INTRODUCCIÓN
Las úlceras de las extremidades inferiores representan una afección con incidencia y prevalencia elevada cuya cronicidad y persistencia en hacer recidivas son dos de las características evolutivas más relevantes, por lo que producen una disminución en la calidad de vida de los pacientes afectados.1 A pesar de un tratamiento etiológico correcto, y a la utilización de una gran variedad de apósitos disponibles, el porcentaje de curación y la velocidad de cicatrización siguen siendo bajos. Esta realidad plantea la necesidad de desarrollar nuevos tratamientos, que de ser más eficaces, permitirán un tratamiento más adecuado de los pacientes, al hacer posible una cicatrización más rápida de aquellas lesiones que, por su cronicidad y tamaño, son más difíciles de tratar.
Los recientes avances alcanzados, tanto en el conocimiento de la biología de las heridas crónicas como en las nuevas técnicas para el cultivo de las células “in vitro” mediante la Ingeniería de Tejidos, han permitido el desarrollo de nuevos procedimientos terapéuticos con los cuales se han logrado avances muy significativos. Las nuevas técnicas permiten el aislamiento y el cultivo de las células de la piel a partir de pequeños fragmentos de este órgano. Las muestras son procesadas para seleccionar y amplificar los queratinocitos “in vitro”, lo cual permite producir láminas de células sobre una matriz; se crean así los equivalentes cutáneos que son trasplantados en las lesiones de la piel.
Estas técnicas fueron desarrolladas inicialmente por Rheinwald y Green en 1975, quienes crearon el primer método para aislar y cultivar las células de la piel de forma eficiente y lograron obtener las primeras láminas de queratinocitos para el trasplante en pacientes con lesiones de la piel.2 Con su trabajo probaron que las células epidérmicas se pueden utilizar de forma exitosa al aislarlas y cultivarlas, pues producen suficiente material de injerto para tratar diferentes lesiones y anomalías que pueden ocurrir en la piel. Dentro de ellas destacan, por su incidencia y extensión, las lesiones ocasionadas por quemaduras,3 pero también son tratadas exitosamente las ulceras crónicas,4 la epidermólisis,5 y los defectos en la mucosa oral.6 Es también relevante su aplicación en la cirugía reconstructiva y estética, en las que su uso es cada vez más amplio y necesario.7
Para que esta técnica pueda funcionar y aplicarse correctamente se requiere de una base dérmica que sea un soporte de base idóneo para que los queratinocitos alcancen una gran expansión, se organicen y ocurra su diferenciación, lo cual formará los equivalentes cutáneos. Una vez que son producidos, es también necesario que se puedan manejar de forma fácil y segura, de tal forma que clínicamente puedan ser trasplantados de forma rápida, apropiada y precisa.8
Dada la importancia fundamental del sustrato para la expansión de los queratinocitos, su diferenciación y la obtención adecuada de láminas para su trasplante rápido y efectivo, en esta investigación se ha modificado la técnica para optimizar tal substrato. A tal fin, basados en las técnicas de Rheinwald y Green, se desarrolló y evaluó un modelo para la producción de un equivalente cutáneo que presenta una alta tasa de expansión celular y hace posible una fácil manipulación y aplicación sobre las lesiones.9
Este equivalente cutáneo optimizado permite la siembra directa de los queratinocitos sobre un gel de fibrina y fibroblastos que, por su arquitectura y sus componentes, favorece la tasa de expansión celular. Tal soporte es muy efectivo, de fácil manipulación para su injerto y un tratamiento capaz de mejorar las diferentes enfermedades de la piel. El presente estudio tiene como objetivo evaluar el beneficio del equivalente cutáneo basado en el crecimiento de queratinocitos sobre un soporte de fibrina y fibroblastos en úlceras vasculares crónicas rebeldes a tratamientos convencionales.
MÉTODOS
Estudio clínico preliminar realizado en el Hospital Clínico Universitario de Caracas, Venezuela.
Se seleccionaron seis pacientes que presentaban: 1) lesiones crónicas de larga evolución 2) fracaso en el proceso de cicatrización por ser úlceras rebeldes tras el tratamiento ambulatorio 3) ausencia clínica y bacteriológica de infección bacteriana.
Se obtuvo el consentimiento informado de cada paciente. Una vez cumplidos estos criterios de selección, la comisión de ética del Hospital Clínico Universitario de Caracas autorizó la realización clínica de este estudio.
Los seis pacientes seleccionados tenían una edad media de 51 años dentro de un intervalo de 37 y 65 años; de ellos tres eran de sexo femenino y tres de sexo masculino. Uno de los pacientes masculinos presentaba la amputación de la pierna izquierda, en cuyo muñón presentaba una úlcera crónica de larga evolución. Todos los pacientes presentaban los criterios de selección mencionados anteriormente. Una vez incluido cada paciente en el estudio, se siguió un protocolo que incluía la historia clínica en la que constaban todos los datos pormenorizados referentes al paciente y su estado físico, así como todo lo referente a la úlcera: tiempo de evolución, tratamiento previo, aspecto del lecho y bordes, resultado de los cultivos, fecha de la colocación de los equivalentes cutáneos, área inicial de la úlcera y su evolución, incluyendo fotografías semanales.
Elaboración de los equivalentes cutáneos
Cumplidos todos lo requisitos y seleccionados los pacientes, se inició la elaboración de los equivalentes cutáneos, cuyo procedimiento fue el siguiente:
- Obtención de las células para el cultivo
Los queratinocitos y los fibroblastos fueron obtenidos para su cultivo a partir de biopsias de piel humana colectadas asépticamente de donantes sanos sometidos a cirugías estéticas, con su respectivo consentimiento informado. A los donantes se les practicó los correspondientes análisis serológicos preoperatorios. Los queratinocitos fueron cultivados con células 3T3-J2, las cuales, previamente, fueron inactivadas mediante un tratamiento por dos horas con mitomicina a una concentración de 4µg/ml. El medio nutritivo fue una mezcla de D-MEM y Ham-F12 en una proporción 3:1, fue suplementado con 10 % de suero fetal de ternera (Gibco), insulina (5µg/ml), hidrocortisona (0,4 µg/ml), triiodotironina (1,3 µg/ml), toxina colérica (8ng/ml), adenina (24 µg/ml), penicilina (100 u/ml) y estreptomicina (100 µg/ml). El medio fue cambiado cada tres días, habiendo añadido, después del primer cambio, el factor de crecimiento epidérmico (EGF, 10 ng/ml). Los fibroblastos usados para la matriz de soporte fueron cultivados en medio D-MEM suplementado con 10 % de suero fetal de ternera.
- Preparación del gel de fibrina y elaboración de los equivalentes cutáneos
Las láminas de fibrina se prepararon a partir de plasma humano mezclando 12-16 mg de fibrinógeno con 800-1200 fibroblastos/cm2, 1 ml de cloruro de calcio al 1 % en suero fisiológico, ácido tranexámico a una concentración de 0, 66 mg/ml de gel y solución fisiológica. El gel se incubó por dos horas a 37ºC en una atmósfera de 5 % de CO2 hasta alcanzar la solidificación. Los queratinocitos del cultivo primario fueron sembrados sobre el gel de fibrina en ausencia de células 3T3, cultivándolos con medio nutritivo especial para los queratinocitos. El crecimiento fue observado periódicamente por medio de un microscopio invertido y al alcanzar la confluencia, el gel fue revestido con un tul de las mismas dimensiones de la capa de células formada, fue desprendido del fondo del frasco manualmente, sin necesidad de tratamiento enzimático para obtener finalmente el equivalente cutáneo.9
Protocolo de trabajo
Una vez obtenidos los equivalentes cutáneos se procedió al tratamiento de los seis pacientes seleccionados; se comenzó con la colocación de cada equivalente directamente sobre la lesión de cada uno de ellos, se inmovilizó y protegió cada transplante mediante un vendaje de gasa estéril. Este procedimiento fue repetido una vez por semana, junto a una evaluación continua de cada paciente para monitorear el estado de la lesión, el estado y efecto de cada injerto, posibles infecciones y la limpieza del exceso de exudado, todo lo cual permitiría revelar si ocurría o no rechazo. Antes de colocar cada nuevo injerto, al retirar el viejo se realizaba un control estricto examinando la lesión y región del tratamiento y se hacia un registro fotográfico para apreciar el proceso de cicatrización y medir la reducción del área de cada lesión. El número de injertos colocados estaría dado por la evolución de la lesión. Se estableció que si después de cuatro a seis injertos no se observaba ninguna respuesta positiva, el tratamiento debería ser suspendido.
RESULTADOS
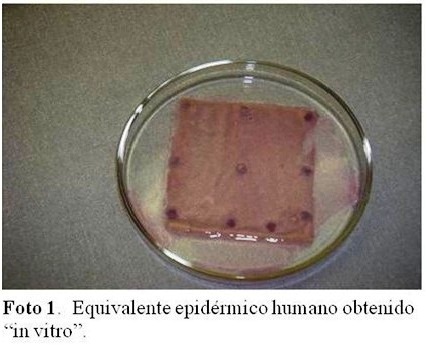
El procedimiento se inició mediante la obtención de la muestra de piel normal y su expansión “in vitro”, con el fin de obtener los equivalentes cutáneos, al cabo de 25 días de cultivo. (Figura 1).
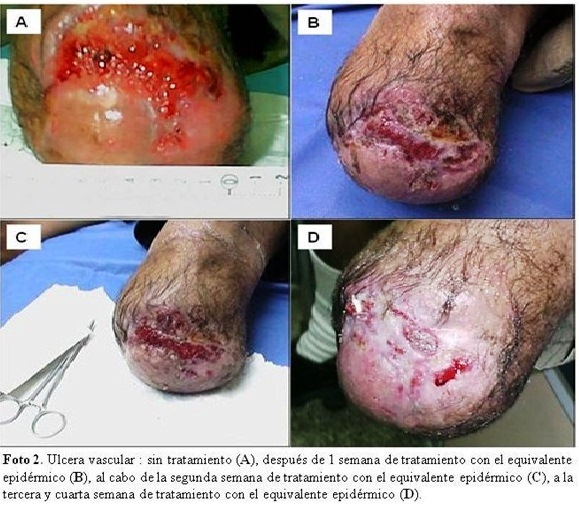
De los seis pacientes que iniciaron el tratamiento, dos abandonaron voluntariamente el ensayo después de realizarse el primer injerto, sin que dieran una causa justificada para tal decisión personal. De los cuatro pacientes que siguieron el tratamiento, uno de ellos es ejemplo resaltante para mostrar los rápidos afectos reparadores que se observan al usarse los equivalentes cutáneos al producir la curación de una forma rápida y efectiva. El paciente, de 37 años de edad, sexo masculino, amputado a nivel de la rodilla de su pierna izquierda, y con una úlcera refractaria a todo tratamiento convencional, y el cual previamente, durante seis meses recibió tratamientos con apósitos, no habiéndose logrado el cierre de la herida. En este paciente se puede observar en la imagen A de la foto, que la lesión presentaba un tejido granuloso desigual, bordes irregulares y trasudado profuso. Ante el fracaso de todos los tratamientos convencionales, al paciente le fueron aplicados equivalentes cutáneos como nueva opción terapéutica. Se le colocó el primer implante y al cabo de una semana se observó un tejido de granulación uniforme con trasudado profuso, como se ve en la imagen B. Se aplicó un segundo equivalente y luego de finalizar la segunda semana se observó que la lesión presentaba bordes planos y migración centrípeta de un tejido cicatricial hacia el centro de la herida, como se puede ver en la imagen C. Con el tercero y cuarto equivalente se pudo percibir que la herida fue disminuyendo de tamaño hasta su cierre completo y sin ningún signo de trasudación, como se puede observar en la imagen D de la foto. El paciente se recuperó totalmente, sin presentar en el tiempo signos de recidiva, considerándose que había alcanzado la cicatrización completa y definitiva de la lesión crónica existente en el sitio de la amputación. (Figura 2 A, B, C y D).
La evolución del resto de los pacientes fue la esperada con este tipo de procedimiento, respondieron todos al tratamiento con los implantes. Dos de los pacientes tratados, como consecuencia de que el tamaño de la úlcera era muy grande, mayor de 50 cm2, además de la condición de ser úlceras con lesiones crónicas de larga data, presentaban lechos muy atróficos para que el tratamiento con los equivalentes funcionaran bien, por lo que fue necesario una limpieza inicial de la herida para retirar el tejido fibroso y necrótico, y de esta manera crear un ambiente optimo para recibir el trasplante. Esto hace que las células del equivalente puedan actuar induciendo la regeneración de las células del borde de la úlcera de la piel del paciente.
DISCUSIÓN
La estructura de la piel presenta una menor complejidad que otros órganos, su remplazo por medio de equivalentes cutáneos desarrollados “in vitro” representan una alternativa que asegura un alto porcentaje de éxito en la mayoría de los casos.10,11 El tratamiento mediante equivalentes cutáneos produce una cicatrización casi inmediata de la lesión crónica rebelde a todo tratamiento convencional, como lo constató la respuesta de los pacientes tratados, dentro de los cuales el ejemplo extremo del caso del paciente amputado expresa las bondades terapéuticas de la técnica descrita. Así, en el caso del paciente con la ulcera desarrollada en la herida de la zona de amputación demuestra las respuestas rápidas y efectivas con equivalentes cutáneos. El mecanismo de cierre de la herida fue por contracción, cierre centrípeto, hecho observado también por otros autores.12 En este caso no se observó integración del injerto dentro del lecho ulceroso. Por otra parte, existe la necesidad, como se reseñó en dos de los casos, que independientemente de las ventajas y bondades que ofrecen los equivalentes dérmicos, se requiere previamente de una limpieza y acondicionamiento de las lesiones crónicas para que las células activas del equivalente cutáneo encuentren un ambiente óptimo que facilite su acción.
Aunque tales mecanismos de acción no se conocen del todo, se infieren tres funciones dinámicas primordiales que pueden actuar y ser fundamentales en este tipo de lesiones al considerar la naturaleza del órgano, tanto física como fisiológica: a) impedir la entrada de gérmenes y evitar la pérdida de líquidos y electrólitos; b) cierre efectivo en el lecho de la herida a través de la interacción con las células del huésped proporcionando una cobertura estable; c) secreción de factores de crecimiento, por parte de las células del equivalente cutáneo, lo cual estimularía las células del huésped que se encuentran en los bordes de la herida. Todo esto, en su conjunto, acelera el proceso de cicatrización regulando el balance entre la síntesis y la degradación de la matriz extracelular, así como la estimulación de la angiogénesis.13,14 De aquí surge la explicación de la necesidad de la limpieza del tejido de la lesión para colocar los implantes en unos tejidos más asertivos para responder a los factores de crecimiento producidos por las células trasplantadas, como lo señalamos en dos de los pacientes.
Este resultado sugiere que este estudio preliminar sobre el uso de los equivalentes cutáneos constituye una alternativa en el tratamiento de las úlceras que por su tiempo de evolución, tamaño y atrofia del lecho ulceroso sean difíciles de tratar. Al probarse que el nuevo equivalente desarrollado es viable, se procederá al estudio en un mayor escalamiento de pacientes para estandarizar, optimizar y validar estadísticamente la implementación de los equivalentes cutáneos para su aplicación clínica. Además, se harán necesario estudios comparativos para valorar tanto la relación costo-eficacia como evaluar con otras formas de injerto de piel y apósitos, todo lo cual reafirmará la eficacia de los tratamientos hechos con las nuevas técnicas que se están desarrollando mediante la ingeniería de tejidos.