INTRODUCCIÓN
En los últimos años, la obesidad y la diabetes mellitus tipo 2 (DM2) se han convertido en un problema de salud pública debido al aumento de casos registrados de ambas enfermedades. La Organización Mundial de la Salud (OMS) reportó un incremento de casi el triple de pacientes desde el año 1975 a la actualidad de la obesidad y un aumento muy similar con DM2 en diferentes grupos etarios.(1)
La Federación Internacional de Diabetes (FID), estableció en la décima edición de su atlas que, en el año 2021 a nivel mundial, 537 millones de personas tenían el diagnóstico de diabetes mellitus (DM) entre los 20 a 79 años.(2) Así mismo se reportaron siete millones de muertes a causa de la DM en 2021 según los datos de la FID, cifras que deberían continuar alarmando a la sociedad.(3)
Su prevalencia en Cuba, en el decenio 2010-2019, tuvo tendencia al incremento de 4,04 % en 2010, a 6,67 % en 2019, siendo más frecuente en las personas del sexo femenino.(4) La provincia de Cienfuegos ocupa el onceno lugar a nivel nacional con la mayor tasa de mortalidad por DM (10,5/100 000 habitantes).(5)
Por su parte, la obesidad es considerada un problema sanitario mundial, debido al mayor riesgo de padecer numerosas enfermedades crónicas, como DM2, hipertensión, enfermedades cardiovasculares, entre otras.(6) Según la OMS en el 2018 alrededor del 39 % de los adultos tenían sobrepeso y un 13 % eran obesos, lo que significa que actualmente se estima que 1400 millones de personas tienen sobrepeso u obesidad, incluidos más de 200 millones de hombres obesos.(7) En Cuba, se observó un rápido aumento del exceso de peso en los últimos años, pues evolucionó de un 35,5 % en 1982 a un 44,3 % en 2019.(8)
La literatura precedente describe ampliamente la asociación del hipogonadismo hipogonadotrópico con la obesidad y/o la DM2, involucrando un extenso espectro de factores neuroendocrinos, vasculares, metabólicos, psicofisiológicos y psicosociales.(9) La obesidad y el sobrepeso corporal se asocian inversamente con los niveles de testosterona. La privación androgénica incrementa la adiposidad y la resistencia a la insulina (IR). De esta manera se entiende que la relación entre estas enfermedades es bidireccional.
Se define el hipogonadismo masculino como el síndrome clínico que resulta de la incapacidad para producir concentraciones fisiológicas de testosterona, cantidades normales de esperma, o ambos y que puede afectar negativamente múltiples funciones orgánicas y la calidad de vida.(10) Se ha encontrado que los hombres diabéticos muestran un riesgo tres veces mayor que sus contrapartes no diabéticas de presentar disfunción eréctil.(11) En Cuba, en un estudio realizado en el Instituto Nacional de Endocrinología (INEN) a 283 varones con DM2, se demostró que la frecuencia de hipogonadismo resultó ser alta, encontrándose en 76,3 % (216 pacientes) de la serie.(12) En la provincia de Cienfuegos no se tiene realizado un estudio específico que relacione el hipogonadismo hipogonadotrópico con la DM2 y obesidad.
Es importante tener en cuenta que el hipogonadismo masculino se asocia de por sí con diferentes manifestaciones que pueden afectar la esfera sexual y la fertilidad, generar problemas con la pareja, traer consigo trastornos depresivos y ansiosos significativos en la persona que lo padece, así como favorecer la aparición de otras enfermedades. Además, es posible que esté relacionado con las enfermedades cardiovasculares y la aterosclerosis, precursores de las enfermedades cardiovasculares. Estos varones también han demostrado tener una leve anemia, baja densidad ósea (costillas y brazos), aumento de la masa adiposa total y subcutánea y disminución de la masa músculo-esquelética.(13)
A pesar de todo ello, en las instituciones de salud, sean estas de atención primaria o secundaria, no se lleva a cabo como rutina la pesquisa de hipogonadismo en diabéticos tipo 2, ni obesos. El problema se exacerba teniendo en cuenta la frecuencia de dichas patologías de base en la actualidad. Teniendo en cuenta todo lo anterior, la presente investigación se plantea los objetivos siguientes: 1. Determinar la frecuencia de aparición de hipogonadismo hipogonadotrópico en pacientes masculinos con diabetes mellitus tipo 2 y obesidad en la provincia de Cienfuegos; 2. Establecer la asociación entre el hipogonadismo hipogonadotrópico con algunas variables sociodemográficas, clínicas y de estilos de vida de los pacientes con diabetes mellitus tipo 2 y obesidad.
MÉTODOS
Se realizó un estudio descriptivo, correlacional, de corte transversal, que tuvo como escenario el Centro de Atención al Diabético, en el Servicio de Endocrinología del Hospital General Universitario Dr. Gustavo Aldereguía Lima, de Cienfuegos, desde abril de 2022 hasta octubre de 2024.
El universo estuvo conformado por los 40 pacientes con diagnóstico previo de DM2 y obesidad, entre 20 y 60 años, sin diagnóstico anterior de hipogonadismo secundario conocido y que firmaron un consentimiento informado previo.
Los datos fueron obtenidos mediante un interrogatorio y examen físico exhaustivos que fueron registrados en un formulario de datos confeccionado para este fin. Se realizaron mediciones antropométricas, auxiliándose de insumos médicos como pesa, tallímetro y cinta métrica. Fueron determinados los valores bioquímicos teniendo en cuenta las medidas apropiadas para su extracción, conservación, transporte y procesamiento de la muestra sanguínea. Las muestras se procesaron en el Autoanalizador Hitachi modelo COBAS 411 del Centro de Atención a la Pareja Infértil del HGAL.
Para la recolección de información adicional se utilizaron fuentes secundarias como historia clínica del paciente. Además de esto, se utilizó como instrumento de recogida de información el Test de A.D.A.M o Cuestionario “Androgen Deficiency in Again Males”, utilizado en varones que tienen riesgo de padecer hipogonadismo. Este cuestionario se diseñó en 1999, en la Universidad de St. Louis Missouri; tiene una sensibilidad del 88 % y una especificidad del 60 %. Consiste en 10 preguntas con respuesta “SI” o “NO” sobre los síntomas del déficit de andrógenos. (Fig. 1).
Las variables estudiadas fueron las siguientes:
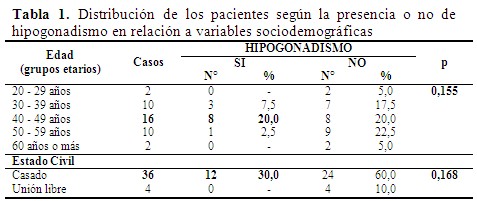
- Edad: 20 a 29 años, 30 a 39 años, 40 a 49 años, 50 a 60 años.
- Estado civil: casado, soltero, viudo, divorciado, concubinato (unión libre).
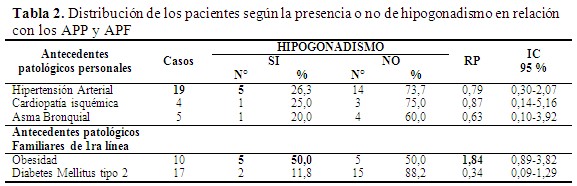
- Antecedentes patológicos personales: hipertensión arterial, asma bronquial, nefropatía, cardiopatía isquémica, otros.
- Antecedentes patológicos familiares de primera línea (padres y/o hermanos): diabetes mellitus tipo 2, obesidad, hipogonadismo.
- Tiempo de evolución de la DM2: hasta 5 años, mayor a 5 años.
- Índice de masa corporal: calculado según la fórmula IMC=Peso(Kg)/Talla(m2) y clasificado teniendo en cuenta los criterios de la OMS.(14)
• Obesidad tipo I: 30-34,9
• Obesidad tipo II: 35-39,9
• Obesidad tipo III (mórbida): ≥40
- Circunferencia abdominal: según la clasificación de la OMS.(15)
• Normal: CA < 102 cm
• Alta: ≥ a 102 cm
- Actividad física: inactiva, activa.(16)
- Hipogonadismo hipogonadotrópico: según los valores de referencia establecidos por el Laboratorio de Atención a la Pareja Infértil del Hospital General Universitario Dr. Gustavo Aldereguía Lima, de Cienfuegos.
FSH à VR: 1,5-12,4 mUl/l
LH à VR: 1,7-8,6 mUl/l
TESTOSTERONA TOTAL:
- 20-49 añosàVR: 2,99-8,36 mg/ml
- 50-60 añosàVR: 1,93-7,40 mg/ml
• Sí tiene hipogonadismo: concentraciones reducidas de testosterona, FSH y LH o concentraciones inapropiadamente normales de gonadotropinas en presencia de testosterona baja.(10)
• No tiene hipogonadismo: concentraciones séricas normales tanto de testosterona, LH y FSH.
- Test de A.D.A.M: según las respuestas se clasifica:
- Patológico: afirmación a la pregunta 1 o 7 o a 3 del resto de las preguntas.
- No patológico: resto de las respuestas
La información obtenida fue procesada en una base de datos empleando el software Statistical Package for the Social Sciences, SPSS (SPSS®, versión 21, Inc.01., Chicago, ILL), el cual permitió aplicar procedimientos de estadística descriptiva y mostrar los resultados en tablas de frecuencia y de relación de variables expresados en número y por ciento.
La comparación de variables cualitativas se realizó a través de la prueba Chi2. La comparación de las variables cuantitativas se realizó con la prueba t de student con un intervalo de confianza de 95 %. Se estudió la asociación entre diferentes factores de riesgo y la presencia o no hipogonadismo hipogonadotrópico, así como la magnitud en que esta se expresó, a través de la medida de asociación razón de prevalencia de exposición, con intervalos de confianza del 95 % de Katz.
Apegándose a principios para la investigación en seres humanos establecidos en la declaración de Helsinki, el estudio se realizó bajo los criterios éticos universales, respetando siempre la integridad y salud del paciente, así como su decisión de ser parte de la investigación.
RESULTADOS
En el periodo estudiado la frecuencia de hipogonadismo hipogonadotrópico en pacientes con DM2 y obesidad fue del 30 %. Al analizar la relación de la presencia del HH con las variables sociodemográficas se encontró una mayor frecuencia en el grupo etario de 40 a 49 años, que representan el 20 %. Además, 90 % de los pacientes estaban casados. La presencia de hipogonadismo no se asoció significativamente con la edad ni con el estado civil (p > 0,05). (Tabla 1).
El antecedente patológico más frecuente en la muestra estudiada fue la hipertensión arterial; sin embargo, no se encontró una asociación estadísticamente significativa entre dichas enfermedades, RP: 0,79 (0,30-2,07). Por su parte, los antecedentes de familiares de 1ra línea con obesidad sí se asociaron significativamente con la presencia de hipogonadismo, RP: 1,84 (0,89-3,82). (Tabla 2).
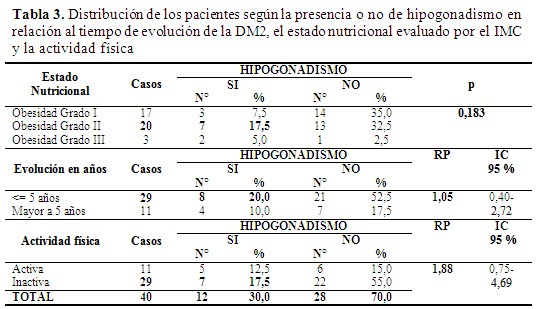
Según la media aritmética, los sujetos con hipogonadismo (5 años; 2,2) presentaban mayor tiempo de evolución de la DM2 que aquellos sin hipogonadismo (3,9; 4,5). El análisis realizado mostró una asociación estadísticamente significativa entre el tiempo de evolución de la DM2 y el HH, con una RP: 1,05 (0,40-2,72). Por otro lado, la mayoría de los sujetos presentaban obesidad grado II. Se encontró que la circunferencia de cintura era mayor a 102 cm en el 100 % de los pacientes y la media del IMC fue mayor en los pacientes con hipogonadismo (36,6 kg/m2) que en aquellos no hipogonádicos (34,8 kg/m2). Sin embargo, no se observó una asociación directa entre presentar un mayor peso, y el hipogonadismo (p= 0,183). Se observó que el 72,5 % de los pacientes estudiados no realizaban actividad física. El 17,5 % de los pacientes con hipogonadismo eran inactivos, y se encontró una relación estadísticamente significativa entre la actividad física y la condición de tener hipogonadismo con un RP: 1,88 (0,75-4,69). (Tabla 3).
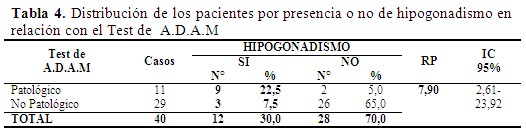
Al aplicar el test de A.D.A.M. se encontró que, de los 12 pacientes con hipogonadismo bioquímico, 9 resultaron “Patológicos” y 3 pacientes resultaron “No Patológicos”. Mientras que solo 2 pacientes sin hipogonadismo bioquímico resultaron “Patológico” al aplicar dicho test. Se halló una asociación estadísticamente significativa entre ambas variables, con un RP: 7,90 (2,61-23,92). (Tabla 4).
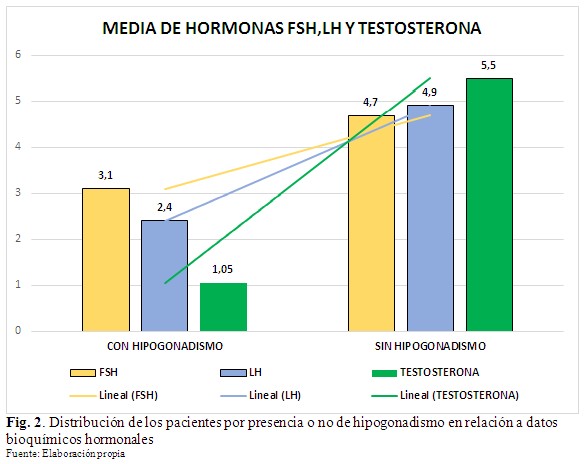
En el gráfico se observa que los hipogonádicos tuvieron una testosterona total media de 1,05 mg/ml (DE ± 0,4), resultando menor que en los pacientes sin hipogonadismo, en los cuales fue de 5,5 mg/ml (DE ± 2,6). De la misma manera la FSH y la LH tuvieron valores promedio inferiores en los pacientes hipogonádicos (3,1 mlU/ml y 2,4 mlU/ml, respectivamente) que en los no hipogonádicos (4,7 mlU/ml y 4,9 mlU/ml respectivamente). La comparación entre las medias aritméticas de los valores de FSH y LH de ambos grupos mediante la prueba t de Student permitió determinar que tienen una diferencia estadísticamente significativa. Los valores promedio totales fueron de 3,3 mg/ml, 3.9 mlU/ml y 3.7 mlU/ml para la testosterona, FSH y LH respectivamente. (Fig. 2).
DISCUSIÓN
La presencia de hipogonadismo masculino en pacientes con DM2 y obesidad trae consigo un estado de inflamación crónica de bajo gasto el cual repercute negativamente en la esfera sexual, psicológica, enfermedades cardiovasculares, tejido muscular, entre otros. Si bien es cierto que la fisiopatología del hipogonadismo en personas con DM2 y obesos aún no está del todo esclarecido, podemos plantear que la acumulación de tejido visceral, la liberación de adiponectinas (FNT-a, IL 6) que son proinflamatorias, la leptina, así como las alteraciones microvasculares y neurológicas producidas por los estados de obesidad e hiperglucemia crónica, interactúan y generan un estado de IR, causante de la disfunción hipotálamo-hipófisis-gonadal, modificando los pulsos de GnRH, gonadotropinas y sexoesteoides y generando así un hipogonadismo hipogonadotropo.
La presente investigación reportó que un tercio de los pacientes estudiados presentaron hipogonadismo hipogonadotrópico. De acuerdo a estudios precedentes, el hipogonadismo masculino es muy frecuente; sin embargo, no todos los pacientes son tratados o diagnosticados a tiempo. Harman y Metter(17) estipulan que solamente el 5 % de los pacientes hipogonádicos reciben tratamiento oportuno, ya que la mayoría no considera este diagnóstico en primera instancia. Como elementos contribuyentes al subdiagnóstico tenemos que se trata de una población de pacientes que, debido a fenómenos culturales, desconocimiento y/o minimización del riesgo para la salud, no siempre acuden a la atención sanitaria ante la presencia de los síntomas. Otra dificultad al respecto es la carencia de las pruebas necesarias en los servicios de salud. Ambos son aspectos de potencial abordaje en proyectos de administración en salud.
La mayor cantidad de hipogonádicos en nuestra investigación se encontraron entre las edades de 40 a 49 años. Este dato concuerda con el estudio realizado por Agudelo Valencia y Montaña López(18) en España, Nueva Granada, donde se estudiaron 20 pacientes obesos y se constató una edad promedio de 44 años en los pacientes con hipogonadismo. Es necesario recalcar que la literatura revisada menciona claramente a la edad como un factor de riesgo que condiciona la disminución de la concentración de andrógenos, lo cual lleva a un hipogonadismo funcional, es decir que ocurre en ausencia de patología estructural intrínseca del eje hipotálamo-hipófisis-gónada.(7) La frecuencia promedio de hipogonadismo funcional es del 40 % a los 40 años y este incrementa un 10 % en cada década siguiente.(11)
En la presente investigación, solo los antecedentes de familiares de primera línea con obesidad se relacionaron estadísticamente con la presencia de hipogonadismo hipogonadotrópico. Existe evidencia de la estrecha relación entre los antecedentes familiares de obesidad, IR, hiperinsulinemia y la expresión del hipogonadismo. Hasta 58 % de los pacientes hipogonádicos presentan un familiar con alguno de los factores de riesgo mencionado anteriormente.(9) Se conoce que la hiperinsulinemia, consecuencia de la IR, lleva al aumento de peso corporal, creándose así un sistema de retroalimentación que conduce a complicaciones como la HTA, hiperlipemia, ateroesclerosis y otras menos consideradas como es el hipogonadismo masculino.
En el presente estudio, 8 pacientes con hipogonadismo tenían entre uno y cinco años de evolución de la DM2, evidenciándose una asociación estadísticamente significativa entre estas dos condiciones. Morales Carrasco et al(19) estiman que más de la mitad de los hombres con DM sufren hipogonadismo, y desarrollan este trastorno 10-15 años antes que la población no diabética. De la misma manera, mencionan que este se exhibe con mucha frecuencia en pacientes con mayor tiempo desde el diagnóstico de DM y en aquellos con complicaciones macro y micro vasculares, asociación que se evidenció en nuestro estudio.
La obesidad grado II predominó en los individuos estudiados, así como la circunferencia de cintura >102 cm en todos ellos. Como resultado de su trabajo, autores como González Jiménez et al(13) en su estudio de 10 varones diabéticos y obesos, concluyen que la correlación entre IMC y testosterona libre no era significativa como tampoco lo fue la correlación entre la DM2 y testosterona libre. En tanto, Enríquez Reyes(20) plantea que el 67 % de los varones obesos tienen hipogonadismo con disfunción sexual consecuente al déficit androgénico. Igualmente, Pinto y Silva,(21) en una revisión sistemática, plantean que el riesgo de hipogonadismo central es ocho veces mayor en hombres con un IMC ≥ 30 kg/m², relacionado con factores como el hiperestrogenismo y la IR.
Por su parte, Corona et al,(22) en un metaanálisis más reciente, en el que se incluyó a un total de 567 pacientes, observó que por cada 5 kilogramos de reducción del peso se producía un aumento de 1 nmol/l en la concentración de testosterona. Las investigaciones destacan que la pérdida de peso, ya sea mediante intervención quirúrgica o medidas conservadoras, puede revertir parcialmente la deficiencia de testosterona y la disfunción sexual, especialmente en personas con DM.(23) Esto sugiere una interconexión entre estas condiciones.
Nuestra investigación mostró una relación significativa entre el hipogonadismo y la inactividad física. Existen publicaciones que sugieren que los hombres con una mejor capacidad de ejercicio aeróbico presentan concentraciones androgénicas más altas. Un estudio con 16 hombres de peso normal y 28 hombres con sobrepeso u obesidad en que se les prescribió un programa de ejercicio aeróbico de 12 semanas, concluyó que las concentraciones séricas de testosterona total, testosterona libre y testosterona biodisponible aumentaron en los hombres con sobrepeso/obesidad, con mejoras significativas en el peso, el IMC y los lípidos.(24) A juicio de Wittert et al.(25) independientemente del peso, el aumento de la aptitud cardiovascular y altos niveles de actividad física se asocian positivamente con concentraciones séricas más altas de testosterona. Estas observaciones son consistentes con los beneficios bien establecidos de la actividad física para mejorar la IR, las anomalías metabólicas asociadas a la obesidad y la inflamación independientemente de un cambio en el peso general.
El diagnóstico clínico del hipogonadismo es difícil, ya que la sintomatología que muchos autores plantean es multifactorial. En el año 1999, en la Universidad de St. Louis Missouri, se diseñó un cuestionario para la búsqueda clínica de deficiencia androgénica y en el año 2000 Morley(26) publica y valida el cuestionario más utilizado en la actualidad para diagnóstico clínico de hipogonadismo, el test de A.D.A.M. Amplios estudios previos se han realizado, como el de Baltimore,(17) en donde se utiliza dicho cuestionario y se encuentra una prevalencia elevada de hipogonadismo, con una relación directa que aumenta con la edad de los pacientes. Al aplicar el test de A.D.A.M, nuestro estudio mostró una relación altamente significativa entre el diagnóstico clínico y bioquímico de los pacientes con hipogonadismo hipogonadotrópico, lo cual coincide con otros resultados hallados. Rodríguez Ibarra(27) revela que dicho cuestionario es una herramienta útil de screening con una sensibilidad de 78,6 % y una especificidad de 66,7 %, así como una buena consistencia y validez.
El diagnóstico bioquímico de hipogonadismo hipogonadotrópico es esencial para lograr un diagnóstico preciso. Nuestro estudio mostró una diferencia significativa entre los valores de gonadotropinas de los pacientes de ambos grupos. Similarmente, Obaid et al(28) encontraron que un número significativo de hombres con DM2 tenían testosterona libre total baja y LH y FSH inapropiadamente normales o inferiores a lo normal, y las medias de LH y FSH fueron significativamente más bajas en pacientes diabéticos que en controles (6,61 versus 9,32 U/l, p = 0,001; y 5,12 versus 10,25 U/l, p = 0,001 respectivamente). Otro resultado comparable lo obtuvo Ugwu et al,(29) en cuya investigación los sujetos con hipogonadismo manifiesto tenían niveles significativamente más bajos de FSH y LH que sus contrapartes eugonadales.
Aunque los resultados de la presente investigación no coincidieron en algunos aspectos con los estudios previamente citados, esto puede ser debido al tamaño muestral reducido u otros factores influyentes y no al efecto bidireccional de la fisiopatología de estas enfermedades crónicas, que tienen como factor común la presencia de IR.
Un tercio de los pacientes estudiados presentaron hipogonadismo hipogonadotrópico, condición que estuvo relacionada directamente con el mayor tiempo de evolución de la DM2, la inactividad física, así como con la presencia de obesidad en familiares de primer grado. Por otro lado, es evidente que el test de A.D.A.M. es una herramienta de notable sensibilidad clínica, dado que en el estudio actual se observó una correlación significativa con el diagnóstico bioquímico de hipogonadismo hipogonadotrópico.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Contribuciones de los autores
Conceptualización: Miguel Orlando Martínez, Annia Quintana Marrero, Elodia Rivas Alpízar.
Curación de datos: Miguel Orlando Martínez, Amanda Avello Rodríguez, Annia Quintana Marrero.
Análisis formal: Miguel Orlando Martínez, Annia Quintana Marrero, Elodia Rivas Alpízar.
Investigación: Miguel Orlando Martínez, Amanda Avello Rodríguez, Annia Quintana Marrero.
Metodología: Miguel Orlando Martínez, Elodia Rivas Alpízar, Jan O´Neil González Ramos, Amanda Avello Rodríguez.
Validación: Annia Quintana Marrero, Elodia Rivas Alpízar, Jan O´Neil González Ramos.
Redacción del borrador original: Miguel Orlando Martínez, Amanda Avello Rodríguez, Annia Quintana Marrero.
Redacción-revisión y edición: Miguel Orlando Martínez, ERA, Jan O´Neil González Ramos.
Financiación
Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos, Cuba.
REFERENCIAS BIBLIOGRAFICAS
1.de la Vega D, Morquecho Nava J, Isidro-Pérez O, Ramírez-Girón N. Análisis del concepto" Diabesidad". Index de Enfermería[Internet]. 2022[citado 15/05/2024]; 1(4):289-93. Disponible en: https://scielo.isciii.es/scielo.php?pid=S1132-12962022000400011&script=sci_arttext
2.Mina Rivera M. Perfil epidemiológico y clínico de los pacientes diagnosticados con diabetes mellitus tipo 2 en el Centro de Salud el Álamo, Nivel I-3, desde el año 2019 al 2021[Tesis]. Lima: Universidad Nacional Federico Villarreal; 2022[citado 15/05/2024]. Disponible en: https://repositorio.unfv.edu.pe/handle/20.500.13084/6370
3.Canal Diabetes. Siete millones de muertes a causa de la diabetes en el 2021. Valencia: Canal Diabetes; 2022[updated @2024 31 de marzo]. Disponible en: https://canaldiabetes.com/muertes-a-causa-de-la-diabetes/.
4.Revueltas Agüero M, Benítez Martínez M, Molina Esquivel E, Hinojosa Álvarez MC, Venero Fernández S, Hernández Sánchez M. Prevalencia y mortalidad por diabetes en Cuba, decenio 2010-2019. Rev Haban Ciencias Médicas[Internet]. 2022 [citado 16/09/2024];21(1):e4239. Disponible en: http://scielo.sld.cu/scielo.php?pid=S1729-519X2022000100010&script=sci_arttext.
5.Ministerio de Salud Pública, Dirección de Registros Médicos y Estadísticos en Salud. Anuario Estadístico de Salud[Internet]. La Habana: MINSAP; 2021[citado 20/09/2022]. Disponible en: https://salud.msp.gob.cu/wp-content/Anuario/Anuario-2020.pdf.
6.Velasco Súarez CM, Rueda Benavides NJ, Hernández Sarmiento CJ, Gómez Ayala JA. Obesidad: fisiopatología y tratamiento. Revisión de la literatura. Médicas UIS[Internet]. 2023[citado 10/04/2024];36(3):89-104. Disponible en: https://revistas.uis.edu.co/index.php/revistamedicasuis/article/view/14913.
7.Rabijewski M. Male-specific consequences of obesity—functional hypogonadism and fertility disorders. Endokrynologia Polska[Internet]. 2023[citado 10/08/2024]; 74(5):480-9. Disponible en: https://journals.viamedica.pl/endokrynologia_polska/article/view/95626.
8.Rivas Estany E, de la Noval García R. Obesidad en Cuba y otras regiones del Mundo. Consideraciones generales y acciones nacionales de prevención. Anales de la Academia de Ciencias de Cuba[Internet]. 2021[citado 16/09/2024];11(1):1-5. Disponible en: http://scielo.sld.cu/scielo.php?pid=S2304-01062021000100023&script=sci_arttext.
9.Mejia-Montilla J, Reyna-Villasmil N, Fernández-Ramírez A, Reyna-Villasmil E. Obesidad, insulinorresistencia y riesgo de enfermedades asociadas. Rev Venez Endocrinol Metabol[Internet]. 2023[citado 20/05/2024];21(2):64-73. Disponible en: https://www.svemonline.org/wp-content/uploads/2023/08/RVEM.-Vol.-21-No.-2-Ano-2023.pdf#page=8
10.Melmed S, Koening RJ, Auchus RJ, Rosen CJ, Goldfine AB. Williams Tratado de Endocrinología. Barcelona: Elsevier, Inc.; 2021[citado 03/07/2024]. Disponible en: https://booksmedicos.org/williams-tratado-de-endocrinologia-14a-edicion/.
11.Gouda SI, Aboelnaga MM, Elbeltagy AM, Elbaz A. Testosterone deficiency in non-obese type 2 diabetic male patients. Arch Ital Urol Androl. 2022;94(4):464-469.
12.Peña GM, Romero MH, Alzugaray MG, Carballo GO. Tratamiento con testosterona en el hipogonadismo de inicio tardío. Rev Cubana Endocrinol [Internet]. 2020[citado 20/08/2024];31(2):[aprox. 12 p.]. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=100603
13.González Jiménez OM, Barrios Machain UA, De Oliveira Rotela MS, Caballero Ydoyaga MA, Caffarena Ramírez MA. Niveles de testosterona libre en pacientes del sexo masculino con diabetes mellitus tipo 2. Rev Virtual Soc Parag Med Int[Internet]. 2016[citado 20/08/2024];3(1):60-4. Disponible en: http://scielo.iics.una.py/scielo.php?script=sci_arttext&pid=S2312-38932016000100007
14.Roca Reina Z, Lozano Casanova M, Martínez Sanz JM, Gutiérrez Hervás A, Hurtado-Sánchez JA, Sospedra I. Diagnóstico y clasificación del sobrepeso y la obesidad: comparación de criterios. International Journal of Kinanthropometry [Internet]. 2022[citado 20/08/2024];2(1):2-12. Disponible en: http://ijok.org/index.php/ijok/article/view/25.
15.Loaiza Dávila LE, Jiménez Ruiz LA. Relación entre el IMC, circunferencia abdominal y el riesgo de enfermedades cardiovasculares en estudiantes universitarios por grupos de género. DATEH Revista Multidisciplinaria de Desarrollo Agropecuario, Tecnológico, Empresarial, y Humanista[Internet]. 2023 [citado 18/03/2024];5(3):36-45. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=9181062.
16.Martínez-Gómez D, Martínez de Haro V, Pozo T, Welk GJ, Villagra A, Calle ME, et al. Fiabilidad y validez del cuestionario de actividad física PAQ-A en adolescentes españoles. Rev Esp Salud Pública[Internet]. 2009[citado 18/03/2024]; 83:427-39. Disponible en: https://www.scielosp.org/pdf/resp/2009.v83n3/427-439/es.
17.Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR. Longitudinal effects of aging on serum total and free testosterone levels in healthy men. J Clin Endocrinol Metab. 2001;86(2):724-31.
18.Agudelo Valencia N, Montaña López JA, García Linares J. Asociación entre obesidad y niveles de testosterona en los pacientes que asisten al servicio de endocrinología del Hospital Militar Central[Trabajo de grado]. Nueva Granada: Universidad Militar Nueva Granada; 2016.
19.Morales Carrasco AP. Panorama clínico de la disfunción sexual en pacientes con diabetes mellitus. Salud (i) ciencia. 2020;23(8):655-6.
20.Enríquez-Reyes R. Obesidad: epidemia del siglo XXI y su relación con la fertilidad. Revista Médica Clínica Las Condes. 2021;32(2):161-5.
21.Pinto JC, da Costa RS. Hipogonadismo masculino e sua relação com a sindrome metabólica. Revista FOCO. 2024;17(1):e4147-e
22.Corona G, Rastrelli G, Morelli A, Sarchielli E, Cipriani S, Vignozzi L, et al. Treatment of functional hypogonadism besides pharmacological substitution. World J Mens Health. 2020l;38(3):256-70.
23.Bermeo González DE. Impacto de la cirugía bariatrica en la función sexual en pacientes con obesidad[Tesis]. Cuenca: Universidad Católica de Cuenca; 2024[citado 18/03/2024]. Disponible en: https://dspace.ucacue.edu.ec/items/25eefb90-5f53-4c73-a636-54370aa29b17
24.Ismail AMA, Abdelghany A, Atef H. Response of testosterone and semen parameters to a 14-week aerobic training in sedentary obese men with hyperglycaemia. Physiotherapy Quarterly[Internet]. 2023[citado 20/09/2024]; 31(1):28-33. Disponible en: https://physioquart.awf.wroc.pl/Response-of-testosterone-and-semen-parameters-to-a-14-week-aerobic-training-in-sedentary,132005,0,2.html.
25.Wittert G, Grossmann M. Obesity, type 2 diabetes, and testosterone in ageing men. Rev Endocr Metab Disord. 2022;23(6):1233-42.
26.Morley JE, Charlton E, Patrick P, Kaiser F, Cadeau P, McCready D, et al. Validation of a screening questionnaire for androgen deficiency in aging males. Metabolism[Internet]. 2000[citado 20/09/2024];49(9):1239-42. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0026049500259647.
27.Rodríguez Ibarra F. Validación del cuestionario de ADAM para la detección de hipogonadismo en pacientes varones con VIH. Revista Ciencia e Investigación [Internet]. 2019[citado 20/09/2024];4(2):28-35. Disponible en: https://zenodo.org/records/3240658
28.Obaid A, Kadhim HI, Rahmah AM. The association of hypogonadism with type 2 diabetes mellitus and obesity. Teikyo Medical Journal[Internet]. 2022[citado 20/09/2024];45(1):5699-706. Disponible en: https://www.teikyomedicaljournal.com/article/the-association-of-hypogonadism-with-type-2-diabetes-mellitus-and-obesity.
29.Ugwu TE, Ikem RT, Kolawole BA, Ezeani IU. Clinicopathologic assessment of hypogonadism in men with type 2 diabetes mellitus. Indian J Endocrinol Metab. 2016;20(5):667-73.