INTRODUCCIÓN
La hipertensión arterial (HTA) representa un desafío global para la Salud Pública. Su prevalencia se encuentra en aumento y sus mecanismos fisiopatológicos aún no están dilucidados del todo.(1) En las últimas décadas, ha ganado relevancia el concepto de los orígenes tempranos de la enfermedad, conocido como programación del desarrollo. Este enfoque sugiere que la exposición a factores adversos durante etapas críticas del desarrollo intrauterino o posnatal temprano, incrementa el riesgo de enfermedades crónicas en la vida adulta, como la HTA.(2)
Se consideran factores adversos para el desarrollo intrauterino la desnutrición materna, la disfunción placentaria, la hipoxia, el estrés materno (ambiental, emocional o fisiológico), los cambios en la microbiota, la privación del sueño, así como, la exposición a glucocorticoides, nicotina o alcohol. Estos factores desencadenan respuestas adaptativas, que priorizan la supervivencia fetal a costa de alterar la maduración de estructuras, como: el riñón, el corazón y el sistema vascular.(3) Aunque se han identificado alteraciones estructurales y funcionales asociadas a este proceso, su vínculo preciso con la patogénesis de la HTA es un campo de investigación activo.(4)
El riñón constituye el regulador a largo plazo de la presión arterial. Es el único capaz de llevar las cifras de presión arterial hasta sus valores normales. Es por esto que Guyton plantea que, cualquier alteración de la presión arterial de forma crónica debe implicar un cambio en la capacidad excretora hidrosalina del riñón.(5) Se ha documentado que, los individuos sometidos a un ambiente intrauterino adverso presentan un menor número de nefronas al nacer, un defecto irreversible en humanos, debido a la ausencia de nefrogénesis posnatal.(3) Esta reducción desencadena hiperfiltración glomerular compensatoria, lo que acelera la pérdida de la función renal y la HTA en la edad adulta, también se sabe que con el aumento de la edad ocurre una pérdida de nefronas, por obsolescencia y glomeruloesclerosis. Esto pudiera ser mayor en los individuos con un menor número de nefronas al nacer, debido a la hiperfiltración glomerular que presentan(2) sin embargo, investigaciones recientes proponen que otros mecanismos, como las modificaciones tubulares, podrían contribuir a la HTA programada.(6)
El objetivo de esta investigación fue: evaluar el estado morfofuncional renal y su contribución al desarrollo de la hipertensión arterial en descendientes adolescentes de ratas con insuficiencia vascular placentaria
MÉTODOS
Se efectuó un estudio preclínico en ratas Wistar provenientes del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB). El trabajo experimental se realizó en el Laboratorio de Fisiología Renal del Instituto de Ciencias Básicas y Preclínicas Victoria de Girón de la Facultad de Ciencias Médicas de la Universidad de Ciencias Médicas de la Habana, durante los años 2022 y 2023. Todos los protocolos recibieron aprobación previa del Consejo Científico y el Comité Institucional para el cuidado y uso de los animales de laboratorio. Se garantizó el cumplimiento estricto de los estándares éticos nacionales e internacionales vigentes para el manejo, empleo y eutanasia en modelos animales.(7,8)
Sujetos experimentales, mantenimiento e inducción de la preñez
Se emplearon ocho hembras nulíparas de 180 g a 200 g y cuatro machos de 200 g - 270 g. Los animales se alojaron en condiciones controladas de luz y oscuridad (12h cada una) y acceso ad libitum a agua y alimento: peso estándar para roedores producido por el CENPALAB. Tras un período de adaptación de siete días, se procedió al apareamiento nocturno durante las fases de proestro o estro del ciclo estral femenino.(9) La identificación de espermatozoides en el lavado vaginal matutino estableció el día 0 de gestación.
Configuración de los grupos
El día 16 de la gestación, se seleccionaron de forma aleatoria cuatro hembras y se les realizó la ligadura bilateral de las arterias uterinas en su porción distal, con seda quirúrgica 00. El procedimiento se efectuó bajo anestesia con 25 mg/kg intraperitoneal de tiopental sódico, en condiciones asépticas.(10) Las cuatro hembras restantes constituyeron el grupo control, que fue sometido al mismo procedimiento quirúrgico, pero sin la ligadura de las arterias uterinas. Tras el parto espontáneo, se conformaron dos grupos de crías de 16 ejemplares cada uno, selección aleatoria y ambos sexos representados: grupo L, descendientes de ratas con ligadura y grupo C descendientes de ratas sin ligadura.
Variables y procedimientos para su estudio
Se registró el peso corporal neonatal en las primeras 24 horas post-nacimiento con una balanza digital Crystal, (precisión 1 mg). A las nueve semanas del nacimiento, se reevaluó el peso corporal con una balanza Gallenkamp y se midió la presión arterial sistólica y diastólica (sistema CODA).(11) Luego, de cada grupo se escogieron de forma aleatoria ocho crías para determinar el volumen plasmático corporal (VPC), mediante la técnica de dilución de Azul de Evans.(5) En las crías restantes, se evaluó la función renal, mediante la determinación de la tasa de filtración glomerular, estimada por depuración plasmática de inulina(12) y la excreción fraccional de sodio: EFNa+;(5) la cuantificación de sodio se realizó por espectrometría de absorción atómica con llama, con un equipo Philips PU 9100.(13) A continuación, se practicó la eutanasia, por exanguinación cardíaca bajo anestesia profunda. De todos los animales se determinó el peso renal (peso de ambos riñones) y la relación peso renal/peso corporal (balanza Crystal). El riñón izquierdo de siete ratas de cada grupo con estudio de la función renal, se seccionó en sentido sagital; los fragmentos se lavaron (solución salina 0,9 %), se fijaron en formalina neutra tamponada al 10 % y se incluyeron en parafina.
De cada bloque de parafina, se prepararon dos láminas histológicas con tres cortes de 3 µm de grosor cada una (micrótomo Histo-Line con cuchillas de acero), que fueron coloreadas con hematoxilina-eosina y reacción del ácido peryódico de Schiff (PAS) (por sus siglas en inglés). De cada corte se digitalizaron nueve campos, tres de cada zona de la corteza renal (polos renales y zona intermedia), desde el borde de la cápsula renal hasta el límite cortico-medular. Se desecharon aquellos campos poco representativos. Las imágenes se tomaron a 100X y 400X de magnificación, con una cámara digital MOTICAM 3 de 3,0 megapíxeles, acoplada al microscopio Motic BA 210 y el programa Motic de análisis de datos y se guardaron en formato jpg en una computadora Acer.
Para el análisis histológico se seleccionaron estructuras con los límites bien visibles. Se cuantificó el número de glomérulos en nueve campos por animal, a 100X de magnificación, mediante la herramienta de conteo del programa ImageJ. Se calculó el volumen de 20 glomérulos cortados de forma transversal, mediante el método de Weibel,(14) a partir del área glomerular medida a 400X de magnificación con la herramienta de trazado libre del programa ImageJ. En 10 túbulos proximales (diámetro mayor/menor = 1 ± 0,2), se determinó la altura del epitelio como el promedio de las mediciones realizadas en las posiciones horarias 3, 6, 9 y 12, desde la membrana basal hasta el borde del ribete en cepillo, a 400X de magnificación, con la herramienta línea recta del programa ImageJ.
Procesamiento estadístico
Para el procesamiento estadístico se utilizó el programa GraphPadPrism v5.01. La normalidad de las variables se verificó mediante la prueba de Kolmogorov-Smirnov. Las comparaciones entre grupos se realizaron con las pruebas t de Student (variables con distribución normal) y U de Mann-Whitney (variables sin distribución normal). Se asumió una p < 0,05 como diferencia significativa.
RESULTADOS
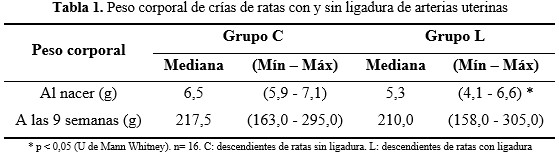
El peso corporal de los descendientes del grupo L, al nacer fue menor, pero no presentó diferencias a las nueve semanas con respecto a los del grupo C. (Tabla 1).
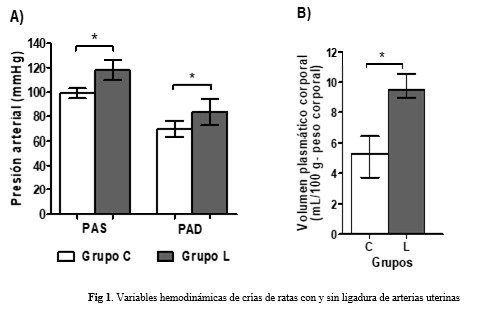
En las crías de nueve semanas de nacidas, descendientes de ratas sin ligadura, Grupo C, n= 8 y Grupo L, n= 6, descendientes de ratas con ligadura, al comprobar las variables hemodinámicas se apreció, que la presión arterial y el VPC fueron mayores en el grupo L, correspondiente a los descendientes de ratas con ligadura. (Fig. 1).
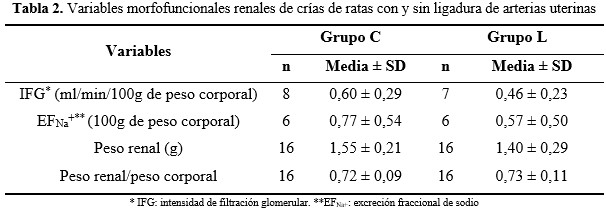
No se encontraron diferencias entre los grupos en el peso renal, la relación peso renal/peso corporal y las variables de función renal. (Tabla 2).
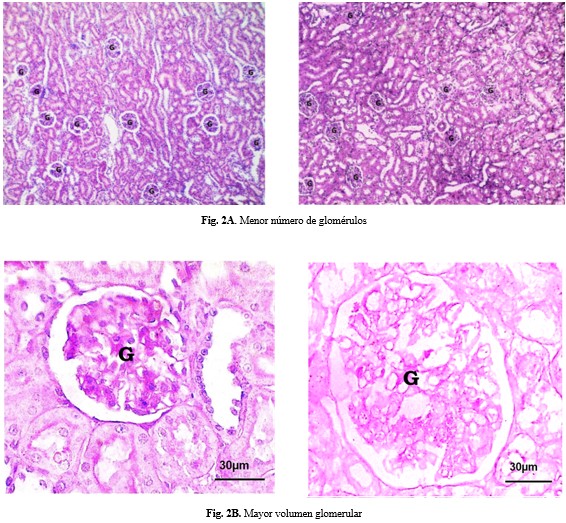
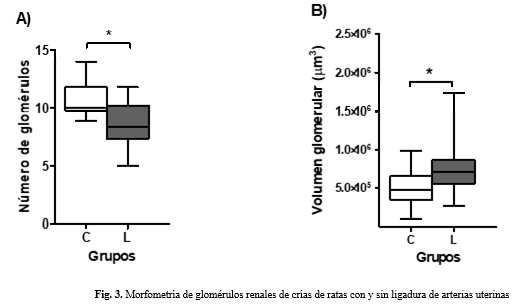
En el estudio histológico cualitativo de la corteza renal se apreció un menor número de glomérulos y mayor volumen glomerular en el grupo L. Fotomicrografías ópticas representativas de los glomérulos renales de crías de ratas con y sin ligadura de arterias uterinas. A) menor número de glomérulos (magnificación 100X) y en B) mayor volumen glomerular (magnificación 400X) en el grupo L. (Figs. 2A y 2B).
Los resultados anteriores fueron corroborados en el estudio morfométrico. (Fig. 3).
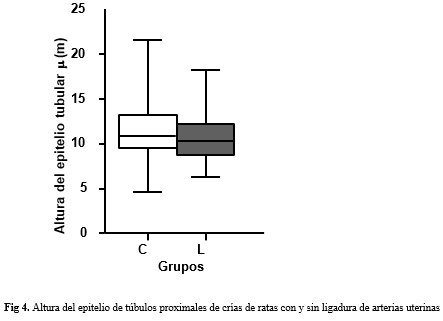
No se encontraron diferencias significativas entre los grupos en cuanto a la altura del epitelio de los túbulos proximales. (Fig. 4).
DISCUSIÓN
El menor peso al nacer en los descendientes de las ratas sometidas a ligadura de las arterias uterinas, corrobora la existencia de un ambiente intrauterino adverso en el biomodelo utilizado, ya que este constituye uno de los marcadores de esta condición.(2) A las nueve semanas del nacimiento, el peso de estos animales fue similar al de sus controles, lo que se corresponde con la posterior ganancia de peso acelerada que se ha descrito tanto en humanos como en animales de experimentación.(15)
La investigación actual es continuación de un estudio realizado en el mismo biomodelo, pero a las tres semanas de nacidas las crías.(6) Similar a lo ocurrido en ese estudio, en las crías de nueve semanas se encontró elevada la presión arterial, tanto sistólica como diastólica. Este resultado pudiera estar relacionado con el mayor VPC de los animales y es coherente con la teoría de Guyton sobre el papel dominante del riñón y el manejo de volumen en la hipertensión crónica.(5) Un VPC elevado, aumenta la precarga cardiaca y el gasto cardíaco, lo que ejerce una presión sostenida sobre las paredes arteriales y contribuye de forma directa a incrementar la presión arterial media.
Los resultados confirman la existencia de menor número de glomérulos y mayor volumen glomerular en las crías a las nueve semanas de nacidas. Esto refuerza el modelo de nefropatía por reducción de nefronas e hiperfiltración compensatoria en las nefronas remanentes, descrito por Brenner(2) y observado en el biomodelo a las tres semanas de nacidos los animales.(6) La hipertrofia glomerular persistente es un sello distintivo de adaptación inicial, que se convierte en un factor patogénico a largo plazo. La hiperfiltración sostenida conlleva estrés hemodinámico y mecánico sobre los capilares glomerulares, que predispone a esclerosis glomerular y pérdida progresiva de la función renal con el envejecimiento, lo que estaría incrementado en individuos con un bajo número de nefronas congénito.(2)
Los hallazgos actuales aportan perspectivas críticas sobre la transición de los ajustes renales iniciales en el biomodelo utilizado hacia un fenotipo hipertenso establecido. Una diferencia con lo observado en las crías a las tres semanas de nacidas con el presente estudio, es la ausencia de hipertrofia tubular a las nueve semanas. Esta discrepancia sugiere que la hipertrofia tubular temprana(6) podría representar una respuesta adaptativa transitoria a la sobrecarga inicial de solutos derivada de la hiperfiltración glomerular. A las nueve semanas, otros mecanismos compensatorios a nivel tubular, que pudieran ser neurohormonales o de transporte más eficientes, podrían suplantarlas adaptaciones estructurales, además, la hipertrofia tubular inicial pudiera preceder a cambios atróficos no evaluados en el presente estudio, no obstante, la normalidad morfológica tubular no implica normalidad funcional. La persistencia de valores elevados de presión arterial y VPC sin hipertrofia tubular en las crías de las ratas con ligadura de las arterias uterinaa las nueve semanas de nacidas, apunta a una alteración funcional en la reabsorción tubular de sodio y agua. La teoría de Guyton predice que la HTA crónica esencial requiere un desplazamiento de la curva de excreción de sodio por el riñón, por lo que se normaliza la excreción, pero a una presión arterial más alta.(5)
Los resultados del estudio sugieren que el riñón de la rata sometida a un ambiente intrauterino adverso por insuficiencia vascular placentaria, en la adolescencia mantiene un balance sódico neutral a expensas de una presión arterial elevada. Los mecanismos exactos requieren investigación futura, pero su efecto neto sería una reabsorción aumentada de sodio, que sostiene la expansión de volumen plasmático y la HTA, incluso, sin hipertrofia tubular proximal detectable. Lo anterior subraya la plasticidad de las respuestas adaptativas renales a lo largo del tiempo y la complejidad de la programación del desarrollo
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Contribución de los autores:
1- Conceptualización: Adina Pérez Mejías, Tammy Fernández Romero, Mailin Claxton Louit.
2- Curación de datos: Adina Pérez Mejías, Mailin Claxton Louit.
3- Análisis formal: Adina Pérez Mejías, Tammy Fernández Romero, Mailin Claxton Louit, Melvis Taylín Zumeta Dubé.
4- Adquisición de fondos: Adina Pérez Mejías.
5- Investigación: Adina Pérez Mejías, Tammy Fernández Romero, Mailin Claxton Louit, Melvis Taylín Zumeta Dubé.
6- Metodología: Adina Pérez Mejías, Mailin Claxton Louit, Melvis Taylín Zumeta Dubé.
7-Administración del proyecto: Adina Pérez Mejías.
8- Supervisión: Tammy Fernández Romero.
9- Redacción del borrador original: Adina Pérez Mejías, Mailin Claxton Louit.
10- Redacción, revisión y edición: Tammy Fernández Romero, Melvis Taylín Zumeta Dubé.
REFERENCIAS BIBLIOGRÁFICAS
1- Organización Mundial de la Salud. World health statistics 2023: monitoring health for the SDGs, sustainable development goals[Internet]. Ginebra:OMS;2023[citado 24/3/24]. Disponible en: https://iris.who.int/server/api/core/bitstreams/eaa4a7b3-2dd2-4e0a-984e-fc4f8c5553fd/content.
2- Luyckx V, Moritz K, Bertram J. Programación del desarrollo de la presión arterial y la función renal a lo largo de la vida. En: Alan S, Chertow GM, Luyckx V, Marsden PA, Skorecki K, Taal MW. Brenner y Rector El riñón. 11na ed. Barcelona:Elsevier Health Sciences;2021. p. 667-709.
3- Iturzaetaa A, Tejeirab MMS. Programación temprana de la hipertensión arterial. Arch Argen Pediatr[Internet]. 2022[citado 23/12/23];120(1):[aprox. 8p.]. Disponible en: https://www.sap.org.ar/docs/publicaciones/archivosarg/2022/v120n1a10.pdf.
4- Ushida T, Cotechini T, Protopapas N, Atallah A, Collyer C, Toews AJ, et al. Aberrant inflammation in rat pregnancy leads to cardiometabolic alterations in the offspring and intrauterine growth restriction in the F2 generation. Journal Developmental Origins Health Disease. 2022;13(6):706-18.
5- Guyton AC, Hall JE. Tratado de Fisiología Médica[Internet]. Barcelona:Elsevier Saunders;2021[citado 17/7/2024]. Disponible en: https://www.uk.elsevierhealth.com/catalogsearch/result/?filter_product_type=78&q=9788413820132.
6- Pérez A, Caraballo D, González L, Fernández T. Estado morfofuncional renal y su contribución a la hipertensión arterial en ratas con bajo peso al nacer. Rev Cubana Invest Biomed[Internet]. 2025[citado 3/1/26];44(1):[aprox. 3p.]. Disponible en: https://revibiomedica.sld.cu/index.php/ibi/article/view/3473.
7- Underwood W, Anthony R. AVMA guidelines for the euthanasia of animals: 2020 edition[Internet]. Schaumburg:AVMA;2020[citado 24/3/24]. Disponible en: https://www.spandidos-publications.com/var/AVMA_euthanasia_guidelines_2020.pdf.
8- Gaceta Oficial República Cuba. Decreto-Ley 31/2021 De Bienestar Animal. Gaceta Oficial 25(Ext)[Internet]. La Habana:GOC;2021[citado 24/3/24]. Disponible en: https://www.gacetaoficial.gob.cu/sites/default/files/goc-2021-ex25-.pdf.
9- Fernández T, Suárez G, Clapés S. Protocolo para la citología vaginal directa de ratas de laboratorio. Rev Haban Cienc Méd[Internet]. 2021[citado 30/3/22];20(3):[aprox. 5p.]. Disponible en: https://www.revhabanera.sld.cu/index.php/rhab/article/view/4086.
10- Alfonso C, Tomé O. Obtención experimental de crías con crecimiento intrauterino retardado. Rev Cubana Cienc Vet[Internet]. 2000[citado 24/3/24];26(1):[aprox. 2p.]. Disponible en: https://scielo.sld.cu/scieloOrg/php/articleXML.php?pid=S0864-03002006000400006&lang=es.
11- Andika M, Humaira V, Yesika R. Effects of Bisoprolol on Decreased Blood Pressure of Systole in Male White Rats Hypertension and Hypertension with Complications of Liver Dysfunction. IJPSM. 2022;7(2):1-6.
12- Schreiner GE. Determination of Inulin by Means of Resorcinol. Proceedings of the Society for Experimental Biology and Medicine. Med. 1950;74(1):117-20.
13- Fisher A. Atomic Spectrometric Methods of Analysis. Londres:Royal Society of Chemistry;2025.
14- Lane PH, Steffes MW, Mauer SM. Estimation of glomerular volume: A comparison of four methods. Kidney International. 1992;41(1):1085-9.
15- Durá T, San Martín I, Gallinas F, Chueca MJ, Berrade S. Catch-up growth and associated factors in very low birth weight infants. An Pediatr. 2020;93(5):282-8.