INTRODUCCIÓN
El virus del papiloma humano (VPH) representa una de las infecciones de transmisión sexual más comunes a nivel mundial, con una alta prevalencia en mujeres en edad reproductiva y una fuerte asociación con el desarrollo de lesiones intraepiteliales escamosas de alto grado y cáncer cervicouterino. Según la Organización Mundial de la Salud, aproximadamente el 99 % de los casos de cáncer de cuello uterino están vinculados con infecciones persistentes por tipos oncogénicos del VPH, especialmente los tipos 16 y 18.(1)
La mayor prevalencia de infección por VPH cervical en mujeres se observa en África subsahariana (24 %), seguida por América Latina y el Caribe (16 %), Europa oriental (14 %) y el Sudeste Asiático (14 %). En los hombres, la prevalencia varía significativamente dependiendo de los patrones de comportamiento sexual. Las infecciones de transmisión sexual han sido durante décadas un tema prioritario en la investigación médica, y constituyen un amplio campo de estudio enfocado en comprender su origen, evolución y posibles estrategias para controlarlas. Estos esfuerzos abarcan el desarrollo de fármacos, terapias específicas y campañas de prevención. En cuanto al VPH en particular, a pesar de ser uno de los virus de transmisión sexual más estudiados, su control continúa representando un desafío significativo para la salud pública.(2, 3)
Las estrategias tradicionales de manejo del VPH incluyen la prevención mediante vacunas profilácticas, como Gardasil y Cervarix, y el tratamiento de las lesiones con procedimientos quirúrgicos o ablativos. No obstante, estos métodos no eliminan el virus latente ni garantizan la prevención total de la progresión neoplásica, especialmente en regiones con acceso limitado a servicios de salud.(4) Por esta razón, la comunidad científica ha redoblado esfuerzos para desarrollar terapias innovadoras que actúen a nivel molecular.
Entre las tecnologías emergentes, la herramienta de edición génica CRISPR-Cas9 (por sus siglas en inglés de Clustered Regularly Interspaced Short Palindromic Repeats) se posiciona como una alternativa prometedora para el tratamiento dirigido de infecciones virales persistentes. Esta tecnología, derivada del sistema inmune adaptativo de bacterias, permite modificar secuencias específicas del ADN con alta precisión y eficiencia. Diversos estudios han demostrado que CRISPR-Cas9 puede dirigirse a genes virales como E6 y E7 del VPH, esenciales para la transformación maligna de las células hospedadoras, logrando su silenciamiento o eliminación.(5) Investigaciones recientes exploran su aplicación in vitro e in vivo, y evidencian la reducción de la proliferación celular; y recuperación de los mecanismos de apoptosis celular.
La tecnología CRISPR-Cas9 ha marcado un hito en la biología molecular y la genética, al permitir modificaciones precisas en el genoma. Este sistema, compuesto por repeticiones palindrómicas cortas agrupadas y regularmente interespaciadas (CRISPR) junto con la proteína asociada Cas9, ha demostrado un notable potencial para editar el ADN viral, lo que abre la posibilidad de eliminar el material genético del VPH en células infectadas.(6) Se estima que una fracción significativa de los casos de cáncer en humanos está relacionada con este virus, el cual se encuentra presente en la gran mayoría de los diagnósticos de cáncer de cuello uterino, considerado el cuarto tipo de cáncer más común entre las mujeres a nivel mundial. Además de su aplicación terapéutica, los sistemas CRISPR-Cas cumplen una función esencial como mecanismo inmunológico adaptativo en bacterias, donde se identificaron secuencias repetidas separadas por fragmentos denominados “espaciadores”, los cuales resultaron ser homólogos a secuencias virales.(7, Xu) En este contexto, se busca desarrollar y perfeccionar el uso de CRISPR-Cas9 para la eliminación dirigida del ADN del VPH, evaluando su viabilidad como una herramienta terapéutica eficaz frente a este virus.
El avance de esta técnica también ha impulsado debates sobre su seguridad, especificidad y factibilidad clínica. A pesar de los desafíos, como el riesgo de efectos fuera del objetivo (off-target) y las barreras en la entrega eficiente del sistema CRISPR-Cas9 a las células afectadas, el progreso continuo en vectores de transporte y optimización del diseño de guías específicas fortalece su potencial terapéutico.
Este artículo analiza los avances actuales en el uso de CRISPR-Cas9 como estrategia de tratamiento contra el VPH y la reversión de lesiones premalignas, destacando su relevancia frente a las limitaciones de las terapias convencionales. Asimismo, se examina el estado de la investigación en este campo, con el fin de valorar sus implicaciones futuras en la medicina personalizada y la biotecnología clínica. Lo anterior responde al objetivo de la revisión bibliográfica: fundamentar teóricamente la información sobre los principales factores de riesgo que contribuyen a la persistencia del VPH y el desarrollo de lesiones premalignas.
DESARROLLO
El presente artículo se desarrolla bajo un enfoque metodológico cualitativo, con un diseño de revisión bibliográfica y documental. Se realiza una recopilación y análisis crítico de la literatura científica actual relacionada con la aplicación de la tecnología CRISPR-Cas9 en el tratamiento del VPH y la reversión de lesiones premalignas asociadas.
Se seleccionaron artículos científicos de relevancia médica dentro de la comunidad científica, utilizando como criterios de búsqueda términos clave como "CRISPR-Cas9", "virus del papiloma humano", "cáncer cervicouterino" y combinaciones de operadores booleanos como "OR" y "AND". La búsqueda se orientó a contribuciones científicas con fecha de publicación comprendida entre 2020 y 2025.
Los criterios de inclusión utilizados fueron: publicaciones desde el año 2020, artículos científicos publicados en revistas indexadas y de alto impacto, revisiones sistemáticas, metaanálisis y referencias clásicas de la literatura médica relacionadas con la patología del cáncer cervicouterino. De acuerdo con la metodología PRISMA,(8) se realizó la identificación de información actualizada en bases de datos electrónicas como Scielo, Elsevier, PubMed, Biblioteca Virtual de la Salud y Google Académico.
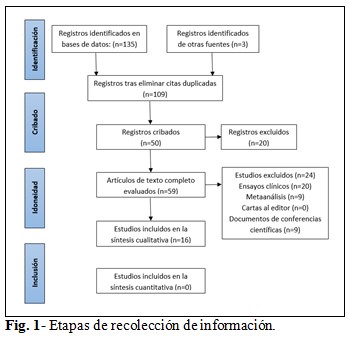
Mediante el uso de palabras clave y operadores booleanos, se identificaron inicialmente 135 registros, de los cuales, tras la eliminación de duplicados y artículos irrelevantes (revisión de títulos y resúmenes), se obtuvieron 109 artículos de revisión. Luego, se eliminaron 50 documentos tras revisar sus fechas de publicación, títulos y resúmenes. Finalmente, de los artículos completos seleccionados, 59 permanecieron elegibles. Tras aplicar los criterios de inclusión y exclusión, se incluyeron 16 artículos que cumplieron con los estándares metodológicos requeridos para ser incluidos en el análisis y la síntesis de resultados. (Fig. 1).
Los artículos científicos seleccionados versaron sobre el uso de la tecnología CRISPR-Cas9 en la eliminación del ADN del VPH, así como en la inhibición de sus genes oncogénicos, particularmente E6 y E7. La mayoría de ellos fueron artículos de revisión, aunque también fueron incluidas dos investigaciones experimentales y dos comparativas.
Los resultados de los estudios in vitro revisados evidenciaron una inhibición efectiva de la expresión de los oncogenes E6/E7 en células HeLa (células humanas de cáncer cervical), lo que condujo a la reactivación de las proteínas supresoras tumorales p53 y Rb, fundamentales en la regulación del ciclo celular; mientras un estudio clave demostró que la aplicación de CRISPR-Cas9 dirigida al gen E7 del VPH-16 redujo la proliferación celular y promovió significativamente la apoptosis en buena parte de las células infectadas.(9, 10, 11)
En los estudios con modelos murinos se observó una regresión parcial o total de las lesiones neoplásicas inducidas por el VPH tras la administración de vectores virales que transportaban los componentes de CRISPR-Cas9. Uno de los ensayos más destacados reportó disminución del tamaño tumoral después de tres semanas de tratamiento.(10) Además, el análisis de los riesgos asociados al uso de esta tecnología reveló que, aunque los eventos fuera de objetivo (off-target), son una preocupación, el uso de sistemas mejorados como Cas9 de alta fidelidad (HiFi-Cas9) o Cas12a ha reducido significativamente estos efectos colaterales, e incrementado la especificidad del tratamiento.(12)
Contexto del VPH y su relevancia clínica
El VPH tiene afinidad por las células epiteliales de la piel y las mucosas, especialmente en la región anogenital. Su genoma, compuesto por ADN circular, incluye genes de expresión temprana (E1, E2, E6 y E7) y tardía (L1 y L2). Entre ellos, las oncoproteínas E6 y E7 son fundamentales en la transformación maligna, ya que interfieren con los supresores tumorales p53 y Rb, así promueven la proliferación celular descontrolada, inhiben la apoptosis y facilitan la acumulación de mutaciones genéticas que pueden conducir al desarrollo de cáncer.(13)
Desde el punto de vista clínico, las lesiones premalignas, como la neoplasia intraepitelial cervical (NIC), constituyen una fase reversible del proceso patológico, lo que ofrece una oportunidad crucial para implementar terapias dirigidas. Estas lesiones se clasifican según su grado de severidad:(14)
- NIC 1 (leve): Corresponde a lesiones intraepiteliales escamosas de bajo grado (LSIL), que en la mayoría de los casos remiten espontáneamente. En esta etapa, aunque el virus se encuentra activo, las alteraciones celulares son mínimas.
- NIC 2 (moderada) y NIC 3 (severa): Aunque la replicación viral se reduce, el VPH persiste debido a su capacidad de evadir la respuesta inmune y modificar el microambiente local. En estas fases, se intensifica la expresión de oncoproteínas, se altera el control del ciclo celular y el genoma viral puede integrarse en el ADN del huésped. Estas lesiones tienen un mayor riesgo de progresar a cáncer invasivo si no se tratan oportunamente.
Fundamentos de la tecnología CRISPR-Cas9
El término CRISPR hace referencia a una serie de secuencias de ADN identificadas en los genomas de organismos procariotas, como bacterias y arqueas. Originalmente descubiertas en Escherichia coli, su función era incierta en un inicio. Con el tiempo, se comprendió que forman parte de un sistema inmunológico adaptativo bacteriano que permite a estos organismos defenderse de infecciones virales. Este sistema, conocido como CRISPR-Cas9, ha sido rediseñado como una herramienta de edición genética de alta precisión y especificidad.(10, 15, 16)
El sistema CRISPR-Cas9 consta de dos componentes principales:(13)
- Proteína Cas9: Es una nucleasa que reconoce y corta secuencias específicas de ADN en presencia de una secuencia adyacente conocida como PAM (protospacer adjacent motif), de aproximadamente 17 a 20 nucleótidos. Este corte se realiza a través del apareamiento de bases tipo Watson-Crick entre el ADN objetivo y el ARN guía. La rotura de doble cadena (DSB) inducida por Cas9 constituye el paso inicial para la edición del genoma. Posteriormente, la célula activa mecanismos endógenos de reparación del ADN, principalmente la unión de extremos no homólogos (non-homologous end joining, NHEJ) o la reparación dirigida por homología (homology-directed repair, HDR), mediante los cuales se generan las modificaciones genéticas deseadas.
- ARN guía (gRNA): Es una secuencia de ARN sintética compuesta por 20 pares de bases, diseñada específicamente para reconocer una región objetivo del ADN. Este ARN dirige a la proteína Cas9 hacia la secuencia complementaria en el genoma, y facilita el corte preciso. Una vez realizado, los mecanismos de reparación celular actúan sobre la doble hebra rota, lo cual permite la introducción de pequeñas inserciones, deleciones o incluso el reemplazo de un nucleótido específico.
El proceso completo comienza con la introducción del complejo Cas9-gRNA en las células diana. Dentro de la célula, el gRNA se acopla al sitio específico del ADN, ya sea viral o celular, y guía a la nucleasa Cas9 para generar una ruptura en la doble hélice. Dependiendo del tipo de reparación activada, puede lograrse la inactivación de genes virales, la corrección de mutaciones o la inserción dirigida de nuevas secuencias genéticas, lo que posiciona a CRISPR-Cas9 como una herramienta clave en la terapia génica moderna.
Aplicación de CRISPR-Cas9 en el manejo del VPH(6)
La sobreexpresión de los oncogenes E6 y E7 del VPH guarda una estrecha relación con la progresión de las lesiones cervicales. Por ello, su inactivación directa representa una estrategia prometedora para frenar el avance de dichas alteraciones. Los avances recientes en la edición genética han permitido convertir esta hipótesis en una alternativa terapéutica tangible. En el caso del VPH, la tecnología CRISPR-Cas9 se enfoca en interrumpir específicamente el genoma viral, actuando sobre los genes E6 y E7, con el objetivo de restaurar la función de los supresores tumorales p53 y Rb, lo cual permite inhibir la proliferación celular descontrolada.
Diversos estudios preclínicos han evidenciado que la aplicación de ARN guía, diseñado para estas regiones, puede lograr los siguientes efectos: (11, 17, 18, 19)
- Eliminación de la persistencia viral: Al generar mutaciones específicas en el ADN del VPH, se reduce su capacidad replicativa, lo que facilita su eliminación por el sistema inmune.
- Restablecimiento de mecanismos de supresión tumoral: La inactivación de E6 permite la reactivación funcional de la vía p53, mientras que la interrupción de E7 favorece la recuperación de la vía del supresor tumoral Rb. Estas acciones derivan en la detención del ciclo celular y la activación de la apoptosis.
- Regresión de lesiones premalignas: En estudios con modelos animales, como ratones, la edición dirigida de los genes E6 y E7 ha demostrado inducir la regresión de lesiones cervicales precancerosas. Esto se ha logrado mediante el uso de nanopartículas (NP) compuestas por el vector no viral PBAE546 y un plásmido recombinante que codifica el sistema CRISPR/Cas9, mostrando una alta eficiencia de transfección y una biotoxicidad mínima.
Ventajas de CRISPR-Cas9 en distintos contextos científicos y clínicos
El sistema CRISPR-Cas9 demuestra una alta eficiencia y especificidad en la eliminación del ADN del VPH, particularmente en cepas de alto riesgo como VPH-16 y VPH-18, lo que lo posiciona como una herramienta terapéutica prometedora para prevenir la progresión hacia el cáncer cervical en fases premalignas. Su capacidad para inducir roturas de doble cadena (DSB) en sitios específicos del genoma viral, activando mecanismos de reparación como la NHEJ o HDR, permite modificar o eliminar genes virales sin afectar significativamente el ADN celular. Ensayos in vitro evidencian que la edición dirigida de los oncogenes E6 y E7 reduce la expresión de oncoproteínas y restaura parcialmente las vías supresoras tumorales p53 y pRb, lo cual promueve apoptosis celular y disminuye la proliferación. En modelos murinos, el uso de CRISPR-Cas9 encapsulado en nanopartículas redujo lesiones premalignas en un 78 % de los casos, con normalización epitelial confirmada por histopatología. Además, el análisis de posibles efectos fuera de objetivo reveló una baja tasa de mutaciones no deseadas (<2 %) y ausencia de toxicidad sistémica, lo que refuerza su seguridad y especificidad como herramienta terapéutica.(6, 20, 21, 22) Aunque los resultados preclínicos de CRISPR-Cas9 son prometedores, existen varios desafíos para su aplicación clínica. Uno de los principales es la eficiencia en la entrega del sistema CRISPR-Cas9 en tejidos humanos, especialmente en terapias dirigidas. Aunque el uso de nanopartículas para administrar CRISPR-Cas9 ha mostrado potencial; aún es necesario optimizar su estabilidad, penetración celular y especificidad, además de minimizar posibles efectos adversos. También es crucial garantizar la precisión de la edición genética para evitar mutaciones fuera del objetivo. Además, se deben evaluar los efectos a largo plazo de la edición génica, como la estabilidad genómica y los riesgos de reactivación viral, ya que los virus pueden desarrollar mecanismos para evadir el tratamiento. Por otro lado, la posibilidad de efectos fuera del objetivo puede inducir mutaciones no deseadas, y la implicación de p53 en la reparación del ADN plantea preocupaciones sobre la capacidad tumorigénica de las células editadas. Finalmente, las consideraciones éticas sobre el acceso, el uso indebido de la tecnología y la seguridad de la edición genética siguen siendo un tema relevante antes de su implementación clínica.(23) El uso de CRISPR-Cas9 para el tratamiento del VPH y la reversión de lesiones premalignas se encuentra actualmente en una fase preclínica, pero tiene el potencial de revolucionar el enfoque terapéutico de esta infección. Integrar esta tecnología con otras estrategias, como inmunoterapias o vacunas terapéuticas, podría mejorar su eficacia y seguridad, con vistas a reducir los riesgos asociados. Además, el avance en la especificidad de la herramienta y los sistemas de entrega podría facilitar la transición hacia ensayos clínicos en humanos, abriendo nuevas oportunidades para el tratamiento de otras infecciones virales y cánceres relacionados con virus.
CONCLUSIONES
CRISPR-Cas9 representa un avance clave en la biomedicina, con un gran potencial para combatir infecciones virales como el VPH y revertir enfermedades premalignas. Sin embargo, su implementación clínica requiere superar obstáculos técnicos y éticos, así como garantizar un acceso equitativo. Con el progreso de la investigación, esta herramienta podría convertirse en un pilar esencial para la prevención y tratamiento del cáncer cervical y otras patologías relacionadas con el VPH.
A pesar de los avances en modelos celulares y animales, la aplicación clínica de CRISPR-Cas9 enfrenta retos significativos, como la optimización de los sistemas de entrega, la reducción de efectos fuera del objetivo y la evaluación de riesgos a largo plazo. Sin embargo, su integración con otras estrategias terapéuticas, como inmunoterapias y vacunas terapéuticas, podría potenciar su eficacia y seguridad, allanando el camino hacia ensayos clínicos en humanos y transformando potencialmente el tratamiento del VPH y otras enfermedades virales asociadas al cáncer.
Conflictos de intereses:
Los autores declaran no tener conflictos de intereses.
Contribución de los autores:
Conceptualización: Melany Yamilex Reascos Chalacán
Curación de datos: Melany Yamilex Reascos Chalacán, Mauricio Fernando Enrríquez Grijalva
Análisis formal: Melany Yamilex Reascos Chalacán, Mauricio Fernando Enrríquez Grijalva, Bryan Fernando Coka Calvache, Sylvia del Pilar Núñez Arroba
Investigación: Melany Yamilex Reascos Chalacán, Mauricio Fernando Enrríquez Grijalva, Bryan Fernando Coka Calvache, Sylvia del Pilar Núñez Arroba
Metodología: Melany Yamilex Reascos Chalacán
Visualización: Melany Yamilex Reascos Chalacán
Redacción-borrador original: Melany Yamilex Reascos Chalacán, Mauricio Fernando Enrríquez Grijalva, Bryan Fernando Coka Calvache, Sylvia del Pilar Núñez Arroba
Redacción-revisión y edición: Melany Yamilex Reascos Chalacán, Mauricio Fernando Enrríquez Grijalva
Financiación:
Autofinanciado.
REFERENCIAS BIBLIOGRÁFICAS
1. Lycke KD, Steben M, Garland SM, Woo YL, Cruickshank ME, Perkins RB, et al. An updated understanding of the natural history of cervical human papillomavirus infection—clinical implications. Am J Obstet Gynecol. 2025;232(5):453–60.
2. World Health Organization. Human papillomavirus and cancer[Internet]. 2024[citado 12/08/2025]. Geneva: OMS; 2024[citado 12/08/2025]. Disponible en: https://www.who.int/news-room/fact-sheets/detail/human-papilloma-virus-and-cancer
3. Flores A, Rodríguez MA, Rodríguez MA, Gómez PI, Pinto JA. Conocimientos y riesgos sobre el VPH y su relación con el cáncer cervicouterino en mujeres entre 20 y 59 años de edad. RIDE[Internet]. 2022[citado 12/08/2025];12(24):[aprox. 50p]. Disponible en: https://www.scielo.org.mx/pdf/ride/v12n24/2007-7467-ride-12-24-e039.pdf
4. Zou K, Huang Y, Li Z. Prevention and treatment of human papillomavirus in men benefits both men and women. Front Cell Infect Microbiol. 2022;12:1077651.
5. Inturi R, Jemth P. CRISPR/Cas9-based inactivation of human papillomavirus oncogenes E6 or E7 induces senescence in cervical cancer cells. Virology[Internet]. 2021[citado 12/08/2025];562:[aprox. 40p]. Disponible en: https://www.sciencedirect.com/science/article/pii/S0042682221001525
6. Cañarte JG, Intriago JC, Sornoza MG. Uso de crispr/cas9 para la eliminación del ADN del virus del papiloma humano: avances y perspectivas terapéuticas. MQRInvestigar[Internet]. 2024[citado 12/08/2025];8(3):[aprox. 30p]. Disponible en: https://www.investigarmqr.com/ojs/index.php/mqr/article/view/1716/5397
7. Toro AI, Tapia LJ. Virus del papiloma humano (VPH) y cáncer. Med laboratório[Internet]. 2021[citado 12/08/2025];25(2):[aprox. 32p]. disponible en: https://www.medigraphic.com/pdfs/medlab/myl-2021/myl212b.pdf
8. Barquero WG. Análisis de Prisma como Metodología para Revisión Sistemática: una Aproximación General. Salud Redes[Internet]. 2022[citado 12/08/2025];8(sup1):[aprox. 40p]. Disponible en: https://revista.redeunida.org.br/index.php/rede-unida/article/view/3317/864
9. Guzmán CA, Gutiérrez S, Hernández C, Londoño E. Avances del CRISPR/CAS en relación con su aplicación en cáncer colorrectal. Univ Med[Internet]. 2022[citado 12/08/2025];63(2):[aprox. 25p]. Disponible en: https://revistas.javeriana.edu.co/index.php/vnimedica/article/view/36183/28417
10. Gao C, Wu P, Yu L, Liu L, Liu H, Tan X, et al. Aplicación del sistema CRISPR/Cas9 en la carcinogénesis cervical. Cancer Gene Ther. 2022;29:466–74.
11. Ling K, Dou Y, Yang N, Deng L, Wang Y, Li Y, et al. Las nanoterapias de ARNm de edición genómica inhiben la progresión del cáncer de cuello uterino y regulan el microambiente inmunosupresor para la terapia adoptiva de células T. Revista de liberación controlada. 2023;360:496-513.
12. Donoso RF, Gómez N, Rodríguez A. Edición genómica con CRISPR-Cas9 y su aplicación en trastornos genéticos. Rev Cubana Inv Bioméd[Internet]. 2024[citado 03/10/2025];42(2):[aprox. 13p]. Disponible en: https://revibiomedica.sld.cu/index.php/ibi/article/download/3354/1542/18503
13. Hoffmann M, Quabius ES. Relevance of Human Papillomaviruses in Head and Neck Cancer-What Remains in 2021 from a Clinician’s Point of View? Viruses. 2021;13(6):1173.
14. Soto GA, Hernández JA, López R del C, Aguayo CD, Villela LM, Espino M, et al. Tipificación de serotipos del virus del papiloma humano de alto riesgo. Ginecol Obstet Mex[Internet]. 2020[citado 12/08/2025];88(10):[aprox. 10p]. Disponible en: https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0300-90412020001000659
15. Moradi A, Khoshniyat S, Nzeako T, Khazeei Tabari MA, Olanisa OO, et al. The Future of Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR)-Cas9 Gene Therapy in Cardiomyopathies: A Review of Its Therapeutic Potential and Emerging Applications. Cureus. 2025;17(2):e79372.
16. Sowbhagya R, Muktha H, Ramakrishnaiah TN, Surendra AS, Tanvi Y, Nivitha K, et al. CRISPR/Cas-mediated genome editing in mice for the development of drug delivery mechanism. Mol Biol Rep. 2023;50(9):7729–43.
17. Wei Y, Zhao Z, Ma X. Description of CRISPR-Cas9 development and its prospects in human papillomavirus-driven cancer treatment. Front Immunol. 2022 Nov 21;13:1037124.
18. Kermanshahi AZ, Ebrahimi F, Taherpoor A, Eslami N, Baghi HB. Cánceres inducidos por el VPH: una amenaza inminente y el potencial de CRISPR/Cas9 para la terapia dirigida. Virol J[Internet]. 2025[citado 12/08/2025];22(156):[aprox. 32p]. Disponible en: https://virologyj.biomedcentral.com/counter/pdf/10.1186/s12985-025-02783-x.pdf
19. Huafeng L, Li G, Peng X, Deng A, Ye L, Lei S, et al. El uso de CRISPR/Cas9 como herramienta para estudiar virus infecciosos humanos. Frente. Celular. Infect Microbiol[Internet]. 2021[citado 12/08/2025];11:[aprox. 40p]. Disponible en: https://www-frontiersin-org.translate.goog/journals/cellular-and-infection-microbiology/articles/10.3389/fcimb.2021.590989/full?_x_tr_sl=en&_x_tr_tl=es&_x_tr_hl=es&_x_tr_pto=tc
20. Zubair A, Sujan A, Ali M, Hussain SM. Current Challenges With Highly Active Antiretroviral Therapy and New Hope and Horizon With CRISPR-CAS9 Technology for HIV Treatment. Chem Biol Drug Des. 2025;105(5):e70121.
21. Najafi S, Tan SC, Aghamiri S, Raee P, Ebrahimi Z, Jahromi ZK, et al. Therapeutic potentials of CRISPR-Cas genome editing technology in human viral infections. Biomed Pharmacother. 2022;148:112743.
22. Mondal R, Brahmbhatt N, Sandhu SK, Shah H, Vashi M, Gandhi SK, et al. Applications of Clustered Regularly Interspaced Short Palindromic Repeats (CRISPR) as a Genetic Scalpel for the Treatment of Cancer: A Translational Narrative Review. Cureus. 2023;15(12):e50031.
23. Li J, Tang C, Liang G, Tian H, Lai G, Wu Y, et al. Clustered Regularly Interspaced Short Palindromic Repeats and Clustered Regularly Interspaced Short Palindromic Repeats-Associated Protein 9 System: Factors Affecting Precision Gene Editing Efficiency and Optimization Strategies. Hum Gene Ther. 2023;34(23-24):1190-1203.