INTRODUCCIÓN
La neurocisticercosis (NCC) es una enfermedad parasitaria común, en la cual el sistema nervioso central (SNC) está infestado por las larvas de Taenia solium. Resulta el tipo más habitual de neuroparasitosis y es endémica en los países en desarrollo de Asia, África y América. Su frecuencia aumenta en los países desarrollados, como resultado de las migraciones humanas. Afecta a más de 50 millones de personas y es la causa más importante de epilepsia en el mundo.(1)
La enfermedad se desarrolla cuando el cisticerco se encuentra en el sistema nervioso central del cerebro humano. Esta tiende a ser más común en áreas rurales, donde las condiciones de saneamiento e higiene son deficientes, y condicionan la ingestión de huevos del parásito por vía fecal-oral.(2)
Una característica importante de la NCC es la heterogeneidad observada en varios niveles. Clínicamente, los parásitos del SNC pueden ser asintomáticos, como sucede en la mayoría de los afectados; o producir una gran variedad de síntomas, que incluyen cefalea, mareos, crisis epilépticas, déficit neurológico focal, trastornos psiquiátricos e hipertensión intracraneal grave. Esta heterogeneidad clínica se debe a la variación en la localización, número y estadio de evolución de los parásitos, así como a la intensidad de la reacción inflamatoria.(3)
En las regiones endémicas la NCC se toma en cuenta como diagnóstico diferencial estándar de la mayoría de las afecciones neurológicas, pero no de las psiquiátricas.(4) No obstante, la infestación trae como consecuencia síndromes neuroquirúrgicos y psicológicos complejos. Junto a los trastornos neuroconductuales asociados con problemas neurológicos y neuroquirúrgicos, los síntomas pueden reproducir diferentes trastornos psiquiátricos en el 15% de los pacientes infestados.(5)
Las manifestaciones neurológicas de la NCC se presentan comúnmente como crisis epilépticas (80 %), dolor de cabeza (40 %), alteraciones de la visión (20 %) y confusión (15 %). Ciertos mecanismos inmunes se inician en el SNC, causando gliosis reactiva y aracnoiditis, los cuales finalmente conducen a endarteritis proliferativa. Esto provoca la oclusión de la luz arterial e hidrocefalia, como consecuencia de lo cual hay hipertensión intracraneal y edema. Estos cambios estructurales dependen en gran medida de la cantidad de lesiones parasitarias y de su ubicación. Además, se sabe que la NCC ventricular y subaracnoidea se asocia con meningitis e hipertensión intracraneal, que pueden provocar deterioro cognitivo, principalmente déficit de atención, disminución de la conciencia y delirio.(6)
Se han identificado una variedad episodios psicóticos inducidos por la NCC, como delirio, cambios sensoriales perceptivos, ansiedad, depresión, trastornos de la personalidad, confusión, agitación psicomotora, comportamiento agresivo y alucinaciones visuales. Muchos pacientes con NCC muestran una disminución en la calidad de vida, depresión o deterioro cognitivo moderado no explícitamente relacionado con la gravedad de la enfermedad o con un tipo en particular. Se ha descrito asociación entre los trastornos mentales y la presencia de hipertensión intracraneal, lo cual no se cumple para las crisis epilépticas.(7)
Una intervención de salud pública adecuada podría prevenir, controlar y posiblemente erradicar esta infección. Las medidas que deben tomarse incluyen quimioterapia antiparasitaria, a nivel individual o masivo; educación sanitaria a la población afectada; inmunización de cerdos infectados mediante vacunación; y tratamiento de estos con fármacos antiparasitarios (albendazol o praziquantel). Esta enfermedad representa un importante problema de salud pública, cuya erradicación es factible y podría reducir la prevalencia de complicaciones como las crisis epilépticas y el deterioro cognitivo.(8)
A pesar de que abunda la evidencia acerca de la presencia de manifestaciones neuropsiquiátricas en los pacientes con NCC, no se dispone se investigaciones que hayan analizado su asociación con los hallazgos tomográficos en el contexto de la población ecuatoriana. En consecuencia, el problema que dio origen a esta investigación surge de un vacío en la evidencia disponible acerca de la correlación entre deterioro cognitivo y los signos tomográficos en los pacientes con NCC. El objetivo del presente estudio es determinar la correlación entre el estado cognitivo y los hallazgos tomográficos en pacientes con neurocisticercosis.
MÉTODOS
Se realizó una investigación con diseño correlacional, prospectivo y transversal, para establecer la correlación entre el estado cognitivo y los hallazgos tomográficos en pacientes con NCC atendidos por consulta de Neurología en el Hospital San Vicente de Paúl (Ibarra, Ecuador) y el Hospital del Instituto Ecuatoriano de Seguridad Social de Ibarra (IESS – Ibarra). Se incluyeron todos (N=93) los pacientes con diagnóstico (clínico e imagenológico) de NCC, durante el periodo comprendido entre de mayo de 2019 y mayo de 2020.
Para el diagnóstico se consideraron los siguientes criterios estandarizados por Del Brutto y colaboradores:(9)
- Criterios absolutos: Visualización de cisticerco subretiniano o demostración concluyente de un escólex dentro de una lesión quística en estudios de neuroimagen.
- Criterios imagenológicos mayores: Lesiones quísticas sin un escólex discernible, mejora de lesiones; lesiones quísticas multilobuladas en el espacio subaracnoideo; calcificaciones cerebrales parenquimatosas típicas.
- Criterios imagenológicos menores: Hidrocefalia obstructiva (simétrica o asimétrica) o realce anormal de las leptomeninges basales.
- Criterios clínicos/de exposición: 1) Mayores: Detección de anticuerpos específicos contra el cisticerco o antígenos del cisticerco mediante métodos de inmunodiagnóstico estandarizados; cisticercosis fuera del sistema nervioso central; evidencia de un contacto doméstico con infección por T. solium. 2) Menores: Manifestaciones clínicas sugestivas de NCC; personas que provienen o viven en un área donde la cisticercosis es endémica.
Se excluyeron los pacientes que no aceptaron colaborar con la investigación, los que tenían diagnóstico de enfermedades mentales y los menores de edad cuyos padres o representantes legales no aceptaron participar en la investigación. Los que abandonaron la atención y seguimiento en la consulta de Neurología fueron eliminados del estudio.
La información fue recogida en la consulta de Neurología de ambos hospitales, después de explicar a los pacientes los pormenores del estudio y de solicitar su consentimiento de participar en la investigación. Fueron recopilados los aspectos relacionados con las características generales de los pacientes (edad, sexo, nivel de instrucción, vínculo laboral, antecedentes patológicos personales y antecedente familiar de NCC), la valoración del estado cognitivo y los hallazgos tomográficos de la evaluación de los estudios de imagen, una vez obtenido el consentimiento de estos por escrito.
En ningún momento se realizaron procederes, maniobras, estudios o pruebas no incluidos en el protocolo de atención de esta enfermedad establecido por el ministerio de salud pública del Ecuador.
Para medir el estado cognitivo se utilizó el Mini-Mental State Examination, de Fosltein (MMSE),(10) validado por varios autores en estudios precedentes, y ajustado para individuos con un nivel de educación bajo.(11,12)
El MMSE evaluó cinco áreas: orientación espacio – temporal; atención, memoria y concentración; cálculo matemático; lenguaje y percepción visuoespacial; y la capacidad de seguir instrucciones básicas. A cada una de ellas se otorgó una puntuación, cuya sumatoria permitió evaluar el estado cognitivo de los pacientes. (Tabla 1).
Se utilizó el programa SPSS v23.0. Como medidas de resumen para las variables cualitativas se emplearon las frecuencias absolutas y porcentajes; y en el caso de las variables cuantitativas, el promedio y la desviación estándar. Como prueba de contraste de hipótesis, con vistas a analizar la relación entre hallazgos tomográficos (tamaño de las lesiones, número de lesiones, ubicación, localización, topografía, y estadio) y estado cognitivo, se utilizó la estimación del riesgo relativo (RR) y el test de Chi cuadrado, considerando en ambos significación estadística cuando el valor de p<0,05. El análisis multivariado se aplicó mediante un modelo de regresión logística binaria, en el cual se consideraron como variables dependientes las áreas de la valoración cognitiva; y como cofactores, los signos tomográficos que alcanzaron significación estadística en el análisis bivariado. En ambos análisis, se consideró significación estadística cuando el valor de p<0,05.
RESULTADOS
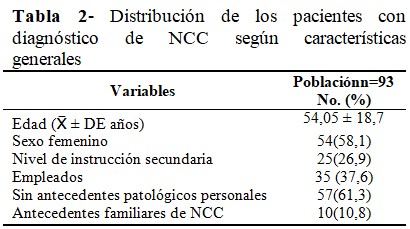
Se incluyeron 93 pacientes con una edad promedio de 54 años (54,1 ± 18,7 años), predominio del sexo femenino (n=54; 58,1 %), instrucción secundaria (n=25; 26,9 %), empleados (n=35; 37,6 %), sin antecedentes patológicos personales (n=57; 61,3 %); y antecedente familiar de NCC en 10 pacientes (10,8%). (Tabla 2).
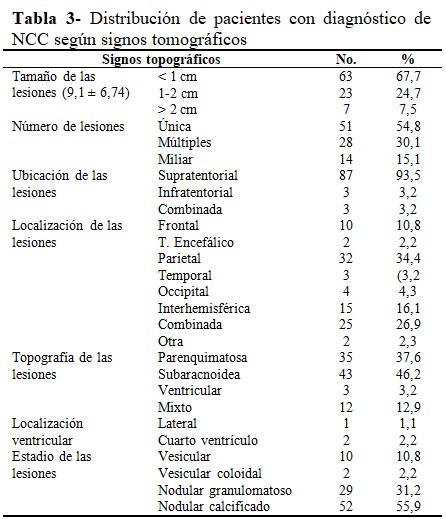
Los hallazgos tomográficos indicaron un tamaño promedio de las lesiones de 9,1 mm ± 6,7 mm.
En el 67,7 % de los casos, las lesiones tenían menos de 1 cm de diámetro (n=63); 54,8 % se trató de lesiones únicas; 93,5 % de ubicación supratentorial; 26,9 % en más de un lóbulo. En relación con la topografía de las lesiones, predominaron las de origen subaracnoideo (n=43; 46,2 %) y las parenquimatosas (n=35; 37,6 %). Al analizar el estadio de las lesiones, las nodulares calcificadas prevalecieron (n=52; 55,9 %), seguidas por las nodulares granulomatosas (n=29; 31,2%). (Tabla 3).
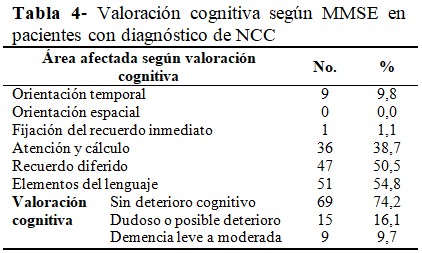
En relación con el resultado de la valoración cognitiva, se observó en la mayoría de los pacientes un estado cognitivo normal (n=69; 74,2 %), así como demencia de leve a moderada en el 9,7 % (n=9) de los casos. Al realizar la valoración por áreas del estado cognitivo, la afectación en los elementos del lenguaje se constató en el 54,8 % (n=51) de los casos, el recuerdo diferido estuvo afectado en el 50,5% de los pacientes (n=47); y el cálculo matemático en el 38,7 % (n=36). Ninguno de los pacientes manifestó alteración en la orientación espacial; pero en la orientación temporal, hasta el 9,8% mostró afectaciones. (Tabla 4).
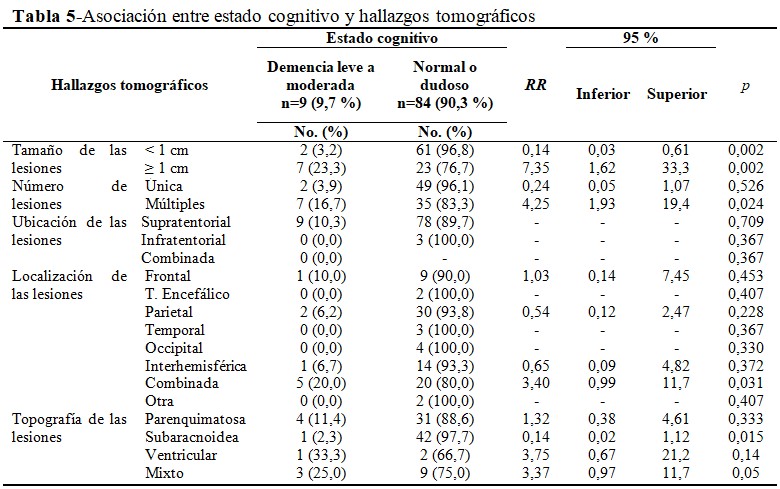
Al analizar la relación entre los diferentes signos tomográficos y el estado cognitivo, el 23,3 % (n=7) de los pacientes con lesiones ≥ 1 cm obtuvieron un puntaje en la escala MMSE sugestivo de demencia leve a moderada, o sea, que los pacientes con lesiones iguales o mayores a 1 cm, tuvieron una probabilidad de 7,35 veces más de padecer deterioro cognitivo, con respecto a aquellos con lesiones menores a 1 cm [RR: 7,35; IC 95 %: 1,62-33,3]; (p<0,05). De forma similar, se observó que los pacientes con lesiones múltiples (n=7; 16,7%) tuvieron 4,25 veces más probabilidades de desarrollar deterioro cognitivo que los pacientes con una sola lesión observada en la tomografía [RR: 4,25; IC 95 %: 1,93-19,4]; (p<0,05). La ubicación de las lesiones no se asoció de forma estadísticamente significativa con el estado cognitivo (p>0,05), aunque el 10,3 % (n=9) de los casos con lesiones supratentoriales tuvieron deterioro cognitivo. En relación con la localización de los cisticercos, cuando fue combinada (n=5; 20 %), esto significó una probabilidad 3,4 veces mayor de tener deterioro cognitivo [RR: 3,40; IC 95 %: 0,99-11,7]; (p<0,05).
Igualmente, los pacientes con topografía mixta (n=3; 25,0 %) tuvieron una probabilidad de hasta 3,37 veces más de deterioro cognitivo [RR: 3,37; IC 95 %: 0,97-11,7]; con un valor de p = 0,05. (Tabla 5).
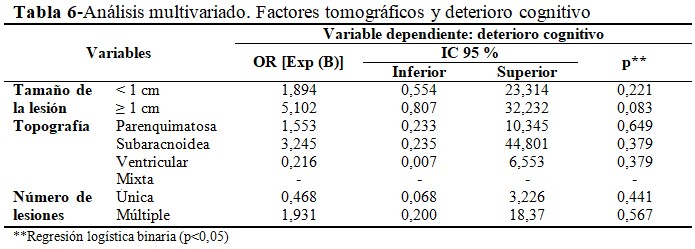
El análisis multivariado mediante modelo de regresión logística binomial, con el cual se obtuvo una precisión de 90,3 % (R2 de Negelkerke = 26,9), concluyó que ninguna de las variables alcanzó significación estadística (p>0,05). Al aplicar la prueba de bondad de ajuste de Hosmer y Lemeshow (p=0,850), se aceptó la hipótesis nula (H0), indicativa de que no existieron diferencias entre los valores esperados y obtenidos, demostrando un buen ajuste del modelo. (Tabla 6).
DISCUSIÓN
El deterioro cognitivo se acepta a menudo como una manifestación de NCC; sin embargo, la información sobre la incidencia real de esta afección en los pacientes con NCC es limitada y controvertida. Los pocos estudios que se centran en el estado cognitivo en pacientes con NCC son heterogéneos, ya que incluyen pacientes con diferentes formas de la enfermedad y utilizan diversos diseños e instrumentos para evaluar la cognición.(13)
En esta investigación se incluyeron 93 pacientes con NCC, los cuales fueron atendidos en dos hospitales ecuatorianos, entre los cuales se estableció una prevalencia de deterioro cognitivo de 9,7 %, según el MMSE de Folstein. Además, se constató que las áreas cognitivas con mayor afectación fueron el lenguaje (54,8 %), recuerdo diferido (50,5 %) y cálculo matemático (38,7 %). Estos resultados indican que la demencia leve entre estos pacientes fue menor a la observada en otras series analizadas, en las que se registran cifras superiores, desde el 12,5 % en Perú(14) y los Estados Unidos(15) y el 15,6 %-18,2 % en la India.(16,17)
La diferencia en la frecuencia de deterioro cognitivo en esta investigación, en comparación con los trabajos mencionados, también pudiera explicarse porque la edad de los pacientes analizados tuvo un valor medio de 54,05 ± 18,7, lo que significa que se trata de una población en la que no son mayoría los adultos mayores, entre los que se sabe, es más frecuente y permanente el deterioro cognitivo y la demencia.
Estos resultados difieren de los descritos por Huang y colaboradores(2) en la población China, en la cual las afectaciones del lenguaje se constataron en el 3,35 % de los casos, las alteraciones de la conciencia en el 9,02 %, la pérdida de memoria en el 9,41 % y los trastornos mentales en el 1,93 %. Las diferencias entre estos reportes con lo obtenido en este trabajo, pudieran estar relacionadas con las diferencias en participantes, que en la investigación mencionada fueron 1535 pacientes, y en esta, 93 pacientes; además del instrumento utilizado para evaluar el estado cognitivo, que también fue diferente. No obstante, el trabajo consultado permite confirmar los hallazgos de este, en el que las áreas cognitivas más afectadas fueron el lenguaje (54,8 %), memoria (50,5 %) y cálculo matemático (38,7 %).
Estos resultados también pueden sustentarse en la evidencia que indica que los síntomas psiquiátricos son frecuentes en la NCC, junto al deterioro cognitivo y deterioro intelectual, trastornos depresivos, trastornos del comportamiento y psicosis. La progresión de la enfermedad y la hipertensión intracraneal se correlacionan con niveles más altos de comorbilidad psiquiátrica, los cuales se prolongan por varios años, mientras no sea diagnosticada la enfermedad, causando un deterioro importante de la salud física y mental, de la calidad de vida y de la funcionalidad de los pacientes.(18)
En este sentido, aunque se describe que los pacientes con NCC intraparenquimatosa o extra parenquimatosa presentan manifestaciones psiquiátricas como deterioro cognitivo y depresión. La literatura sobre la frecuencia de deterioro cognitivo en la NCC es inconsistente y la relación entre el deterioro cognitivo y las características específicas del parásito sigue sin estar clara: se han descrito formas leves de deterioro cognitivo en el 45 % y 71,9 % de los pacientes con NCC, mientras que la demencia o las características cognitivas graves se diagnostican en el 12,5 % y el 15,1 % de los afectados.(19,20,21,22,23)
Al analizar la correlación entre la presencia de deterioro cognitivo y las manifestaciones tomográficas, se estableció que el tamaño de la lesión > 1 cm [RR: 7,35; IC 95 %: 1,62-33,3]; el número de lesiones (múltiples o racemosa) [RR: 4,25; IC 95 %: 1,93-19,4] y la topografía mixta [RR: 4,51; IC 95 %: 1,38-14,8]; se asociaron de forma estadísticamente significativa con la presencia de demencia leve a moderada (p<0,05). Esto significa que, a mayor tamaño y número de los cisticercos, mayor probabilidad existe de que el paciente desarrolle deterioro cognitivo.
Sin embargo, para Ciampi y colaboradores(22) no se estableció una relación entre los hallazgos imagenológicos, el tipo de lesiones o su localización, con presencia de deterioro cognitivo; por lo que plantean que el deterioro cognitivo parece no estar determinado por la carga de enfermedad según el número de lesiones solamente, sino más bien por la interacción sinérgica entre el número, la localización, las diferentes fases evolutivas y la producción local de diversos grados de inflamación y edema cerebral.
En este contexto, se acepta también que la mayor incidencia de deterioro cognitivo se observa en pacientes con NCC racemosa, que es una forma de presentación poco común, referida a una proliferación aberrante de las larvas de Taenia solium; se presentan como múltiples membranas quísticas no encapsuladas que brotan exógenamente dando una apariencia quística multilocular. Estos quistes se observan típicamente en áreas no confinadas del cerebro como supraselar, acueducto de Silvio, y cuarto ventrículo, alrededor del tronco encefálico rostral, y normalmente carecen de escólex, realce de contraste y edema.(24)
Esto pudiera sustentarse también en los hallazgos de Varghese y colaboradores(25) quienes obtuvieron una incidencia de afectaciones cognitivas similares a las de esta investigación, con un predominio de los problemas de memoria; afirmando que los pacientes con NCC muestran deterioro en las funciones ejecutivas, la memoria verbal y no verbal, la praxis y la fluidez verbal, lo que también se comprobó en esta investigación.
Estos investigadores explican la etiopatogenia del deterioro cognitivo en los pacientes con NCC por la presencia de colinesterasa y pseudocolinesterasa en la membrana vesicular del escólex. La pared de la vesícula tiene más actividad enzimática; por lo tanto, es probable que haya una mayor degradación de la acetilcolina, así como una inflamación neurogénica que podría contribuir a la disfunción cognitiva en los pacientes; además, describen un aumento en los niveles de interleuquina 5 y 10 (IL-5 e IL-10) en la sangre de los enfermos.(25)
Por otra parte, el deterioro cognitivo en los pacientes con NCC se ha relacionado con la atrofia del hipocampo, complicación bastante frecuente, debido a una diversidad de mecanismos que incluyen crisis convulsivas recurrentes que pueden ser subclínicas, o episodios recurrentes de inflamación relacionados con la liberación periódica de antígenos del cisticerco atrapados dentro de las calcificaciones.(26) Dado el papel principal del hipocampo en la memoria y otras funciones cognitivas, es plausible suponer que su atrofia podría ser el vínculo para explicar el deterioro cognitivo en pacientes con NCC, como plantean Del Brutto y colaboradores(13) en una investigación realizada en el Ecuador.
Como limitación a este trabajo, se puede mencionar que se trata de una población pequeña, representativa de dos provincias del Ecuador, la cual convendría ampliar en investigaciones futuras.
De acuerdo con el Mini-Mental State Examination, el porcentaje de pacientes con NCC que presentaron demencia leve a moderada, es inferior a las cifras descritas en la literatura consultada. Las áreas cognitivas más afectadas fueron lenguaje, recuerdo diferido y cálculo matemático. El déficit cognitivo se asoció con hallazgos tomográficos como lesiones menores de de un centímetro, múltiples y de topografía mixta en el análisis bivariado; sin embargo, en el análisis multivariado no se observó significación estadística.
Conflicto de intereses:
Los autores de esta investigación declaran no tener conflicto de intereses.
Contribución de autores:
1. Conceptualización: Jorge Luis Anaya González, Francisco López Muñoz
2. Curación de datos: Jorge Luis Anaya González, Erlen Carmona Alvarez-Builla
3. Análisis formal: Jorge Luis Anaya González, Francisco López Muñoz
5. Investigación: Jorge Luis Anaya González, Erlen Carmona Alvarez-Builla, Adriana Miniet Castillo
6. Metodología: Jorge Luis Anaya González, Erlen Carmona Alvarez-Builla
7. Administración del proyecto: Jorge Luis Anaya González
8. Recursos: Jorge Luis Anaya González, Erlen Carmona Alvarez-Builla, Adriana Miniet Castillo
9. Software: Jorge Luis Anaya González, Erlen Carmona Alvarez-Builla
10. Supervisión: Jorge Luis Anaya González, Francisco López-Muñoz
13. Redacción – borrador original: Jorge Luis Anaya González, Francisco López Muñoz, Erlen Carmona Alvarez-Builla, Adriana Miniet Castillo
14. Redacción – revisión y edición: Jorge Luis Anaya González, Francisco López Muñoz, Erlen Carmona Alvarez-Builla, Adriana Miniet Castillo
Financiamiento:
Para el desarrollo de esta investigación no se recibieron fondos de ninguna persona o institución.