INTRODUCCIÓN
El surgimiento del nuevo coronavirus, SARS-Cov-2, descrito como el agente causal de la COVID-19, y cuyo origen tiene lugar en China a fines de 2019, ha desatado la alarma en la comunidad internacional, generando el colapso del sistema de salud en muchas regiones del mundo, además de la severa crisis económica, social y sanitaria que ha provocado esta pandemia, declarada como tal desde marzo de 2020.(1)
La cifra de muertes por esta nueva enfermedad sobrepasa ya los tres millones de personas, especialmente adultos con comorbilidades asociadas, como diabetes mellitus, hipertensión arterial, cardiopatías y cáncer.
Se conoce que el SARS-CoV-2 tiene una elevada tasa de contagios, transmitiéndose rápidamente de una persona a otra a través de la tos o secreciones respiratorias, y por contactos cercanos. Las microgotas respiratorias (más de cinco micras), tienen la capacidad de transmitirse hasta dos metros de distancia, las cuales al hacer contacto con la mucosa de la boca, nariz u ojos propician la entrada del virus al organismo.(1)
Aunque el sistema respiratorio resulta el más afectado por esta enfermedad, hoy se conoce que puede ocasionar daño a cualquier otro órgano,(1) y que predispone también a la enfermedad tromboembólica, debido a la excesiva inflamación, activación plaquetaria, disfunción endotelial y estasis que suele ocasionar la infección por este nuevo beta-coronavirus.
Se ha descrito la coagulopatía como una anomalía común en pacientes con COVID-19, con presencia de elevados niveles de fibrinógeno y dímeros D; esto ha motivado a los expertos a sugerir la consideración de dosis profilácticas de heparina de bajo peso molecular (HBPM) en el tratamiento a todos los pacientes con COVID‐19.(2)
La heparina está constituida por la unión de cadenas alternantes de D-glucosamina y ácido urónico, glucurónico o idurónico. La heparina no fraccionada (HNF) constituye una mezcla heterogénea de cadenas de sacáridos (con peso molecular entre 3.000 y 30.000 Daltons), obtenida a partir de la mucosa intestinal del cerdo o del pulmón de la vaca. La importancia del origen biológico está en la incidencia de trombocitopenia inducida por heparina (TIH), siendo superior con las heparinas de origen bovino (2,9 %), en comparación con las de origen porcino (1,1 %).(3) Su farmacocinética señala que no se absorbe por vía oral, tiene metabolismo hepático y se elimina por vía renal.(3)
Al someter a la heparina al proceso conocido como despolimerización química o enzimática, se obtienen las HBPM, que son fragmentos de menor tamaño (2.000 a 9.000 D), mayormente capaces de inhibir el factor Xa sobre el factor IIa, lo que se asocia con menores problemas hemorrágicos.(3)
Al comparar las heparinas no fraccionadas con las HBPM, se evidencia la óptima biodisponibilidad de estas última, además de que su baja unión a las plaquetas se manifiesta como un menor riesgo de aparición de fenómenos hemorrágicos y de una incidencia mínima de trombopenia inducida (TI).(3)
Continúa siendo relevante el conocimiento de todo lo relacionado con el nuevo coronavirus. Por ello, se describe el curso de un caso de trombocitopenia inducida por HBPM empleada para tratar la COVID-19. Este fue una de las experiencias resultantes de la colaboración médica entre el Contingente Cubano Internacional Henry Reeve y la República de Azerbaiyán.
PRESENTACIÓN DEL CASO
Se presenta un paciente masculino, de 64 años de edad, con antecedentes de hipertensión arterial, para lo cual cumplía su tratamiento regular. Procedente del servicio de Emergencia, refirió ser contacto cercano de un caso positivo de COVID-19 (su hijo), motivo por el cual se le realizó toma de muestra nasal para PCR (siglas en inglés de Reacción en Cadena de la Polimerasa), cuyo resultando fue positivo al virus de la COVID-19. Al día siguiente de realizada la prueba PCR (7 días antes del ingreso), comenzó a presentar síntomas, como tos seca poco frecuente, fiebre de 38 grados centígrados, decaimiento y malestar general. Se conoció, además, que el paciente, durante este período previo a la hospitalización, recibió tratamiento con esquema completo de Favipiravir (1600 mg cada 12 horas el primer día, y luego 600 mg cada 12 horas durante cuatro días), así como dos días con moxifloxacino oral, y 7 dosis de enoxaparina (40 mg) subcutánea como tromboprofilaxis.
El examen físico del sistema respiratorio al momento del ingreso, evidenció el murmullo vesicular disminuido, sobre todo hacia la base pulmonar derecha. Las constantes vitales fueron: frecuencia respiratoria (FR) de 24 respiraciones por minuto, frecuencia cardíaca (FC) de 100 latidos por minuto, tensión arterial (TA) en 160/100 mm/Hg y saturación periférica de oxígeno (SpO2) con aire ambiental en 95 %.
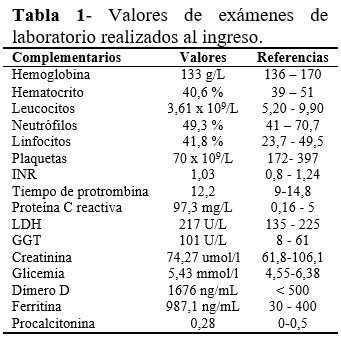
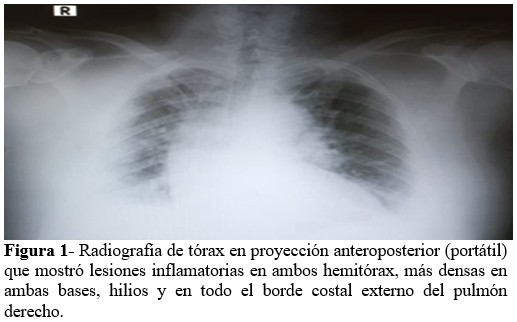
Se realizaron los complementarios de rutina (Tabla 1) y radiografía de tórax (Figura 1). Esta última evidenció lesiones inflamatorias en ambos hemitórax, más densas hacia las bases, hileos y todo el borde costal externo del pulmón derecho. El paciente se diagnosticó como COVID-19 moderado-severo, y se decidió mantener protocolo. Al evaluar los resultados de los complementarios de laboratorio realizados, se encontró trombocitopenia moderada (70 x 109/L) y niveles elevados de Dímero-D (1676), por lo cual se suspendió de inmediato la enoxaparina, ante la sospecha TIH. También se consultó el caso con especialistas de Hematología, y luego de realizar otros exámenes, se descartaron causas secundarias de trombocitopenia, y se decidió mantener la dosis de 100 mg diarios de aspirina como tromboprofilaxis, además del seguimiento estrecho de la evolución del paciente y de su recuento plaquetario. Luego de dos días hospitalizado, comenzó a necesitar oxígeno suplementario a bajo flujo por catéter nasal para alcanzar una SpO2 por encima de 94 %, junto a 6 mg diarios de dexametasona, e inició tratamiento con Remdesivir a dosis establecida durante 5 días. También a partir del segundo día de ingreso, el conteo de plaquetas comenzó a ascender paulatinamente (92), y al cuarto día fue de 120 x 109/L; al sexto día se mostraron dentro de límites normales (215) y al noveno día ya el recuento plaquetario fue de 254 x 109/L. El paciente evolucionó favorablemente, sin otras complicaciones. La prueba de PCR evolutiva fue negativa, y se decidió su egreso.
DISCUSIÓN
Se ha demostrado que en pacientes infectados por el nuevo coronavirus SARS-CoV-2, prevalece el riesgo incrementado de enfermedad tromboembólica venosa (ETEV), al existir mecanismos favorecedores donde se incluye la presencia de una estasis venosa debido a la disminución de la movilidad, secundaria a diversos factores (astenia intensa provocada por la infección, inmovilización hospitalaria); por otro lado, la tormenta de citoquinas que precipita el inicio del síndrome de respuesta inflamatoria sistémica (SRIS) y trae como consecuencia un proceso de tromboinflamación e hipercoagulabilidad, condiciona un alto riesgo trombótico; y por último, la presencia del daño endotelial que provoca la unión del virus a su receptor (enzima de conversión de la angiotensina II).(4)
Se conoce que los casos de COVID-19 que presentan determinadas alteraciones de la hemostasia, como el tiempo de protrombina (TP), las plaquetas, el fibrinógeno y el dímero-D, corren un riesgo mayor de desarrollar una coagulopatía intravascular diseminada (CID), y por consiguiente, mayor probabilidad de morir.(4)
Se postula que la principal causa de la inflamación pulmonar y su consecuencia directa, el deterioro del intercambio gaseoso, lo constituye el aumento de citoquinas, estimulándose la fibrinolisis pulmonar y provocando así un incremento en los niveles del dímero-D.(4)
El encamamiento inevitable causado por la hospitalización, unido a las características propias de la COVID-19, con la consecuente producción de citoquinas que conducen a un estado proinflamatorio y procoagulante, con aumento en la formación de trombina y disminución de la fibrinólisis y de los mecanismos anticoagulantes, hacen crucial el empleo de la profilaxis antitrombótica; casos en los cuales las HBPM o el fondaparinux (de elección en caso de TIH o situaciones de alergia) son los medicamentos de elección a utilizar.(4)
Según las recomendaciones de la International Society on Thrombosis and Hemostasis (ISTH), deben recibir HBPM a dosis profilácticas, todos aquellos pacientes con COVID-19 que requieran hospitalización, a menos que esté contraindicado por la presencia de sangrado activo o descenso plaquetario por debajo de 25 x 109/L5, o menor de 30 x 109/L;(4) presenten o no factores de riesgo protrombótico asociados.(4,5,6)
La aplicación profiláctica de HBPM, aunque muy recomendada por expertos, no está exenta de eventos secundarios, siendo una de sus complicaciones más graves la trombocitopenia; en tal sentido, se ha documentado una incidencia elevada, del 6,9 %, al analizarse retrospectivamente una cohorte de enfermos afectados por la COVID-19, la cual parece sugerir que la TIH pudiese producirse de forma espontánea como resultado de la infección por el SARS-CoV-2; se señala, además, que en pacientes con fuerte sospecha de TIH hay que suspender dicho tratamiento y/u optar por continuarlo con un anticoagulante alternativo, como profilaxis a su vez del alto riesgo de trombosis inducida por TIH.(7)
Se habla de trombocitopenia cuando se produce una disminución en el número de plaquetas, la cual se puede expresar por un tiempo de sangría prolongado. De forma general es considerado como límite inferior de la cifra de plaquetas el valor de 150 x 109/l, existiendo pocas manifestaciones clínicas entre los límites de 50-150 x 109/l, a menos que se asocie con una disfunción plaquetaria. Cuando el número de plaquetas oscila entre 20-50 x 109/l aparecen entonces hemorragias espontáneas mínimas como hematomas, petequias, equimosis y epistaxis, además de hemorragias posquirúrgicas. Por otro lado, cuando se produce un recuento inferior a 20 x 109/l, las hemorragias son graves, se involucran las membranas de las mucosas y puede surgir una púrpura grave.(8)
Aunque la complicación más temida del uso de la heparina sigue siendo la hemorragia, la TIH constituye un evento poco frecuente, pero grave, del tratamiento con cualquier tipo de heparina, la cual es mediada por la formación de anticuerpos contra el complejo heparina-factor plaquetario 4 (FP4), y se caracteriza por la presencia de trombocitopenia moderada y la asociación paradojal de trombosis arterial o venosa. Dicha reacción prevalece más en los pacientes que han recibido HNF intravenosa que en quienes han sido tratados con HBPM.(11)
Aunque existen excepciones en el inicio de su presentación, lo típico es que la disminución del recuento de plaquetas suceda tras 5-10 días de haberse iniciado la exposición a la heparina. Se conocen dos variedades clínicas, con diferencias en el inicio, duración y gravedad de esta.(8,9)
Por un lado, se describe la TIH tipo I, que representa un 10-20 % de los pacientes que reciben heparina, aparece durante los primeros cuatro días de su uso, donde el conteo plaquetario rara vez cae a menos de 100 x 109/l y generalmente no aparece sangrado o trombosis, de manera que constituye una forma benigna de TIH.(8) Y está la TIH tipo II, presente entre un 2-30 % de los pacientes, luego de cinco a 14 días de iniciada la administración de heparina, pudiendo ocurrir inmediatamente en aquellos previamente expuestos al fármaco (especialmente en los tres meses anteriores); cuando se suspende, la cifra de plaquetas regresa a sus valores normales en un período de cinco a siete días.(8,9)
En la TIH tipo I prevalece la agregación plaquetaria inducida por la heparina con posterior secuestro esplácnico, mientras que en la tipo II, se involucra un proceso humoral inmune; donde se incluye: la unión no inmunológica y reversible de la heparina a la superficie plaquetaria; la formación de complejos heparina- factor plaquetario 4 (H-PF4), y se neutraliza así la acción anticoagulante de esta; la formación de anticuerpos dependientes de heparina (especialmente IgG); la unión de la IgG dependiente de heparina al receptor en la superficie plaquetaria; y por último, la destrucción de los agregados plaquetarios por el sistema reticuloendotelial, todo lo cual provoca la trombocitopenia.(8)
La incidencia de TIH es considerada de hasta un 3 % para la HNF y de menos del 1 % para las HBPM, según se reconoce internacionalmente.(8)
Cuando aparece un recuento plaquetario bajo en un paciente que recibe heparina, es necesario recurrir a determinados criterios para establecer el diagnóstico de TIH:(8)
1. Trombocitopenia que ocurre durante la administración de heparina.
2. Exclusión de otras causas de trombocitopenia (infección, otras drogas o trombocitopenia autoinmune).
3. Trombocitopenia que se resuelve luego de suspender la administración de heparina.
4. Demostración de anticuerpos antiplaquetarios heparino-dependientes por una prueba in vitro.
La trombocitopenia en estos casos se presenta como una disminución relativa del 50 % o más del número de plaquetas en comparación al conteo basal, o como la caída absoluta de las plaquetas a un nivel inferior o igual a 150 x 109/L; con un nadir que tiende a estar entre 50 x 109/L y 80 x 109/L, pudiendo encontrarse valores tan bajos como 20 x 109/L, o tan altos como 150 x 109/L, todo lo cual está en dependencia de los valores basales previos al inicio del tratamiento con heparina. Cuando aparecen cifras menores a 20 x 109/L, suelen ser pacientes complicados con CID.(12)
Aunque la trombocitopenia no suele ser severa, se describe por la literatura que la mitad de los pacientes pueden tener un curso asintomático, señalándose que pueden asociarse complicaciones que amenazan la vida hasta 30 días posteriores del diagnóstico inicial; y que en 25-50 % de los pacientes puede aparecer trombosis venosa profunda en miembros inferiores y hasta la mitad de estos podrían complicarse (embolismo pulmonar).(12)
La THI se asocia con morbilidad y mortalidad elevadas, de ahí la importancia de realizar el diagnóstico correcto, para el cual existen métodos como ELISA (del inglés Enzyme Linked Immunosorbent Assay) para medir el factor plaquetario 4 (PF4), el cual es sensible pero inespecífico; y el ensayo para evaluar la liberación de serotonina (SRA), que es más específico y es considerada como la prueba patrón de referencia para el diagnóstico (solo disponible en algunos laboratorios).(12)
Con el paso de los años se ha podido demostrar la importancia del índice clínico preprueba de las 4T (4T), el cual tiene buen valor predictivo negativo (VPN), pero valor predictivo positivo variable; o sea, una preprueba de las 4T baja, normalmente excluye la TIH, y una alta no demuestra que exista la enfermedad (Tabla 2);(10,11,12) dicha prueba se valora por una puntación que va desde 0 a 8, con intervalos de 0-3, 4-5 y 6-8, identificando como baja, intermedia y alta, respectivamente, la probabilidad de TIH.(12) Los puntos obtenidos en cada categoría se suman, y de la siguiente manera se obtiene la probabilidad preprueba de trombocitopenia inducida por heparina: 6-8: alta probabilidad; 4-5: probabilidad intermedia; 0-3: probabilidad baja.
Cuando existen casos de puntuación baja, es poco probable que ocurra TIH, y es posible continuar con el fármaco; sin embargo, cuando prevalece una puntuación alta, debe suspenderse de inmediato, con la consecuente administración de una terapia antitrombótica alternativa,(12) dentro de la cual se encuentran los antiagregantes plaquetarios,(8) y deben realizarse pruebas específicas para confirmar el diagnóstico.(12) Se debe señalar que en aquellos pacientes con antecedentes de TIH, se sugiere evitar la heparina de por vida.(9)
En el caso expuesto anteriormente, se evidenció que después del paciente recibir 7 dosis de enoxaparina subcutánea, el recuento plaquetario presentó su nadir en 70 x 109/L, fueron descartadas otras causas de trombocitopenia por parte de Hematología, y aunque no hubo disponibilidad para la realización de las pruebas de laboratorio específicas para este tipo de trastorno, sí se demostró la utilidad del Score de las 4T para el diagnóstico de TIH, resultando una puntuación de 6 (alta probabilidad), lo cual se confirmó con el ascenso de las plaquetas a partir de las 48 horas posteriores a la suspensión de la enoxaparina y su normalización en menos de una semana.
Aunque se describen numerosas escalas para estadificar el riesgo de TIH, actualmente se conoce que las escalas, a punto de partida de las manifestaciones clínicas, tienen más relevancia y son las más empleadas.(12)
Es de resaltar que, aunque se ha avanzado significativamente en el conocimiento de la COVID-19, aún existen aspectos sin una explicación concreta. El presente caso clínico demuestra que, al ser el uso de la enoxaparina una de las principales recomendaciones en los pacientes hospitalizados con esta enfermedad, se debe estar alerta ante la posible aparición de TIH, con vistas a realizar el diagnóstico oportuno y evitar el resto de las posibles complicaciones que pueden derivar de su empleo.
Conflicto de intereses:
Los autores no presentan conflicto de intereses.
Contribución de los autores:
Conceptualización: Ruber Ortiz Legrá, Mayvi Pérez Castillo, Andrés Pavel Peña Batista.
Visualización: Ruber Ortiz Legrá, Mayvi Pérez Castillo, Andrés Pavel Peña Batista.
Redacción -borrador original: Ruber Ortiz Legrá, Mayvi Pérez Castillo, Andrés Pavel Peña Batista.
Redacción -revisión y edición: Ruber Ortiz Legrá, Mayvi Pérez Castillo, Andrés Pavel Peña Batista.
Financiación:
Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos, Cuba.