INTRODUCCIÓN
El envejecimiento de la población mundial es hoy un hecho ineludible y se conocen perfectamente sus causas determinantes, entre las que se encuentran la disminución de las tasas de fertilidad, la notable reducción de la mortalidad en las primeras etapas de la vida y el descenso de la mortalidad de las personas adultas.1
No obstante, cuando enfocamos las causas o determinantes del envejecimiento individual, como proceso, el análisis resulta más complejo. Desde el punto de vista biológico, el envejecimiento se asocia a la acumulación de daños moleculares y celulares, que con el paso del tiempo provocan la disminución gradual (aunque con una gran variabilidad de un individuo a otro) de las reservas fisiológicas y de la capacidad funcional, aumentando el riesgo de enfermar y de morir.2,3
Algunos autores definen el envejecimiento como la claudicación, a cierta edad, de las habilidades del organismo humano para mantener a los tejidos somáticos, lo que depende de las inversiones metabólicas que este o la especie hayan realizado para ello.4
Para otros, el envejecimiento es un misterio y lo definen como el proceso que convierte a jóvenes adultos, por lo general saludables e independientes, en adultos mayores cuyo deterioro fisiológico incrementa progresivamente sus necesidades de asistencia y el riesgo de enfermar y de morir.5
Según aparecen diversas definiciones del envejecimiento como proceso biológico, a través del tiempo se han enunciado múltiples teorías para explicar sus causas (más de 300), que incluyen en su contenido la descripción de cientos de mecanismos celulares y moleculares específicos que contribuyen a la biología intrínseca del envejecimiento y que, de una forma más sintética, constituyen un pequeño número de teorías principales.6,7
La inflamación crónica está asociada con el envejecimiento y juega un papel causal en varias enfermedades relacionadas con la vejez, como el cáncer, la ateroesclerosis y la osteoartritis. La fuente de esta inflamación crónica es a menudo atribuida a la activación de las células inmunes a lo largo del tiempo.8
La teoría o mecanismo del envejecimiento oxidativo inflamatorio (oxi-inflamm-aging), ha surgido en años recientes como hipótesis causal de muchas alteraciones que ocurren durante el envejecimiento, así como las de varias enfermedades relacionadas con la vejez.
Este artículo tiene como objetivo describir los elementos teóricos que enuncian la teoría del envejecimiento oxidativo inflamatorio (EOI), así como sus implicaciones para la práctica clínica, teniendo en cuenta sus vínculos con las principales enfermedades asociadas con el envejecimiento.
DESARROLLO
Inmunosenescencia e inflamación
En el sistema inmunitario aparecen cambios significativos vinculados con el envejecimiento, denominados inmunosenescencia (IS). En la actualidad se discute si la IS es un proceso intrínseco del envejecimiento (en particular por la involución del timo) que conduce a la desregulación de la inmunidad, o es una respuesta adaptativa del individuo a la exposición continua de patógenos (en particular infecciones virales prolongadas como la del citomegalovirus), o a exposición a antígenos a lo largo de la vida.9-11
El compromiso de la función inmunitaria con el envejecimiento afecta tanto la inmunidad innata como la adaptativa, y en esta última, particularmente el compartimiento de células T.12,13 Otro hallazgo distintivo de la IS es la desviación de la respuesta de citoquinas tipo TH1 de las células T CD4 auxiliadoras a una respuesta de tipo TH2 con el consiguiente aumento de los niveles de citoquinas pro inflamatorias, todo lo cual contribuye a la desregulación de la respuesta inmune con predominio de la inflamación crónica de bajo grado.14
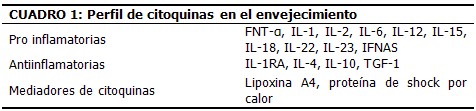
Las personas de larga vida (por ejemplo, los centenarios) parecen enfrentar la inflamación subclínica a través de una respuesta antiinflamatoria. Las citoquinas son la expresión de una red de compuestos que requiere genes, polimorfismos y ambiente, y están involucradas tanto en la inflamación como en la antiinflamación (Cuadro 1). La inflamación pudiera ser la clave para comprender el envejecimiento y la antiinflamación uno de los secretos de la longevidad.15
El envejecimiento oxidativo-inflamatorio (oxi-inflamm-aging)
Los estudios señalan que existe una correlación importante entre envejecimiento e inflamación. Freund y cols8 señalan que existe un incremento de 2-4 veces en los niveles séricos de mediadores pro inflamatorios en individuos mayores de 50 años en relación con sujetos más jóvenes. Además, las personas centenarias saludables tienen un perfil inflamatorio más bajo que los centenarios frágiles.16 Se ha demostrado también un elevado estado inflamatorio en los adultos mayores frágiles, marcado por altos niveles de IL-6 y proteína C reactiva e incremento en el número de leucocitos circulantes.17
Teniendo en cuenta muchos de estos aspectos, se ha propuesto una nueva teoría integradora del envejecimiento que une elementos de la teoría de los radicales libres propuesta por Hartman en 1956,18 la teoría mitocondrial de Miquel (1980)19 y la teoría inflamatoria, conjunto al que se denomina oxi-inflamm-aging y que fue propuesta en el 2008 por De la Fuente.20
Básicamente, las teorías de radicales libres y mitocondrial, postulan que el envejecimiento es la consecuencia de la acumulación del daño oxidativo en las biomoléculas, causada por la elevada reactividad de los radicales libres y las especies reactivas de oxígeno (ERO), producidas en todas las células, especialmente en las mitocondrias, organelos donde es utilizado necesariamente el oxígeno en el metabolismo oxidativo.20 Las mitocondrias constituyen el sitio mayor productor y a la vez la principal diana de las ERO, pues estos deterioran el ADN mitocondrial (ADNmt) y sus funciones, lo que a su vez ocasiona un círculo vicioso al aumentar la producción de ERO. La formación de mutaciones en el ADNmt puede acelerarse debido a este proceso cíclico, lo que pudiera provocar envejecimiento acelerado.21,22
Los altos niveles de daño oxidativo provocan cambios celulares clave que incluyen una reducción del NAD (+) disponible, una molécula esencial requerida para un número de procesos celulares vitales que incluyen la reparación del ADN, la señalización inmune y los procesos epigenéticos.23
Para protegerse de la toxicidad del oxígeno, las células tienen varios mecanismos antioxidantes que previenen la formación de ERO, también pueden neutralizarlas después de su generación (sistemas de la superóxido dismutasa, catalasa y glutatión reductasa).24,25 Estos sistemas defensivos no son perfectos y cuando la concentración de ERO sobrepasa la capacidad de estos sistemas para aclararlos, aparece una situación de estrés oxidativo que daña a las biomoléculas (lípidos, proteínas y ADN) y a las estructuras celulares (membranas, mitocondrias y material nuclear).26 De esta forma, las funciones celulares y del organismo se basan en un perfecto balance entre los niveles de ERO y antioxidantes.27
La teoría oxidativo-inflamatoria del envejecimiento28,29 sugiere que este proceso está vinculado a un estrés oxidativo crónico, que afecta a todas las células del organismo, pero especialmente aquellas de los sistemas regulatorios (nervioso, endocrino, inmune). Estos sistemas, como consecuencia, disminuyen su capacidad para preservar su estado redox, con pérdidas funcionales incompatibles con un adecuado mantenimiento de la homeostasis, hecho fisiológico cardinal del envejecimiento.
En esta teoría se le atribuye un papel principal al sistema inmune, toda vez que la desregulación de sus respuestas, incrementada por el estrés oxidativo, puede conducir a un aumento de producción de citoquinas proinflamatorias, lo que produce un estado inflamatorio crónico de bajo grado que contribuye a la generación de más ERO, por lo que se produce un círculo vicioso oxidación-inflamación-oxidación.30
El sistema inmune, debido a su necesidad de generar continuamente compuestos oxidativos e inflamatorios, puede activar, si no está bien regulado, al factor nuclear κB (FN-κB); este, después de alcanzar cierto nivel de activación, estimula la expresión de genes que programan la producción de estos compuestos, contribuyendo al proceso cíclico ya mencionado.31
De esta forma, tanto el estrés oxidativo como el estrés inflamatorio al deteriorar la homeostasis fisiológica, provocarían el oxi-inflamm-aging.
Implicaciones para la práctica clínica
En la actualidad se acepta que la inflamación crónica es la principal condición subyacente en muchas enfermedades relacionadas con el envejecimiento como la ateroesclerosis, osteoartritis, cáncer, diabetes, osteoporosis, demencia, enfermedades vasculares, obesidad y síndrome metabólico (Cuadro 2).32,33 En las poblaciones humanas envejecidas, la disfunción metabólica, y en particular la resistencia a la insulina y los trastornos inflamatorios, son muy comunes y el identificar los mecanismos moleculares que subyacen en la integración metabólica-inmune, cobra importancia para la comprensión de la etiopatogenia de estas enfermedades y su abordaje terapéutico. Por otra parte, la identificación de vías que controlan la inflamación relacionada con la edad, es también valiosa para comprender si los tratamientos enfocados a modular el oxi-inflamm-aging pueden ser beneficiosos para la longevidad.34 En este sentido, los estudios se han dirigido al uso de antioxidantes y a modificaciones de los estilos de vida, como la restricción calórica y el ejercicio físico.
Resultaría muy extenso este artículo si se abordaran todos los pormenores de la patogenia de las enfermedades crónicas relacionadas con el envejecimiento, por lo que solo nos referiremos a la importancia de la inflamación como mecanismo productor en tres de las más prevalentes en las personas ancianas: ateroesclerosis, cáncer y demencia.
Inflamación y ateroesclerosis: El daño de las células endoteliales incrementa la producción de ERO por las células vasculares, provocando una respuesta inflamatoria y el inicio de la ateroesclerosis.35 El estrés oxidativo está involucrado también en el metabolismo lipídico, en la ruptura de la placa, la trombosis, el daño miocárdico, la apoptosis, la fibrosis y la insuficiencia cardiaca.36 Recientes estudios aportan fuertes evidencias de que la calcificación vascular está asociada con el estado inflamatorio y se incrementa con las citoquinas inflamatorias.37
Inflamación y cáncer: Varias revisiones sugieren una relación directa entre la inflamación crónica y el cáncer.33,37 Las moléculas clave que vinculan la inflamación con las alteraciones genéticas celulares en el cáncer, son las prostaglandinas, las citoquinas, el FN-κB, quimioquinas y factores angiogénicos. Los principales efectores químicos son las ERO, derivadas de las reacciones inflamatorias, que pueden actuar directa o indirectamente dañando factores de transcripción como el FN-κB. Estas observaciones sugieren que el oxi-inflamm-aging contribuye a la inducción y progresión del cáncer por la vía de señalización del FN-κB.
Inflamación y demencia: Las investigaciones sugieren que la inflamación crónica puede ser un importante contribuyente para el desarrollo de enfermedades neurodegenerativas, en particular la demencia.33,38 Se plantea que el IFN-γ y otras citoquinas proinflamatorias, interactúan con el proceso de producción del péptido beta amiloide, el hallazgo distintivo de la enfermedad de Alzheimer.39 Además existe inmunorreactividad para citoquinas como la interleuquina 6 (IL-6), el factor de necrosis tumoral α (TNF-α) y el factor de crecimiento transformante b (TGF-b).40
Restricción calórica
Aunque se ha demostrado que la restricción calórica (RC) es un método para reducir la producción de ERO, esta enlentece el envejecimiento y extiende la vida máxima en diversas especies animales;41-43 sus efectos sobre la resistencia a la enfermedad y la mortalidad en los primates – los mamíferos más cercanos al hombre –, no son muy consistentes. Un primer estudio de 20 años de seguimiento en monos Rhesus en los que se utilizó RC sin malnutrición, demostró una disminución de la incidencia de enfermedades relacionadas con la edad (diabetes, cáncer, enfermedad cardiovascular y atrofia cerebral).44 No obstante, otro estudio de seguimiento de 23 años de primates jóvenes a los que se sometió a RC, mostró igualmente una demora en el comienzo de las enfermedades asociadas al envejecimiento, pero sin mejoría en las curvas de supervivencia.45
La RC en humanos, de la que recientemente se publican algunos resultados, en la mayoría de los casos implica reducción del consumo de calorías de un 25-40 % en relación con el ingreso normal de alimentos, por lo que se ha considerado una severa intervención con resultados tanto beneficiosos como perjudiciales. Recientes ensayos clínicos de restricción de 25 % de calorías en humanos, han demostrado mejoría en predictores de longevidad como disminución de la tasa metabólica en reposo, del FNT-α y de los factores de riesgo cardiometabólicos,46 aunque se señala como efecto adverso importante la disminución de la densidad mineral ósea en sitios clínicamente importantes para fracturas osteoporóticas como cuello femoral y columna lumbar.47
Algunos autores consideran actualmente que los efectos de la RC sobre el envejecimiento, no son simplemente el resultado de la reducción de la cantidad de las calorías consumidas, sino también de la composición de la dieta, y que resulta más conveniente realizar intervenciones periódicas (ciclos) de RC no tan estricta (reducción de menos de 20 % de calorías), que intervenciones prolongadas.48
Lo que sí parece quedar claro es que el menor consumo de calorías y de la dieta llamada saludable, en comparación con la llamada dieta occidental, mejora los parámetros de envejecimiento saludable, como se demuestra en un estudio reciente.49 Actualmente se está desarrollando un estudio multicéntrico con mejor diseño (CALERIE fase 2), con RC de un 25 % que medirá aspectos médicos, físicos y psicológicos conductuales, que podrán brindar más luz sobre esta intervención en un futuro mediato.50
Antioxidantes: Los antioxidantes protegen al organismo de los efectos dañinos de los radicales libres y las ERO, producidos normalmente en el metabolismo oxidativo, donde los nutrientes y el oxígeno se transforman en energía. El descubrimiento de los antioxidantes aumentó la esperanza de poder enlentecer el envejecimiento, añadiéndolos simplemente a la dieta. Sin embargo, los estudios con suplementos antioxidantes han brindado poco apoyo a esta conclusión y se necesitan estudios epidemiológicos a gran escala para aclarar esta interrogante. Por el momento lo que existe es una evidencia positiva para la salud respecto al consumo de frutas y vegetales, los alimentos más ricos en antioxidantes naturales.51
Una revisión reciente de ensayos clínicos sobre el suplemento de antioxidantes (vitamina C, vitamina E, resveratrol, curcumina, hidroxitirosol y coenzima Q10) y su influencia en las enfermedades relacionadas con el envejecimiento, también muestra resultados controversiales, lo que se trata de explicar por una incorrecta selección inicial de los pacientes, al no realizarse una caracterización cuantitativa del estado redox de cada individuo y no tener en cuenta tanto las demandas individuales como el trasfondo genético de estos.52
El uso de resveratrol, un antioxidante componente de las uvas, ha sido un tema de intensa investigación en las últimas décadas. Recientes investigaciones han sugerido que los productos de la uva en su conjunto (que contiene además de resveratrol, catequinas, polifenoles y flavoniodes), pueden ayudar al mantenimiento de la salud cardiovascular y brindan protección frente al envejecimiento, sus enfermedades asociadas, la neurodegeneración y el cáncer.53
Un estudio de seguimiento por tres, seis, nueve y más años (Aging in Chianti Project), encontró que los ancianos expuestos a una dieta habitual con alto contenido en resveratrol, tuvieron menor riesgo de desarrollar síndrome frágil, pero solo durante los primeros tres años, no después.54
Ejercicio y actividad física
Los beneficios del ejercicio y la actividad física para la salud, son indiscutibles. Las evidencias son múltiples, basadas en estudios experimentales y epidemiológicos, de que tanto el ejercicio como el entrenamiento físico, combaten las secuelas del envejecimiento, en particular el síndrome frágil. Se ha demostrado que el ejercicio tiene acciones antioxidantes y antiinflamatorias, ejercidas fundamentalmente sobre el tejido adiposo, el músculo esquelético, el sistema inmune y el sistema cardiovascular, modulando el perfil de citoquinas anti/proinflamatorias, factores de transcripción redox-sensitivos como el FN-κB, el activador de proteína-1, enzimas pro oxidantes y antioxidantes y proteínas reparadoras como la proteína del shock por calor, el complejo del proteosoma, la glicosilasa de ADN oxiguanina, la glicosilasa de ADN uracilo y la telomerasa.55
Un estudio longitudinal encontró que los adultos mayores con un estilo de vida a base de ejercicio moderado o intenso mostraron un perfil menor de citoquinas inflamatorias, menos modificaciones en el compartimiento de células T y sus funciones, y telómeros más largos.56 En la actualidad se desarrollan ensayos bien diseñados sobre el papel del ejercicio de resistencia sobre el sistema inmune y la adaptación muscular, unido a intervenciones nutricionales.57
CONCLUSIONES
Entre las múltiples teorías y mecanismos descritos para explicar el envejecimiento, el oxi-inflamm-aging ha surgido como una propuesta integral basada en investigaciones recientes para revelar la biología intrínseca de este proceso y su relación con las enfermedades relacionadas a él.
La adopción, desde edades tempranas, de un estilo de vida saludable que incluya una dieta balanceada, sin exceso de calorías y rica en antioxidantes naturales, así como el ejercicio físico adecuado y sostenido, pueden ayudar a garantizar un envejecimiento satisfactorio, limitando la fragilidad y conservando la función como medida de calidad de vida.
Aún continúan en investigación los potenciales beneficios de la restricción calórica y de los suplementos de productos antioxidantes con el objetivo de frenar el oxi-inflamm-aging en un intento de lograr mayor longevidad y menor carga de enfermedades asociadas al envejecimiento.