INTRODUCCIÓN
La historia de los antibióticos comienza en 1928 con el descubrimiento de la penicilina. La generalización de su empleo permitió reducir la mortalidad por enfermedades infecciosas. (1-4) Desde entonces y hasta nuestros días se ha desarrollado un elevado número de antibióticos. La gran variedad existente hace necesaria su clasificación. Para ello se utilizan diversos criterios como: el origen, mecanismo y espectro de acción, forma de actuar y estructura química. Este último es el más utilizado en la literatura científica y se fundamenta en la similitud química de los núcleos bases en su estructura molecular; lo que permite agrupar familias con características físico-químicas y farmacológicas comunes. (5) En esta clasificación se destacan los que poseen un anillo betalactámico, los antibióticos más prescriptos en atención primaria y en hospitales. (5,6)
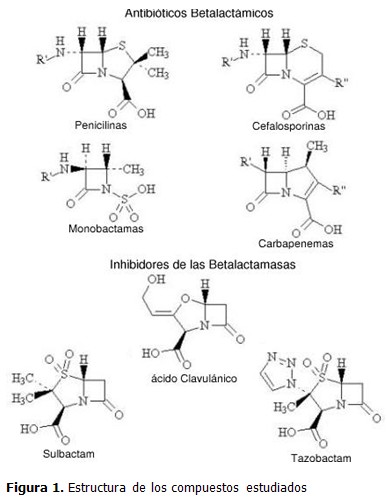
El anillo betalactámico puede fusionarse con otros anillos y tener distintos sustituyentes, dando lugar a cuatro grandes grupos de antibióticos: penicilinas, cefalosporinas, monobactamas y carbapenemas. En esta familia de antimicrobianos suelen incluirse los inhibidores de las betalactamasas; los cuales, a pesar de manifestar una reducida actividad antibacteriana, (5) poseen el anillo betalactámico y tienen una reconocida actividad farmacológica al combinarse con los antibióticos, potenciando su acción.
Los primeros antibióticos betalactámicos conocidos pertenecen al grupo de las penicilinas, formadas por la fusión de los anillos betalactámico y tiazolidínico que originan el ácido 6-aminopenicilánico, con una cadena lateral en la posición 6 del anillo. En las cefalosporinas, muy similares a las penicilinas, el anillo fusionado al betalactámico es el dihidrotiacínico cuyo resultado es el ácido 7-aminocefalosporánico sustituido en las posiciones 3 y 7. Otro grupo de estos fármacos lo constituyen las carbapenemas, originados por la unión de los anillos betalactámico y pirrolidínico, compartiendo el nitrógeno. Por último, el grupo de los compuestos monocíclicos, las monobactamas. La variación en las cadenas laterales condiciona las propiedades y da lugar a la diversidad de miembros de cada una de las familias.
El uso indiscriminado de antibióticos ha provocado en los microorganismos el desarrollo de mecanismos de resistencia que neutralizan la acción de estos fármacos. (6-14) Por tal motivo, no cesan los esfuerzos en la búsqueda de nuevas fórmulas más potentes y generales (9-14), siguiendo variadas y novedosas estrategias. Estas incluyen la caracterización detallada de las macromoléculas diana; el aislamiento y estudio de complejos antibiótico-receptor en los mecanismos de acción y/o antibiótico-macromolécula bacteriana inhibidora en los mecanismos de resistencia; el estudio de propiedades físicas, como la difusión, que influyen directamente en ambos mecanismos; estudios de relación estructura-actividad biológica y la modelación en computadoras de estructuras moleculares, propiedades electrónicas y mecanismos de reacción; entre otras. (14, 20-25)
Los compuestos betalactámicos siguen resultando de interés para los investigadores y se ha llegado a crear una muy amplia colección de nuevos candidatos a convertirse en antibióticos comerciales. (25) Uno de los métodos más utilizado en la búsqueda de nuevas betalactamas biológicamente activas se basa en la relación de esta propiedad con la estructura molecular.
Por tales razones se realizó el presente trabajo con el objetivo de realizar la modelación de la estructura molecular y propiedades electrónicas relevantes para el comportamiento químico de antibióticos betalactámicos e inhibidores de las betalactamasas.
MÉTODOS
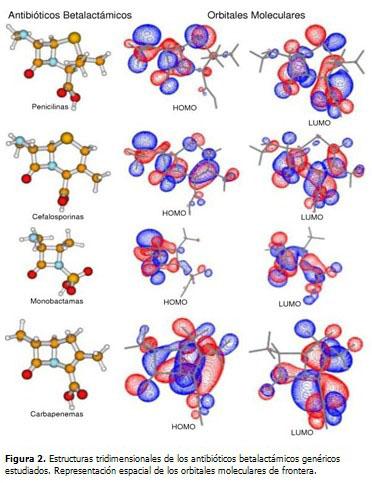
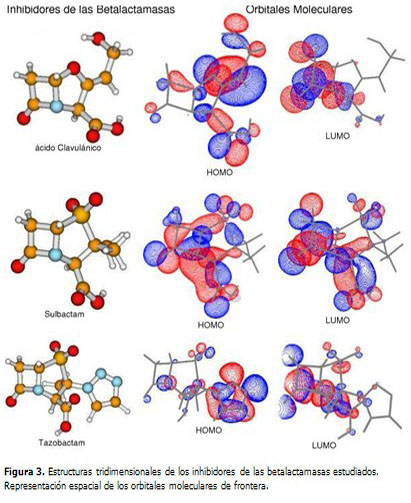
Se realizó un estudio teórico empleando métodos de la mecánica cuántica para modelar la estructura y propiedades electrónicas de antibióticos betalactámicos e inhibidores de las betalactamasas. Se estudiaron 7 moléculas distribuidas en: una representación genérica de cada una de las familias de antibióticos betalactámicos y tres inhibidores de la betalactamasas. En el caso de los antibióticos se utilizó como sustituyente en R' el radical metilo (-CH3) y en R'' el hidrógeno. (Figura 1).
La modelación molecular se realizó utilizando computadoras personales IBM compatibles y las estructuras tridimensionales se obtuvieron mediante la optimización de las geometrías moleculares a un nivel semiempírico, según el modelo parametrizado 3(PM3), (26) empleando el paquete de programas MOPAC, Versión 7.01.3 para Linux. (27)
Una vez obtenidas las geometrías de equilibrio se calcularon las densidades de cargas naturales y los orbitales moleculares, mediante el análisis de los orbitales naturales de enlace según la teoría del funcional de la densidad (Density Functional Theory, DFT) a un nivel B3LYP/6-31G(d) // HF/PM3. (28) Se utilizó la teoría de los orbitales de frontera de Fukui para analizar la reactividad. (29,30) Los cálculos se realizaron con el paquete de programas Gaussian 98 Versión A.7 para Linux. (31) El análisis gráfico se realizó con el programa MOLDEN Versión 3.6. (32,33)
RESULTADOS
Mediante el análisis geométrico se pudieron obtener las estructuras moleculares optimizadas.
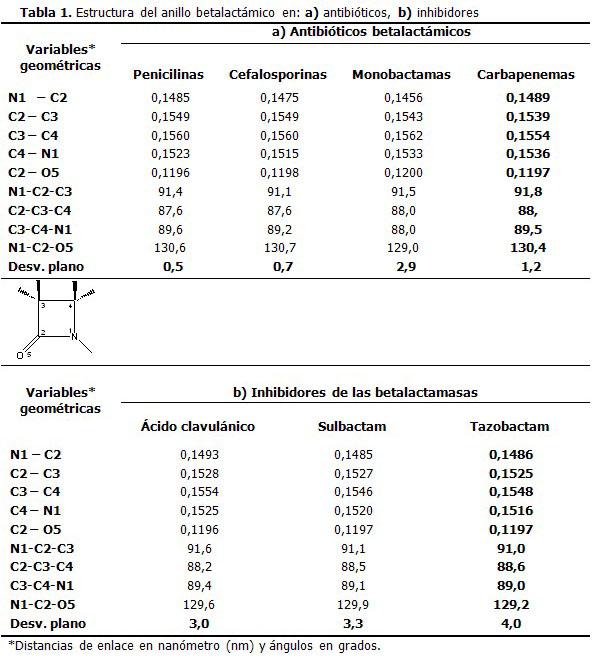
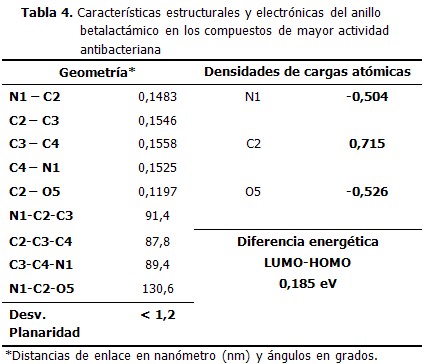
Los valores de las variables geométricas más significativas muestran una estructura muy similar del anillo betalactámico en todos los compuestos estudiados. (Tabla 1).
Las diferencias más significativas corresponden a la desviación de la planaridad. Esta resulta mayor en los inhibidores de las betalactamasas y en las monobactamas, en los cuales la geometría del anillo se aleja entre 2,9 y 4,0 grados del plano. En contraste con ello, la presencia de otro anillo fusionado al anillo betalactámico favorece la planaridad de este último, situación que ocurre en las penicilinas, cefalosporinas y carbapenemas.
Densidades de cargas
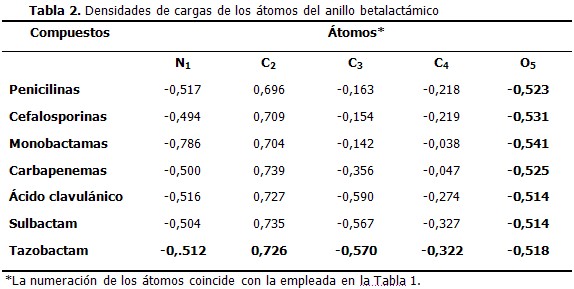
Las mayores densidades de cargas negativas recaen sobre los heteroátomos, nitrógeno (N1) y oxigeno (O5), en orden decreciente. Por su parte, el segundo carbono (C2) constituye el único centro con una marcada densidad de carga positiva. Las variaciones de las densidades de cargas atómicas al pasar de un compuesto a otro se corresponden con las diferencias en el entorno atómico. Así, la densidad de carga negativa en el nitrógeno de las monobactamas (N1) se refuerza por la presencia del grupo –SO3H; mientras que el carbono C3 es menos negativo cuando se encuentra unido al nitrógeno del fragmento –NHCH3. Las mayores variaciones ocurren sobre el carbono C4. De manera análoga a la geometría molecular, el anillo betalactámico muestra poca variabilidad en el comportamiento de las densidades de cargas entre los diferentes compuestos modelados. (Tabla 2)
Orbitales de frontera
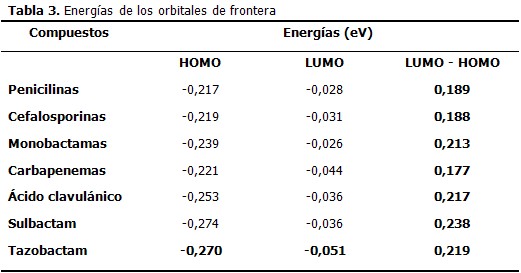
Al analizar los valores de las energías de los orbitales de frontera, así como las diferencias energéticas LUMO – HOMO se pueden diferenciar los compuestos en dos grupos. El primero está formado por las penicilinas, cefalosporinas y carbapenemas con una diferencia energética entre los orbitales LUMO y HOMO que oscila entre 0,177 y 0,189 eV; valores muy bajos que favorecen la existencia de transiciones electrónicas, premisa importante en la reactividad química, esto coincide con la mayor potencialidad de estas moléculas como antibióticos.
El resto de las moléculas estudiadas (monobactamas, ácido clavulánico, sulbactam y tazobactam) conforman el otro grupo, caracterizado por existir mayor diferencia energética entre los orbitales de frontera (valores entre 0,213 y 0,238 eV), lo cual indica que las transiciones electrónicas en estos compuestos estarán menos favorecidas que en los del primer grupo. (Tabla 3)
El análisis de la forma de los orbitales de frontera resulta menos concluyente. En la parte derecha de las figuras 2 y 3 se representa la forma espacial de los orbitales HOMO y LUMO de cada una de las moléculas estudiadas. Como se puede observar, estos orbitales se deslocalizan bastante sobre varios átomos. No se puede definir un comportamiento regular en el aporte individual de cada átomo a los orbitales moleculares de frontera.
Integrando los resultados de las modelaciones realizadas y según los modelos teóricos utilizados en los cálculos, es de esperar que un compuesto con propiedades estructurales y electrónicas en el anillo betalactámico similares a las que se proponen a continuación posea una mayor actividad antimicrobiana. Los valores que representan las principales características estructurales y electrónicas del anillo betalactámico en los compuestos modelados de mayor actividad antibacteriana fueron calculados promediando los obtenidos para estas variables en las penicilinas, cefalosporinas y carbapenemas.(Tabla 4).
DISCUSIÓN
En las modelaciones realizadas se comprobó que el anillo betalactámico no varía estructuralmente de manera significativa. La presencia de un anillo fusionado al betalactámico, aunque no sea aromático, le confiere mayor estabilidad al aumentar las posibilidades de deslocalización de las nubes electrónicas; esto ocurre en las penicilinas, cefalosporinas y carbapenemas. La cercanía al anillo de átomos con elevada electronegatividad como el azufre (S), dobles enlaces y el grupo carboxilo (–CO2H) justifican esta mayor estabilidad.
Las variaciones de las densidades de cargas atómicas más significativas ocurren sobre el carbono C4. Este átomo permite la fusión de otros anillos para formar los antibióticos betalactámicos, siendo esta la posible causa de la dispersión en los valores. A pesar que el nitrógeno N1 también participa en la mencionada fusión, las densidades de cargas sobre él varían muy poco por ser un elemento mucho más electronegativo y atraer fuertemente su nube electrónica. Estos resultados deben ser confirmados empleando modelos teóricos más completos desde el punto de vista matemático, sobre todo al optimizar las estructuras moleculares. Ello elevaría los costos computacionales de la modelación. El interés está dado por la posible relación directa del entorno electrónico en la vecindad del carbono C4 con propiedades que marcan diferencias farmacológicas entre las familias de antibióticos betalactámicos.
El análisis de los orbitales de frontera es utilizado con frecuencia para relacionarlo con la reactividad de las moléculas; así, cuando las diferencias LUMO-HOMO son pequeñas, las moléculas son muy susceptibles electrónicamente y como consecuencia muy reactivas. Esto ocurre con todas las moléculas modeladas en este estudio. Se debe enfatizar que las penicilinas, cefalosporinas y carbapenemas poseen los menores valores energéticos LUMO-HOMO, marcando una diferencia respecto a las monobactamas y los inhibidores de las betalactamasas. Este hecho se corresponde con la mayor actividad antimicrobiana del primer grupo respecto al último.
Todos estos resultados aportan elementos que justifican a nivel molecular el empleo en la práctica médica de las combinaciones de un antibiótico betalactámico del primer grupo con un inhibidor de las betalactamasas, para neutralizar los efectos de la resistencia bacteriana. En esta combinación, los antibióticos son los responsables de la actividad antibacteriana por su mayor reactividad a nivel electrónico y su estabilidad estructural. A nivel molecular, las enzimas betalactamasas de las bacterias tendrán mayor afinidad por el anillo betalactámico del inhibidor, por estar desprotegido estructuralmente y poseer menor fortaleza en sus enlaces.
En el caso de los antibióticos betalactámicos, los orígenes de la resistencia bacteriana están influidos por el propio crecimiento de miembros de una misma familia. Estas se han desarrollado a partir de núcleos estructurales comunes, responsables de la actividad antibacteriana, con variaciones en las cadenas laterales que modifican propiedades como su espectro de acción, entre otras. Si bien esta gran similitud en la estructura molecular garantiza la actividad biológica deseada, hace que los nuevos fármacos sean mucho más susceptibles a los mecanismos de resistencia que han desarrollado las bacterias. Obtener nuevos compuestos que estructuralmente difieran bastante de los existentes, ayudaría a superar los efectos de la resistencia bacteriana. Determinar los orígenes de la actividad antibacteriana a nivel electrónico es una premisa necesaria en la búsqueda de estos nuevos antibióticos.