CONCEPTO
Prótesis valvulares: Son dispositivos diseñados para sustituir las válvulas cardíacas nativas, manteniendo el flujo unidireccional normal del corazón.
La implantación de una válvula artificial permite mejorar la calidad y esperanza de vida de un número importante de pacientes y se puede considerar un tratamiento de rutina en la cardiopatía valvular avanzada. Sin embargo, los potadores de prótesis se hacen acreedores de una nueva patología, derivada de las potenciales complicaciones protésicas y del uso de anticoagulantes.
En los pacientes con prótesis valvulares cardíacas, la mortalidad no difiere de las válvulas mecánicas. Los pacientes con válvulas mecánicas tienen una mayor incidencia de hemorragia y trombo embolismo, mientras que las válvulas bioprotésicas están asociadas a problemas de durabilidad.
Clasificación de las válvulas cardíacas artificiales
Prótesis mecánicas
1.- De esfera en jaula: Starr Edwards.
2. - De disco oscilante: Medtronic-Hall, Carbomedics, St. Jude, Omniscience.
La válvula de St. Jude es la de mayor uso en la actualidad a nivel mundial, tiene una capa de carbón pirolítico y dos discos semicirculares que oscilan entre la posición abierta y la cerrada. Sus características de flujo son favorables y causan menor gradiente transvalvular y mayor gasto cardíaco que las válvulas de esfera en jaula o las de disco inclinadas. La trombogenicidad en posición mitral es menor que en otras válvulas protésicas.
Válvulas biológicas
1.- Homoinjertos: se obtienen de cadáveres.
2.- Autoinjertos: se obtiene del propio paciente.
3.- Heteroinjertos: se obtiene de otras especies (Ejemplo porcina).
A su vez estas pueden estar montadas sobre un soporte más o menos rígido y tener un anillo de sutura similar al de las prótesis mecánicas (prótesis soportadas) o carecer del mismo (prótesis no soportadas o stentless).
Las válvulas biológicas (bioprótesis) se han fabricado en gran medida para salvar el riesgo de tromboembolia que es inherente a todas las prótesis mecánicas, así como el peligro a las inconveniencias concomitantes del tratamiento permanente con anticoagulantes.
Tipos de disfunción
Disfunción protésica intrínseca
Esta complicación, también conocida como fallo estructural primario de la prótesis, se debe al desgaste y rotura del material en las prótesis mecánicas y a la degeneración y calcificación de los velos en las prótesis biológicas
En el momento actual se considera una rareza el fallo estructural primario de una prótesis mecánica
En las prótesis biológicas el fallo estructural primario es la causa más frecuente de disfunción y se debe a los cambios degenerativos de los velos.
El deterioro estructural está en relación con el tipo de prótesis (los homoinjertos duran más que los heteroinjertos), la edad del receptor (niños y adolescentes presentan calcificación precoz), la posición de la prótesis (varios estudios han demostrado que la mitral dura más que la aórtica) y circunstancias diversas (insuficiencia renal, embarazo). La degeneración empieza a hacerse significativa a partir de los 5 años y con el transcurso del tiempo la tasa de fallo se hace exponencial.
Disfunción protésica extrínseca
Se refiere a la disfunción que ocurre por causas ajenas a la propia válvula:
• Fuga peri valvular: es la más común, se produce por una separación entre el anillo de la prótesis y el de la válvula sustituida, se debe a una técnica quirúrgica deficiente o a la mala calidad del anillo receptor. Generalmente aparece a los pocos días o semanas de la operación y constituye una de las causas más frecuentes de reintervención durante el primer año. Puede ser ligera (1-2 mm), severa (zona amplia), masiva (desinserción total). Aparición tardía infrecuente: sospechar endocarditis.
• Tamaño inapropiado de la prótesis en relación al anillo receptor (fenómeno llamado “too-small-to fit”). La persistencia de los síntomas previos a la cirugía o la presencia de insuficiencia cardiaca alertan sobre esta situación, necesitándose en la mayoría de los casos una reintervención precoz.
• Atrapamiento por pannus, que suele presentarse con el transcurso del tiempo, originando un aumento del gradiente transprotésico con la consiguiente disminución de la capacidad funcional del paciente.
• Anemia hemolítica: por flujo turbulento (fuga, fallo estructural, trombosis, prótesis muy pequeñas).
• Trombosis protésica: es una complicación poco frecuente (0-1.5 % al año en las prótesis mecánicas aórticas y 0.5-4 % en las mitrales) pero muy grave. Además es el responsable del 90 % de las obstrucciones de válvulas protésicas. El riesgo de trombosis aumenta en las prótesis de bola enjaulada y las colocadas en posición mitral, en los pacientes con dos prótesis y en los que siguen un tratamiento anticoagulante inadecuado.
DIAGNÓSTICO
La presencia de disnea, manifestaciones de insuficiencia ventricular aguda, síncope, dolor precordial, o menos frecuente, cuadro de paro cardiorrespiratorio puede ser la forma de presentación clínica
La exploración física de pacientes con una prótesis valvular es diferente de aquellos con válvulas nativas, porque las válvulas protésicas son inherentemente estenóticas y producen sonidos protésicos adicionales.
La auscultación normal de las prótesis de dos discos (más usadas en la actualidad) en posición aórtica se caracteriza por: Primer ruido normal, chasquido de apertura, soplo proto-meso sistólico eyectivo, chasquido de cierre seguido del componente pulmonar del segundo ruido.
La posición mitral se caracteriza por chasquido de cierre, segundo ruido, chasquido de apertura y soplo mesodiastólico.
En casos de trombosis disminuye o desaparece el chasquido de cierre apareciendo además un soplo diastólico en posición aórtica u holosistólico de alta frecuencia en la mitral con aumento en la intensidad de los soplos que existían previamente.
Es frecuente la presencia de crepitantes, tercer ruido, hipotensión e incluso shock cardiogénico franco.
El electrocardiograma es inespecífico, en el Rx de tórax es frecuente los signos de edema pulmonar. El ecocardiograma constituye el medio fundamental para el diagnóstico definitivo de esta entidad, requiriéndose un profundo conocimiento de los perfiles de construcción y hemodinámica de las diferentes prótesis.
La ecocardiografía bidimensional (2D) puede identificar alteraciones estructurales graseras en una prótesis tales como trombos, vegetaciones, dehiscencias, pero su sensibilidad para la disfunción de las prótesis cardíacas se ve limitada por la dificultad para visualizar las estructuras que rodean y están posteriores a la prótesis cardiaca. La reflexión de ecos sobre el material protésico, la atenuación del haz de ultrasonidos y las múltiples reverberaciones de los ultrasonidos a partir de las prótesis ocasionan dificultades de interpretación.
Las imágenes Doppler y de flujo en color detectan con más fiabilidad la disfunción protésica. La primera permite evaluar la velocidad del flujo a través de una prótesis valvular y, por tanto la determinación de los gradientes de presión (ver tabla). Las imágenes de flujo en color son la principal técnica utilizada para la detección de insuficiencia de una prótesis valvular.
Prótesis valvulares – Valores normales
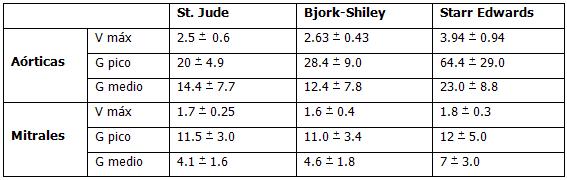
La ecocardiografía transesofágica (ETE) resulta esencial para la valoración de las insuficiencias de las prótesis mitrales y tricuspídea y en ocasiones, de la insuficiencia de prótesis aórticas. La ETE también es útil para la evaluación de trombos, masas, abscesos y dehiscencias.
El movimiento de la prótesis valvular, especialmente el de las válvulas protésicas mitral y tricúspide, se ve más claramente por ETE.
Tratamiento de la trombosis valvular protésica
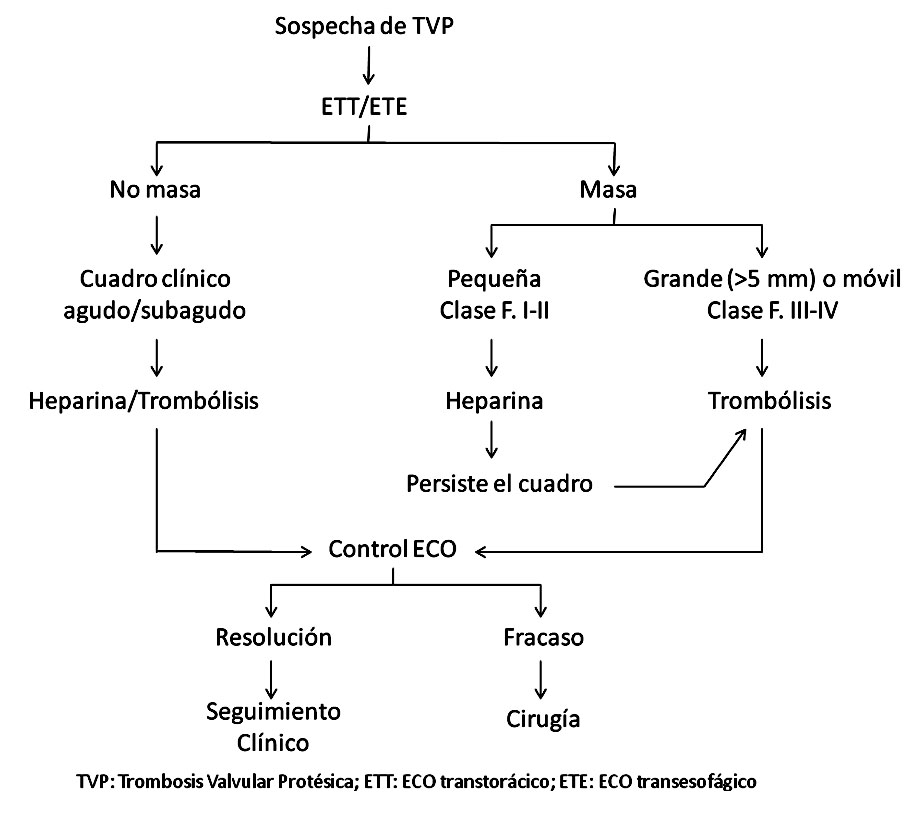
En la actualidad es una disyuntiva en discusión, ¿trombolisis o cirugía?, aunque la terapia médica ha ganado adeptos. Si embargo, no existe ningún estudio aleatorizado que compare estas dos modalidades terapéuticas y la observación disponible procede de estudios observacionales.
Teniendo en cuenta las características de nuestro centro se sugiere el siguiente esquema:
Pacientes con trombosis y evidencia de obstrucción valvular (clase funcional III-IV)
Trombólisis: Estreptocinasa, bolo 250 000 U disueltas en 100 ml de Dextrosa 5% o solución salina al 0.9% a durar 30 minutos.
Dosis de mantenimiento: 100 000 U/hora en 24 horas, pudiéndose continuar por 72 horas si es necesario (2 500 000 U en 500 ml).
Si no hay mejoría a las 24 horas, o si no ha resuelto a las 72 h, debe detenerse el tratamiento y coordinar cirugía de urgencia (recambio valvular).
Una vez completada la trombólisis deben iniciarse con heparina intravenosa para mantener un tiempo parcial de tromboplastina activada con caolín (TPTK) de 2-3 veces el control y warfarina oral para lograr un cociente internacional normalizado (INR) entre 3-4 para prótesis y entre 3.5-4.5 para las mitrales y pacientes con doble prótesis.
La urorcinasa en dosis de 4.400 U/h y el activador tisular del plasminógeno (t-PA) 100 mg (10 mg en bolo, seguidos de una perfusión con la dosis restante durante 5 horas) son alternativas de la estreptocinasa.
Pacientes con trombos pequeños clase funcional I o II (hemodinámicamente estables).
Iniciar tratamiento con heparina intravenosa en dosis para mantener un TPTK de 2-3 veces el control, con la finalidad de propiciar la fibrinólisis endógena; si no hay resolución del trombo se puede proceder al tratamiento fibrinolítico descrito previamente y/o considerar la opción quirúrgica.
Si la respuesta es favorable, iniciar warfarina oral para obtener rango de INR descrito anteriormente.
Es evidente que el resultado del tratamiento (trombolisis y/o heparina) debe ser seguido muy de cerca mediante ecocardiografía que verifique la normalización de la disfunción protésica. Se han propuesto exploraciones repetidas con ETE, pero la mayoría de los autores coincide en que basta con Eco transtorácico-Doppler en la mayoría de las ocasiones.
Ventajas del tratamiento trombolítico
Tasa de éxito alrededor del 80%.
Mortalidad hospitalaria mucho menor (6 %).
Rapidez de su aplicación.
En el caso frecuente de resultados subóptimos, permite operar al paciente en mejores condiciones clínicas y con menor riesgo.
Desventajas del tratamiento trombolítico
Ineficaz en el 16-18% de los casos.
• Complicaciones graves: embolismos (20 %) y hemorragias mayores (5 %).
• Recidiva del cuadro trombótico en el 3-20 % de los casos.
Algoritmo: conducta ante trombosis protésica
Endocarditis protésica
Es cualquier infección que afecta a una prótesis valvular o a una válvula nativa reconstruida. Se calcula que alrededor de un 1-4% de las prótesis han de sufrir infección a lo largo de la vida del paciente, y que la endocarditis protésica constituye el 15-20% del total de endocarditis de un hospital terciario. La incidencia es del 3% en los 12 primeros meses y del 4-6% a partir de los 2 años. El riesgo es mayor durante los primeros 6 meses después de la cirugía (ante todo en las primeras cinco o seis semanas).
La microbiología de las endocarditis de las prótesis valvulares es relativamente predecible y refleja en parte la adquisición nosocomial o comunitaria de la infección. La que se diagnostica en los 60 días que siguen a la operación suele ser ocasionada por estafilococos coagulasa-negativos, ante todo Stahilococus epidermidis. Otras causas comunes durante este período son S. aureus, bacilos gramnegativos y hongos. El espectro de los microorganismos que causan endocarditis protésica entre 2 y 12 meses después de la cirugía y dentro de los 60 días del postoperatorio es similar. La endocarditis que se inicia un año después de la operación se atribuye a una bacteriemia transitoria consecutiva a manipulaciones dentales, gastrointestinales y genitourinarias. Por tanto, la microbiología que se observa en estos casos es similar a la que se presenta sobre válvulas nativas: estreptococo, S. aureus, enterococo y cocobacilos gramnegativos (el llamado grupo HACEK).
El cuadro clínico es similar al de la endocarditis sobre válvulas nativas, al igual que el diagnóstico, que está basado en los hemocultivos y el ecocardiograma. (Ver guías de endocarditis infecciosa)
Tratamiento
En primer lugar hay que erradicar el agente causal, de lo contrario nos encontraremos con recidivas de la infección. Tratar las complicaciones invasoras y destructivas de la infección sean intracardiacas o extracardiacas focales.
El antimicrobiano se elegirá de acuerdo a los resultados de los hemocultivos, y la sensibilidad del microorganismo
Endocarditis estafilocócica
• Vancomicina: 30mg/kg cada 24 horas por vía IV divididos en dos dosis iguales sin exceder 2g en 24h. Duración ≥ 6 semanas.
• Rifampicina: 300mg VO cada 8 horas. Duración ≥6 semanas.
• Gentamicina: 1.0mg/kg IM o IV cada 8 horas. Duración 2 semanas.
Endocarditis por microorganismos HACEK (Haemophilus parainfluenzae, haemophilus aphrophilus, actinobacillus A, cardiobacterium hominis, eikenella corrodens y kingella kingii).
• Ceftriaxona: 2g diarios IV. Duración 4 semanas.
• Gentamicina 1mg/kg IM o IV cada 8 horas. Duración 4 semanas.
Endocarditis por enterococo
• Vancomicina: 30mg/kg vía IV cada 24 horas, dividido en dos dosis iguales, sin exceder 2 g en 24 horas. Duración 4-6 semanas.
• Gentamicina 1mg/kg IM o IV cada 8 horas. Duración 4-6 semanas.
Criterios de cirugía cardíaca:
• Insuficiencia cardíaca congestiva moderada a grave por disfunción valvular.
• Prótesis inestable.
• Recidiva después del tratamiento óptimo.
• Extensión peri valvular de la infección.
• Endocarditis por S. aureus (indicación relativa para prótesis aórtica y mitral).
• Vegetaciones grandes (> 10mm) (relativa).
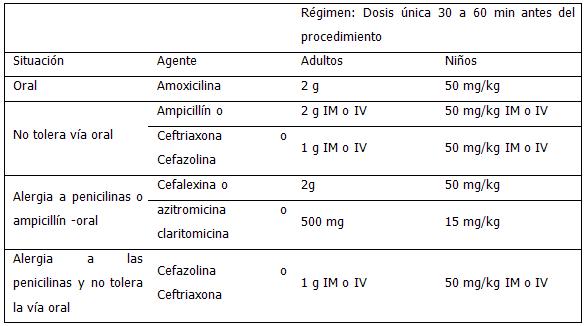
Teniendo en cuenta la mortalidad elevada de los pacientes con endocarditis sobre válvula protésica lo más importante es la profilaxis en aquellas situaciones que tengan riesgo de bacteriemia, los esquemas recomendados son los siguientes:
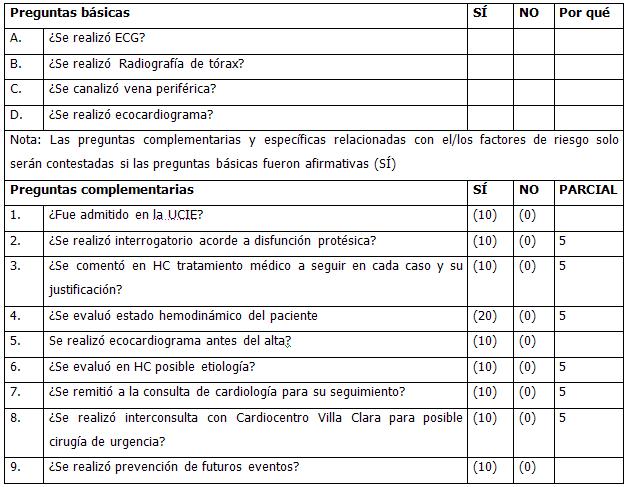
GUÍA DE EVALUACIÓN