La angina inestable (AI) conocida también como síndrome coronario intermedio, angina preinfarto, insuficiencia coronaria aguda, angor in crescendo, se define como dolor opresivo o malestar generalmente torácico atribuible a isquemia miocárdica transitoria. Bajo el epígrafe de AI se engloban diversas manifestaciones clínicas entre la angina estable y el infarto agudo de miocardio (IMA), con distinto peso de la participación de los mecanismos fisiopatológicos implicados (trombosis coronaria-vasoespasmo), y que puede ser expresión de una extensión y gravedad muy variable de la enfermedad coronaria subyacente. Estas diferencias afectan, además del pronóstico, a los procedimientos diagnósticos, de estratificación del riesgo y terapéuticos.
Actualmente la AI pertenece al síndrome isquémico coronario agudo sin elevación de segmento ST del electrocardiograma (SCASEST), junto al infarto agudo del miocardio sin elevación del ST.
DIAGNÓSTICO
El diagnóstico de AI se basa en el reconocimiento de la sintomatología sugerente de isquemia miocárdica, en ausencia de ondas Q patológicas en el ecocardiograma, y sin que se produzca elevación enzimática dos veces por encima del límite superior de la normalidad. Se ha demostrado la existencia de un ritmo circadiano, con mayor incidencia de las crisis en el segmento horario entre las 6 a.m. y las 12 p.m. Las potenciales complicaciones de la AI hacen imprescindible un diagnóstico rápido y correcto seguido de un manejo adecuado.
Diagnóstico clínico: Se caracteriza por iniciar con episodio de angina en reposo, nocturna o no y recurrente a pesar del empleo de vasodilatadores sublinguales, con una duración menor o igual a 30 minutos. Las características del dolor son las siguientes:
• Localización: con mayor frecuencia precordial o subesternal y la intensidad máxima en el centro del tórax. Sin embargo, puede sentirse en cualquier sitio entre el diafragma y el maxilar inferior. El sitio de irradiación más común es hacia los brazos, en especial la cara interna del brazo izquierdo. Otros sitios de dolor referido son: cuello o fauces, área interescapular y maxilar inferior.
• Calidad: Sensación de opresión o peso contra el esternón. Aparece y desaparece en forma gradual. Puede sentirse disnea con el dolor o disnea sola como equivalente anginoso. Los pacientes se aprietan el pecho con la mano o el puño cerrado para describir al médico la calidad del dolor (signo de Levine).
• Factores precipitantes: tensión física o emocional. Otros factores que aumentan el consumo de oxígeno como la ingestión de alimentos y el frío; el angor nocturno se asocia a la fase de movimientos oculares rápidos, angor de decúbito (al acostarse).
• Duración y frecuencia del dolor: hay remisión total del dolor entre los episodios; aunque son variables, por lo común remiten en 2 - 3 minutos, como máximo hasta 30 minutos. Puede variar entre 1 episodio por día, hasta varios.
• Alivio del dolor: con el reposo, nitritos sublinguales en 5 – 10 minutos.
• Factores de riesgo: tratar de identificar la presencia de uno o más de ellos, su papel es controvertido, especialmente en las mujeres tienen un escaso valor predictivo.
Principales factores asociados al síndrome coronario agudo.

Examen físico: Es útil no sólo para excluir otras causas de dolor torácico sino también para proporcionar datos que avalen el diagnóstico de angor. La tensión arterial y la frecuencia cardiaca generalmente aumentan durante el dolor. Hipotensión secundaria a reflejo vasovagal, o como expresión de una disfunción ventricular izquierda. Galope por cuarto ruido, desdoblamiento paradójico del segundo ruido. Soplo sistólico por disfunción de músculo papilar, galope por tercer ruido y pulso alternante.
Clasificación de la angina inestable según Braunwald.
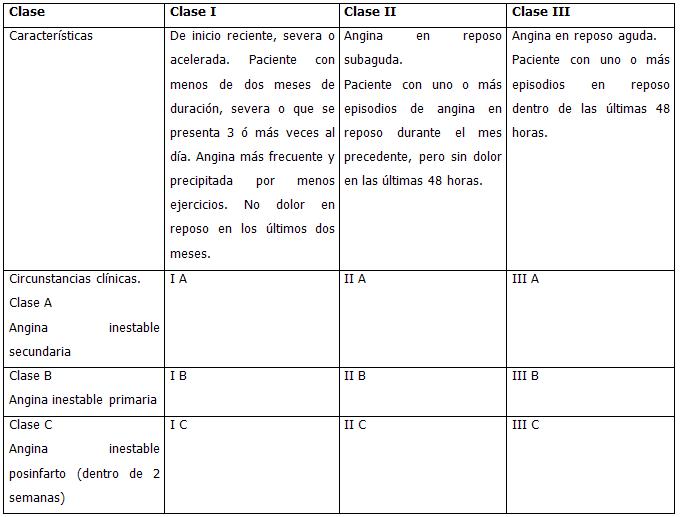
Esta clasificación se basa en la gravedad de los síntomas, las circunstancias clínicas en las que ocurre, la intensidad de la terapia antianginosa y la presencia de alteraciones transitorias del segmento ST y onda T. La aplicación de esta clasificación ha ofrecido datos de interés sobre el perfil de los pacientes con AI. Diversos estudios prospectivos han validado esta clasificación desde el punto de vista pronóstico.
Exámenes complementarios.
• Electrocardiograma: el basal puede ser normal, de gran valor durante la crisis. Las alteraciones más frecuentes son: depresión transitoria del ST, elevación transitoria del ST, inversión de la onda T durante el dolor, pseudonormalización de la onda T con el dolor (si la onda T negativa se hace positiva en un IMA previo indica que hay miocardio viable en la zona del IMA), trastornos de la conducción aurículo-ventricular y arritmias ventriculares, bloqueo de rama izquierda del has de Hiz (RIHH), signos de sobrecarga y/o hipertrofia ventricular izquierda.
• Test de esfuerzo: aporta datos diagnósticos, valor pronóstico, capacidad funcional, valora efectividad del tratamiento y aporta datos del funcionamiento cardiovascular. Puede ser: prueba de esfuerzo convencional en bicicleta o estera rodante submáxima, o limitada por síntomas, o prueba de esfuerzo asociada a gammagrafía cardiaca de perfusión.
Signos de isquemia severa en la prueba de esfuerzo: angina o descenso del segmento ST de más de 2 mm en más de 4 derivaciones o persistente (más de 5 minutos en el reposo o postesfuerzo), descenso de la presión arterial sistólica de más de 10 mmHg durante el esfuerzo.
• Monitorización ambulatoria del ECG Holter: en la AI la magnitud de la isquemia detectada en el estudio, es un predictor independiente de eventos cardiacos mayores.
• Exámenes de laboratorio: Mioglobina es el marcador más precoz. Se puede detectar a partir de 1- 2 horas de iniciado los síntomas. Creatinín fosfoquinasa y de ella la isoenzima MB (CK MB) puede ser normal o movida menos del doble de su valor normal. Se puede medir su elevación a partir de 3- 4 horas y permanece 24- 36 horas elevada. La transaminasa glutámico oxalacética (TGO) de poco valor. Proteína C Reactiva (PCR): es un indicador de evolución. Troponinas cardiacas T e I son detectables entre 3- 12 horas, se normalizan entre 5- 14 días. La CK MB y la troponina tienen valor para la estratificación del riesgo. Cuando son negativas se asocian a una tasa de mortalidad del 1 % en comparación con el 3,7 % existente con una troponina positiva y la PCR elevada tiene una mortalidad superior a los 14 días. Glucemia, estudio de lípidos, creatinina, ácido úrico, coagulograma completo.
• Radiografía de tórax: se indica para valorar congestión pulmonar y otras alteraciones pleuropulmonares; evalúa forma y tamaño del corazón.
• Ecocardiograma transtorácico: es un procedimiento no invasivo de bajo costo, fácil de realizar y de repetir, que puede ofrecer datos valiosos en 5 – 15 minutos. Permite rápidamente estratificar zona de miocardio en riesgo y el tipo de disfunción ventricular (sistólica o diastólica). Determinar la fracción de eyección del ventrículo izquierdo. Descartar presencia de valvulopatías y/o miocardiopatías. Valorar el movimiento y el engrosamiento sistólico de la pared ventricular, primero se producen alteraciones en el engrosamiento de la pared (subendocárdico) y las alteraciones en su movimiento aparecen posteriormente, solo cuando se afecta el flujo subepicárdico (isquemia severa)
Para que la ecocardiografía pueda detectar alteraciones de la contractilidad, tiene que existir una reducción del flujo coronario > 50 %, la isquemia debe afectar a más del 20 % del grosor de la pared y afectar a más del 5 % de la masa miocárdica total ventricular.
• Ecocardiograma transesofágico: sólo indicado para descartar la presencia de trombo intracavitario en la fase aguda.
• Ecocardiografía con estrés: puede ser con esfuerzo o farmacológico (dobutamina, dipiridamol, adenosina, hiperventilación y ergonovina) para estudiar viabilidad miocárdica y la reserva contráctil de los segmentos discinérgicos.
• Ecocardiografía con contraste: permite valorar la perfusión y la integridad de la circulación microvascular, utilizando contraste con 2do armónico, inyectando 2 bolos a una concentración de 400 mg/ml, administrándose 5 ml (2,5 gr.) de Levograf/Levivist en situación basal y en el pico máximo de esfuerzo. Está indicado en: deficiente ventana acústica, mala determinación de los segmentos mediobasales de las caras lateral y anterior, durante el período de formación de los residentes o cuando existe desacuerdo con expertos.
• Exploración de perfusión miocárdica: gammagrafía de perfusión miocárdica con talio 201 y tecnesio (Tc) 99 m. El talio trazador análogo al potasio, se incorpora a las células por medio de la bomba Na 2+ / K 2+ adenosín trifosfatasa (ATPasa). El Tc MIBI (metoxisobutil isonitrilo) es un trazador que difunde pasivamente a través de la membrana celular. La gammagrafía con talio 201 practicada durante el esfuerzo a menudo muestra la ausencia de captación en una zona del miocardio, y su normalización cuando se repite unas horas más tarde. En el reposo, este patrón gammmagráfico es característico de la isquemia. Cuando el defecto persiste en el reposo una vez que la isquemia presumiblemente ha desaparecido, se admite que la zona correspondiente está necrosada.
• Coronariografía no invasiva por tomografía multicorte y evaluación de calcio (score de calcio): para detectar lesiones coronarias.
• Estudios invasivos: coronariografía o arteriografía coronaria, es la visualización radiográfica, mediante contraste yodado, de la luz de las arterias coronarias epicárdicas. Es de gran utilidad, las indicaciones de la coronariografía deben ser aquellas encaminadas a establecer la presencia o ausencia de enfermedad coronaria. En la AI esta indicada en la fase aguda si angor refractario y/o inestabilidad hemodinámica. Es electivo si aparece en el ECG isquemia aguda persistente, recurrencia del dolor anginoso, o signos de isquemia severa en la prueba de esfuerzo.
Indicaciones de cateterismo cardiaco
Se consideran indicaciones Clase I en la AI: progresión en la severidad o frecuencia de los episodios de angina en los 2 meses previos a pesar del tratamiento médico, incluida la angina en reposo. Angina de reciente comienzo (en los 2 meses previos) que es severa a pesar del tratamiento médico. Angina con dolor en reposo de más de 15 minutos de duración, asociada a cambios en el ST-T en las pasadas dos semanas. Angina de Prinzmetal o variante.
Se dice que la coronariografía es el patrón oro en el estudio de la enfermedad coronaria y en el análisis cuantitativo de la función ventricular. Ambos parámetros son claves para estratificar el pronóstico de los pacientes con cardiopatía isquémica.
La importancia de la clasificación de los pacientes con AI e IMA sin elevación del ST, en grupos de alto riesgo y bajo riesgo, radica en que sólo se ha informado de beneficios claros de la angiografía precoz, y en caso necesario, intervencionismo coronario percutáneo (ICP) en los grupos de alto riesgo.
TRATAMIENTO (ESTRATEGIAS PRINCIPALES)
Disminución del consumo de oxígeno:
• Nitratos: reducen la demanda de oxígeno y la tensión de la pared al disminuir la precarga y poscarga del ventrículo izquierdo. Mejoran la perfusión del área de miocardio en riesgo o la zona periinfarto al atenuar el vasoespasmo coronario; pueden dilatar la circulación colateral (si existe) y disminuir la presión diastólica final del ventrículo izquierdo.
Presentación: tabletas (de 0,4 - 0,5 - 0,6 - 0,8 mg) para uso sublingual, grageas, parches transdérmicos, nebulizadores, sprays, ampolletas (de 5 – 25 – 50 mg). Dosis de 0,5 – 2 mcg/Kg/minuto.
La infusión debe mantenerse hasta que el paciente esté 12 – 24 horas sin dolor precordial. Después mantenimiento por vía oral con preparados de acción lenta como: Dinitrato o 5 mononitrato de isosorbide que se presenta en tabletas orales, sublinguales, masticables. Dosis 30 – 240 mg/día repartido 3-4 tomas; tetranitrato de pentaeritritol (nitropental) tabletas de 10 – 20 mg. Dosis 30 – 240 mg/día repartido 3-4 tomas (poco usado actualmente).
Para evitar la tolerancia que se produce con el consumo de nitratos, posiblemente relacionada con la depleción de grupos sulfidrilos de la pared arterial, se deben tener las siguientes precauciones: utilizar la menor cantidad de nitratos posible que proporcione beneficio sistémico sostenido, evitar el empleo de fórmulas de acción prolongadas por su efecto de adicción y tolerancia, más reportado que en preparados de acción corta, no administrar a intervalos regulares el medicamento. Establecer un régimen de dosificación que asegure un período sin nitratos de por lo menos de 10 – 12 horas, iniciar el tratamiento con dosis pequeñas.
• Beta bloqueadores: disminuyen las necesidades miocárdicas de oxígeno por: disminución de la frecuencia cardiaca, tensión arterial, contractilidad y velocidad de contracción ventricular (dp/dt), por todo esto reduce el consumo de oxígeno miocárdico. Aumenta el flujo coronario a nivel subendocárdico. Funcionan como antiarrítmico, atenúan la génesis de arritmias ventriculares graves, pueden ayudar a prevenir una muerte súbita cardiaca. Reduce la mortalidad y el riesgo de IMA en un 13 %.
En la AI están propuestos protocolos para el uso de beta bloqueadores al inicio:
Metoprolol 5 mg endovenoso con un intervalo de 5 minutos entre las dosis hasta 3 veces, seguido inmediatamente de 50 mg oral cada 6 horas.
Atenolol 5 mg endovenoso repetir una vez después de 5 minutos y continuar con 50 – 100 mg oral por día.
No hay datos que sugieran que los ß1 selectivos sean más efectivos que los agentes no selectivos. La dosis de mantenimiento se ajusta de acuerdo a la frecuencia ventricular que debe estar entre 50 – 60 latidos/minuto. Evitar el uso de ß- bloqueadores con actividad simpaticomimética intrínseca (pindolol, acebutolol, alprenolol, oxprenolol) en la AI post IMA.
Precauciones: los ancianos requieren dosis menores; en los diabéticos deben usarse preferiblemente los agentes ß1 selectivos y evitar la supresión brusca de los ß- bloqueadores ya que se produce efecto de rebote a los 4 – 6 días.
• Anticálcicos: actúan bloqueando el flujo de calcio a través de los canales lentos en las células del músculo liso vascular y miocárdico, por tanto previenen o alivian el vaso espasmo en las arterias coronarias y afectan la contractilidad miocárdica. Deprimen la función del ventrículo izquierdo. Reducen la tensión arterial. No constituyen el tratamiento de primera elección. Se ha reservado su uso en la AI en aquellos pacientes que no se han controlado después de dosis óptima de nitratos y ß- bloqueadores o en pacientes con intolerancia a estos medicamentos. Se usan en aquellos pacientes que se conoce el componente vasoespástico en la angina. Se han reportado efectos beneficiosos sobre la mortalidad y la incidencia de IMA, aunque hay autores que dicen que el único beneficio constatado ha sido el control de los síntomas. Se prefieren los preparados de acción prolongada a de los a los de acción corta, ya que no reportan iguales beneficios.
La nifedipina incrementa el riesgo de IMA y/o muerte cuando no se administra conjuntamente con ß- bloqueadores.
Tratamiento antitrombótico:
• Inhibidores de la agregación plaquetaria:
1. Ácido acetil salicílico (AAS): acción inhibitoria de la ciclo-oxigenasa, a través de la cual se bloquea la síntesis de tromboxano A2 y se impide parcialmente la agregación plaquetaria. Los beneficios de su administración han sido ampliamente demostrados, se ha establecido el papel clave del AAS en la AI, este medicamento puede considerarse el más importante en el tratamiento de la AI, al disminuir, con una dosis de 160 – 325 mg cada día, el riesgo de mortalidad e IMA en un 50 %.
2. Trifusal (Disgren): potente inhibidor de la agregación plaquetaria inducida por adenosín difosfato (ADP), adrenalina y colágeno. Acusada actividad antitrombótica. Presentación: cápsulas de 300 mg. Dosis 1-3 cápsulas/día durante o al final de las comidas. Pautas de tratamiento propuesta: prevención: 1 cápsula/día; mantenimiento 2 cápsula/día; y en situaciones de alto riesgo 3 cápsula/día.
• Derivados tienopiridínicos: su mecanismo de acción es interferir con la activación de plaquetas mediada por ADP, pero bloquean irreversiblemente los receptores de ADP de las plaquetas y no tienen efecto directo sobre la producción de tromboxano A2 (TXA2). Son más efectivos que el AAS, para inhibir agregación plaquetaria, ejercen bloqueo parcial de la unión del fibrinógeno y del factor von Willebrand con los receptores GP IIb/IIIa.
1. Tiklid - Ticlodona (ticlopidina): modifica cualitativamente el complejo GP IIb/IIIa de la membrana de las plaquetas impidiendo la fijación del fibrinógeno y la consiguiente agregación plaquetaria. Dosis: 1 –2 comprimidos al día; como máximo 3 – 4 tabletas al día.
2. Plavix (clopidogrel): tableta de 75 mg. El 50 % se excreta en la orina y las heces fecales, hasta 5 días después de la dosis, se absorbe rápido por vía oral, pico máximo en sangre 1 hora después de la ingestión. Tiene un mejor perfil de seguridad que la ticlopidina. Dosis indicada en la AI de inicio 300 mg y después de 75 mg al día junto con AAS 75 – 125 mg por día.
• Antagonistas de los receptores plaquetarios del fibrinógeno: conocidos como inhibidores de los receptores GP IIb/IIIa, su principal mecanismo de acción consiste en bloquear la vía común final de la agregación plaquetaria, evitando de esta forma la participación plaquetaria en la formación y crecimiento del trombo. Atenúa los eventos isquémicos recurrentes en pacientes con AI.
1. Abciximab: ampolletas de 10 mg. Indicado en angioplastia coronaria transluminal percutánea (ACTP) y otros procedimientos invasivos. En la AI sin respuesta al tratamiento médico en espera de tratamiento intervencionista. Dosis 0,25 mcg/kg en bolo endovenoso seguido de una infusión continua de 10 mcg/minuto para estabilización de la AI; la infusión debe iniciarse 24 horas antes de la intervención y se debe suspender 12 horas después. Combinado con AAS 300 mg al día y heparina en bolo. Inicio del efecto 30 minutos después de la inyección endovenosa, regreso del efecto en 12 horas, circula en sangre de 12 – 14 días.
2. Tirofiban derivado de la tirosina: inhibidor selectivo de la GP IIb/IIIa. Efecto mínimo sobre el receptor de vitronectina. Vida media en plasma 2 horas. El tiempo de sangramiento regresa a lo normal en 4 horas. Trombocitopenia reversible en el 1 % de los casos. Está indicado post ACTP y en la AI se ha reportado disminución significativa en la incidencia de muerte, IMA o isquemia refractaria.
3. Lamifiban inhibidor selectivo del receptor de la GP IIb/IIIa. A dosis altas demostró una disminución de porcentajes de eventos cardiovasculares como muerte, IMA, AI refractaria, o necesidad de revascularización urgente durante el período de infusión. Indicaciones post ACTP y en la AI.
4. Antagonistas orales de la GP IIb/IIIa: xemilofiban, orofiban, sibrafiban, lamifiban.
Tratamiento antitrombínico:
• Heparina convencional: mucopolisacárido cuya actividad anticoagulante se debe a la interacción con el inhibidor endógeno de la trombina, la antitrombina III. El complejo heparina- antitrombina III puede inhibir también la actividad de los factores de la coagulación Xa, XIIa, XIa, IXa, aunque es más susceptible para la inhibición el factor Xa es 10 veces menos susceptible que la trombina. Requiere vigilar el tiempo de tromboplastina parcial activado (TTPa) a las 6 - 12 – 24 horas y posteriormente cada 24 horas y debe revisarse cada 4 - 6 horas cada vez que se modifique la dosis. El TTPa debe mantenerse entre 1,5 - 2 veces el control. El tratamiento con heparina en la AI es superior al placebo y, muy probablemente, al AAS. La pauta más recomendada es un bolo inicial de 5 000 (18 UI/kg) endovenoso seguido de una infusión continua a dosis de 1 000 UI/ hora (18 UI/kg./hora). En los centros que no están equipados para la administración en infusión de la heparina se recomienda 5 000 UI en bolo endovenoso cada 4 horas. Se recomienda mantener el tratamiento con heparina por 2 – 5 días o hasta que se haga proceder intervencionista de revascularización coronaria; se recomienda una retirada gradual a lo largo de 12- 24 horas para atenuar el efecto de rebote.
• Heparina de bajo peso molecular (HBPM): se obtiene a través de depolimerización de la heparina estándar no fraccionada. Su mecanismo de acción fundamental es la inhibición del factor Xa/antifactor IIa. La vida media es de 4 horas. El uso combinado con AAS en la AI ha reducido la mortalidad. Presentación: 1 ml = 25 000 UI 0,3 ml = 7 500 UI; 0,7 ml = 17 500 UI 0,2 ml = 5 000 UI; Dosis recomendadas 1 mg/kg/12 horas. Para la dalteparina se estudió un esquema de 120 UI/kg/12 horas durante 6 días y después 7 500 UI/día hasta cumplir 40 – 50 dias.
• Anticoagulantes cumarínicos: reducen la concentración de protrombina, inhiben la formación de trombina a través del mecanismo de antagonismo competitivo de la síntesis de factores de la coagulación dependientes de la vitamina K. Warfarina: tabletas de 2- 5 y 10 mg a dosis necesaria para obtener un INR (siglas en inglés de coeficiente internacional normalizado) 2 – 2,5 durante 10 semanas conjuntamente con aspirina 150 mg por día. Inhibidores directos de la trombina: el prototipo es la hirudina y su análogo sintético el hirulog. No requieren un cofactor para inhibir a la trombina a la que se unen selectivamente con una relación 1:1. Tiene una respuesta anticoagulante estable y predecible. Pauta de dosificación de hirudina bolo 0,2 mg/kg seguido de infusión continua a razón de 0,1 mg/kg/hora (dosis baja) y bolo 0,4 mg/kg e infusión de 0,15 mg/kg/hora (dosis media).
Hipolipemiantes:
• Inhibidores de la reductasa hidroximetilglutaril coenzima A (HMG-COA): Nuevos componentes sintéticos derivados de hongos cuya principal característica consiste en inhibir la vía clásica unidireccional enzimática en la biosíntesis del colesterol.
• Lovastatina 10-80 mg/día.
• Atorvastatina 10-80 mg/día.
• Simvastatina 20-40 mg/día.
• Fluvastatina 20-80 mg/día.
Fibrinolisis:
Existen numerosos estudios aleatorizados intentando definir el papel del tratamiento fibrinolítico en la AI. En la actualidad no está recomendado su uso, se reportan efectos adversos, ya que pueden disparar fenómenos de retrombosis como resultado de la producción de sustancias trombogénicas, con la consiguiente formación de trombos con diferente composición (más rico en agregados plaquetarios y escaso en fibrina), y la generación de un estado procoagulante transitorio que permitiría el crecimiento del trombo, la obstrucción y el espasmo en el seno de lesiones no completamente oclusivas.
Los agentes trombolíticos no son útiles en el tratamiento de los síndrome coronarios agudos sin elevación del segmento ST. Su utilización en la AI empeora el pronóstico.
Procedimientos de revascularización:
1- ACTP: La realizada durante la fase aguda de la AI es inicialmente exitosa en torno a un 90%, pero tiene un riesgo más alto, que el de la AI, de IMA, cirugía urgente y muerte hospitalaria, ligado fundamentalmente a la oclusión trombótica aguda.
2- Cirugía de revascularización coronaria: no ha demostrado mejorar el pronóstico comparativamente con el tratamiento médico. Actualmente, la mejoría de las técnicas quirúrgicas y de preservación y control de las condiciones de reperfusión, ha disminuido la morbimortalidad quirúrgica. Estas y la cirugía mínimamente invasiva son las aportaciones más esperanzadoras a evaluar en el terreno quirúrgico. En los múltiples estudios de comparación entre ACTP y cirugía, en la enfermedad multivasos, la prevalencia media de la AI estaba en torno al 50%. En los estudios individuales y en metaanálisis no se detectan diferencias globales en la mortalidad o incidencia de IMA entre ambas técnicas.
TRATAMIENTO (EN LA UNIDAD DE CUIDADOS INTENSIVOS EMERGENTES)
1. Reposo en decúbito supino
2. Canalizar vena segura.
3. Alivio del dolor con nitroglicerina sublingual hasta 3 tabletas.
4. Realizar ECG de 12 derivaciones.
5. Oxígeno por catéter o máscara nasal a 4 litros/minuto.
6. Estratificación del riesgo y selección de los pacientes:
Estratificación de riesgo
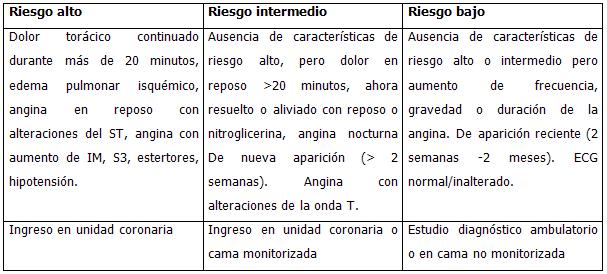
7. Traslado acompañado por personal calificado hasta el lugar de ingreso.
8. Evaluar factores desencadenantes y de ser posible corregirlos (anemia, taquicardia, hipertensión arterial (HTA), sepsis, fiebre).
En la Unidad de Cuidados Intensivos Coronarios
• Reposo en Fowler.
• Oxígeno por catéter o máscara nasal a 4 litros/minuto.
• Dieta blanda y líquida, sin sal, por 24 horas o hasta alivio del dolor.
• Reportar como grave.
• Actividad física:
1er día: Reposo absoluto por 24 horas o hasta alivio del dolor después.
2do día: sentarlo en la cama.
3er día: sentarlo en el sillón e ir al baño. Traslado a cama no monitorizada (rehabilitación).
4to día: caminar libremente en la habitación, ir al comedor. Realizar segunda estratificación del riesgo, valorar la realización de prueba ergométrica evaluativa antes del alta.
5to día: alta.
• Monitorización eléctrica por 48 horas o hasta alivio del dolor.
• Signos vitales cada 3 horas por 48 horas, después cada 8 horas.
• Hidratación por 24 horas o hasta 12-24 horas después de aliviado el dolor con: Dextrosa 5% o cloruro de sodio al 0,9% 1 000 ml a 14 gotas por minuto con polisal 1 ámpula y sulfato de magnesio 2 ámpulas; beta- bloqueadores: 25- 50 mg/día de Atenolol por vía oral; AAS: 125- 350 mg/día vía oral; heparina sódica 5 000 Uds. en bolo subcutáneo/endovenoso según criterio del médico, cada 4 horas durante 2-5 días, o hasta que se haga proceder de revascularización. Ajustar la dosis de acuerdo al tiempo de tromboplastina parcial activado (TTPa); heparina de bajo peso molecular 12 500 Uds. subcutáneo cada 12 horas. No se requiere monitorizar el TTPa; nitratos: Si no se consigue alivio del dolor con preparado de nitroglicerina sublingual, en parches o spray, debe usarse infusión a 0,5- 2 mcg/kg/minuto hasta que el paciente esté 24 horas sin dolor y después continuar con preparados de acción lenta como: dinitrato o 5 mononitrato de isosorbide a dosis de mantenimiento entre 30-240 mg/día o tetranitrato de pentaeritritol (nitropental) a igual dosis; anticálcicos: se ha reservado su uso en aquellos pacientes que no se han controlado después de dosis óptima de beta bloqueadores y nitratos o en pacientes que no toleran estos medicamentos. Se usan cuando se conoce el componente vasoespástico: nifedipina 20-40 mg 3 veces/día; verapamilo 80-120 mg 3 veces/día; diltiazem 60-90 mg 2-3 veces/día; amlodipino 5-10 mg al día.
Medicamentos no disponibles en nuestro medio:
• Antagonistas de los receptores plaquetarios del fibrinógeno conocidos como inhíbidores de las glicoproteínas (gpIIb/IIIa): reopro (abciximac), lamifiban, orofiban, xemilofiban, sibrafiban.
• Antagonistas del receptor de adenosín difosfato (inhibidores de la agregación plaquetaria): ticlopidina (Tiklip, Ticlodone), clopidogrel (Plavix).
• Inhibidores directos de la trombina: hirudina y los derivados semisintéticos de esta (hirulog, bivalirulin).
Exámenes complementarios
• ECG en cada episodio doloroso y después de aliviado el dolor cada 24 horas.
• Enzimas: creatinfosfosinasa fracción MB (CPKMB) cada 12 horas durante 48 horas. Troponina tiene valor para estratificación del riesgo, cuando es negativo tiene una tasa de mortalidad del 1%.
• Coagulograma completo al ingreso y después monitorizar el TTPa cada 24 horas.
• Hemograma al ingreso y después si es necesario.
• Glucemia al ingreso y después si es necesario según criterio médico.
• Creatinina al ingreso y después si es necesario.
• Lipidograma al ingreso.
• Proteína C reactiva (PCR) es un indicador de evolución. Cuando está elevada tiene una mortalidad superior a los 14 días.
• Radiografía de tórax al ingreso y después si es necesario.
• ECG transtorácico en las primeras 48 horas, después si es necesario según criterio médico y antes del alta.
• Prueba ergométrica evaluativa (PEE) pre alta para estratificar el riesgo y si hay signos de isquemia severa como: angina o descenso del ST a una carga inferior a 5 unidades de esfuerzo físico, descenso del segmento ST de más de 2 mm en 4 derivaciones, o persistente más de 5 minutos en el reposo, descenso de la presión arterial sistólica de más de 10 mm de Hg durante el esfuerzo; preparar al paciente para coronariografía diagnóstica.
• Coronariografía de urgencia si: angina refractaria y/o inestabilidad hemodinámica.
• Coronariografía electiva: aparición en el ECG de isquemia aguda persistente, recurrencia del dolor anginoso, signos de isquemia severa en la PEE.
• ECG transesofágico si criterio médico para descartar complicaciones.
• ECG de estrés con esfuerzo o farmacológico (dobutamina, dipiridamol, adenosina, hiperventilación y ergonovina) para estudiar viabilidad miocárdica y la reserva contráctil de los segmentos disquinéticos.
• Gammagrafía de perfusión miocárdica con talio 201 o tecnecio 99m. Estudia viabilidad miocárdica.
• Tomografía por emisión de positrones (PET). Aunque considerada el patrón de oro para estudio de viabilidad miocárdica, no está disponible en la mayoría de los hospitales por el elevado costo.
Cuando ha pasado la etapa de mayor riesgo, se recomienda:
• Identificar los factores de riesgo coronario y recomendar modificar los posibles a corregir.
• Vincular al paciente después del alta a un programa de rehabilitación cardiovascular.
• Dar turno para consulta externa de cardiopatía isquémica al mes, 3 y 6 meses y después seguimiento por su área de salud.
GUÍA DE EVALUACIÓN