CONCEPTO
El traumatismo craneoencefálico (TCE) se define como la lesión recibida por el cráneo, sus cubiertas y el contenido encefálico producto de la acción que ejercen sobre él fuerzas externas.
FISIOPATOLOGÍA
El cerebro puede ser lesionado por mecanismos primarios como la carga estática (también llamada compresión), carga dinámica (tanto impulsiva o aceleración sin impacto directo como mediante impactos que transmiten la aceleración al cráneo), desaceleración o penetración. Entre los mecanismos secundarios se destacan el edema cerebral (con el trauma se activa el edema vasogénico, que ocurre por aumento de la permeabilidad de los capilares, con ruptura local de la barrera hematoencefálica (BHE), aumento del líquido intersticial, y el edema citotóxico, que ocurre por daño isquémico de la célula nerviosa), isquemia local, glucólisis anaerobia, edema de los astrositos, activación de cascadas enzimáticas y de las endotelinas, por formación y liberación de radicales libres de oxígeno.
CLASIFICACIÓN ANATÓMICA
1. TCE con lesión de las cubiertas epicraneales:
a) Heridas epicraneales incisas.
b) Heridas epicraneales contusas.
c) Heridas epicraneales avulsivas.
d) Pérdida de tejidos epicraneales.
e) Hematomas subgaleales.
f) Hematomas subperiósticos.
2. TCE con lesión del cráneo óseo:
Las fracturas craneales pueden clasificarse:
a) Según su localización (clasificación topográfica):
• De la bóveda craneal: Frontales, temporales, parietales, occipitales, múltiples.
• De la base craneal: Fosa craneal anterior, fosa craneal media, fosa craneal posterior.
b) Según su forma:
• Lineales.
• Deprimidas (en bloque, conminutas o en ping-pong).
• Estrelladas.
• Diastasadas.
3. TCE con lesión de contenido intracraneal:
• Conmoción cerebral.
• Contusión cerebral.
• Hematomas intracraneales: epidurales, subdurales, intraparenquimatosos, intraventriculares, hemorragia subaracnoidea.
Estas lesiones generalmente no se presentan de forma pura, sino que suelen imbricarse las diferentes categorías. Esto da una idea del grado de complejidad que pueden llegar a adquirir estas lesiones, y por tanto, lo difícil de su manejo.
CUADRO CLÍNICO
Trauma craneal leve o simple:
• No existe pérdida de conciencia.
• No existen signos de déficit o irritación neurológica.
• El paciente está orientado, obedece órdenes complejas, responde adecuadamente al interrogatorio. No amnesia.
• Escala para coma de Glasgow (ECG)- 15 puntos.
• Puede presentar cefalea discreta (no severa o progresiva) o dolor en el área golpeada.
• Puede presentar algunos vómitos de alimentos (no progresivos).
• Puede presentar vértigos o inestabilidad transitorios, sobre todo al girar la cabeza o a los cambios de posición de acostado a sentado, o de sentado a de pie.
• Puede presentar heridas epicraneales, a veces con lesión de vasos importantes, cuyo sangramiento puede llevarlos al shock (por pérdida de volumen de no controlarse a tiempo).
Fracturas craneales:
Las fracturas de la bóveda craneal no presentan un cuadro clínico propio, sino que dependen de la afectación o no de estructuras neurológicas. Son diagnosticadas con relativa facilidad mediante la ayuda de los rayos X (en cambio, las fracturas de la base del cráneo generalmente no son visibles por estos); poseen un cuadro clínico propio de cada una de sus variedades, lo que favorece la realización del diagnóstico clínicamente:
a) Fosa craneal anterior:
• Hematoma periorbitario uni o bilateral: en “gafas” o "en espejuelos" o signo del mapache (si es bilateral, afectando las dos hemifosas anteriores), o del oso Panda (si es unilateral, que afecta sólo una hemifosa anterior).
• Rinorragia o rinorraquia (uni o bilateral, en dependencia de si afecta una hemifosa anterior, o a las dos). Es importante establecer diagnóstico diferencial, al exponer el goteo en una sábana blanca o un papel, suele separarse el componente hemático del líquido cefalorraquídeo, signo del “salvavidas” o del “huevo frito”.
• Puede existir anosmia (por lesión del primer par craneal, generalmente a nivel de la lámina cribosa del etmoides, menos frecuente por afectación del bulbo o del nervio olfatorio).
• Puede existir alteración de la motilidad de la musculatura periocular (pares craneales III-IV-VI).
• Puede existir defecto visual por lesión del nervio óptico (II par craneal).
• Puede existir anisocoria periférica, o desigualdad pupilar con midriasis unilateral, “seudo-anisocoria central” por lesión de ramos del III par o lesión del esfínter constrictor del iris, o por la presencia de hematoma intraorbitario “extracraneal”, que comprima o irrite al ganglio ciliar en el polo posterior del ojo).
• En resumen, los signos y síntomas suelen estar más frecuentemente ocasionados por lesión de los pares craneales I-II-III-IV-VI.
b) Fosa craneal media:
• Sensación de "oído ocupado" o "líquido en el oído".
• Hipoacusia.
• Hemotímpano durante la otoscopia.
• Otorragia u otorraquia.
• Signo de Batlle (hematoma retroauricular, o pre-esternocleidomastoideo generalmente visible después de transcurridas las primeras 24 h).
• Vértigos intensos por lesión de los conductos semicirculares.
• Paresia o parálisis facial periférica por lesión del nervio facial en su curso a través del peñasco (más frecuente en las fracturas transversas).
• En resumen, los signos y síntomas suelen estar más frecuentemente ocasionados por lesión de los pares craneales VII-VIII.
Las fracturas de fosa posterior no tienen un cuadro clínico bien definido, y pueden ser visualizadas mediante rayos X (preferiblemente en la vista de Towne).
Conmoción cerebral
Implica daño solamente funcional, no anatómico. Se explica por disfunción transitoria de la formación reticular activadora ascendente del tallo encefálico.
• Existe pérdida transitoria de conciencia, pero con recuperación total de esta.
• No signos de déficit o irritación neurológica.
• Amnesia localizada al trauma (en relación con los sucesos del traumatismo).
• Resto de los signos y síntomas similar al trauma craneal simple.
• Cuadro clínico reversible.
Contusión cerebral:
Implica daño funcional y anatómico del encéfalo.
• Existe pérdida de conciencia, que puede ser desde transitoria hasta coma profundo irreversible o la muerte.
• Si se recupera la conciencia, pueden existir alteraciones de esta, como confusión, desorientación, incoherencia, estupor, somnolencia, bradipsiquia.
• Pueden existir signos de déficit neurológico (paresias o parálisis de miembros, parálisis facial central, anisocoria, defectos sensitivos, trastornos pupilares o de la respiración, aparición de reflejos anormales, apraxia, afasia o disfasia) o signos de irritación neurológica (convulsiones, excitación psicomotora, rigidez nucal).
• Puede existir cefalea y vómitos, que pueden ser intensos.
• Pueden existir vértigos.
• El cuadro clínico tiende a ser estable, no progresivo
• En raras ocasiones la contusión puede ser cerebelosa, y entonces aparece ataxia estática o dinámica, nistagmo, e hipotonía, muchas veces enmascarados por la toma de conciencia concomitante.
Compresión cerebral:
Conjunto de síndromes caracterizados por el establecimiento de un “cono de presión” postraumático dentro de la cavidad craneal (lesión que ejerce efecto de masa y que progresa), incluye los hematomas epidurales, subdurales, intraparenquimatosos, y los focos contusivos de relevancia. Como característica distintiva el cuadro clínico de las entidades que conforman el síndrome de compresión cerebral suele ser progresivo.
Hematomas epidurales (localizados entre la duramadre y el cráneo, generalmente por sangrado arterial y más frecuentemente por lesión de la arteria meníngea media)
• Puede o no existir pérdida inicial de la conciencia. Clásicamente se describe el "intervalo lúcido", durante el cual el paciente se mantiene consciente mientras se va acumulando el hematoma y aumenta la compresión. No siempre ocurre así.
• Toma progresiva de la conciencia hasta llegar al coma y la muerte, si no se trata.
• Defecto neurológico focal progresivo.
• Aparición de degradación céfalo-caudal por compresión progresiva. Así, los signos de aviso de su presencia, con la consiguiente emergencia en el tratamiento serían:
Lesión diencefálica: Pupilas mióticas, perezosas. Respiración normal o de Cheyne- Stokes. Toma de conciencia importante. Puede haber posturas de decorticación.
Lesión mesocefálica: Anisocoria con una pupila midriática y arrefléctica, respiración normal o de Cheyne- Stokes. Signo de Babinsky contralateral (generalmente) a la lesión, así como hemiparesia. Reflejo corneo-mandibular de Von Solder.
Lesión protuberancial: Pupilas intermedias fijas, respiración con hiperventilación central, desaparece el reflejo oculo-cefalo-giro normal (ojos de muñeca), desaparecen los reflejos vestíbulo-oculares, pueden aparecer posturas de descerebración, coma profundo.
Lesión bulbar: Pupilas midriáticas y arreflécticas bilaterales, respiración atáxica o paro respiratorio. Bradicardia intensa o arritmias, hipertensión arterial (reflejo de Cushing) que luego se convierte en hipotensión. Coma profundo sin respuesta ninguna a estímulos.
• Suelen asociarse en un porciento bastante alto a fracturas craneales lineales temporales que atraviesan el surco de la arteria meníngea media.
• Con mayor frecuencia ocurren en zona de confluencia fronto-temporo-parietal, donde se encuentra la "zona decolable de Marxant".
Hematomas subdurales (localizados entre la duramadre y el encéfalo)
Según el tiempo de aparición pueden clasificarse como: Agudos (antes de las 48 h. del trauma), subagudos (entre 48 h y 21 días) o crónicos (más de 21 días).
Los hematomas subdurales agudos son clínicamente muy similares a los hematomas epidurales. Como suelen asociarse a contusiones cerebrales, se describe clásicamente que no presentan intervalo lúcido, pero no siempre ocurre su presentación en dicha forma. Debido a esta misma asociación, su mortalidad es más alta.
Los hematomas subdurales crónicos se comportan fisiopatológica y clínicamente de diferente forma.
• Son más frecuentes en pacientes ancianos o alcohólicos, con atrofia cortical.
• Suelen debutar progresiva e insidiosamente.
• Puede existir cefalea del tipo de hipertensión intracraneal, progresiva.
• Pueden existir vómitos.
• Generalmente aparece alguna forma de toma de conciencia que se hace progresiva.
• Puede encontrarse defecto neurológico focal o trastornos de la conducta.
• Habitualmente existen trastornos para la marcha.
• Pueden existir trastornos de los esfínteres urinarios.
Hematomas intraparenquimatosos:
Se comportan clínicamente como las contusiones cerebrales o los hematomas yuxtadurales, dependiendo sus manifestaciones neurológicas de su ubicación dentro del encéfalo, de su tamaño y tasa de aumento de volumen.
Hemorragias intraventriculares:
Generalmente concomitando con contusiones cerebrales, suelen provocar coma profundo por la gran hipertensión intracraneal y la compresión de centros vitales que los acompaña.
Hemorragias subaracnoideas post-traumáticas:
Se ven con frecuencia acompañando a las fracturas de fosa posterior.
Suele existir rigidez en la nuca y signos meníngeos.
Cefalea intensa generalizada y fotofobia.
Si se acompañan de vasoespasmo, pueden producir defectos neurológicos focales o toma de conciencia.
EXÁMENES COMPLEMENTARIOS
Los complementarios más frecuentemente utilizados para decidir el diagnóstico y tratamiento de este tipo de traumatismo son los siguientes:
Radiografía de cráneo: Se deben indicar tres vistas fundamentales: anteroposterior, lateral y Towne. Las dos primeras nos permiten apreciar lesiones en la bóveda craneal (fracturas, presencia de cuerpos extraños intracraneales, desplazamientos de la pineal calcificada, diástasis de suturas). La vista de Towne nos permite visualizar la fosa craneal posterior, y parcialmente la proyección posterior de los peñascos del hueso temporal.
Angiografía carotídea: Es un estudio invasivo, que requiere de cierta demora en su ejecución, actualmente ha sido desplazada por la tomografía axial computarizada (TAC), aunque en los centros que no cuentan con este último recurso, mantiene toda su vigencia e importancia. Permite apreciar desplazamientos de los patrones vasculares normales debido a lesiones intracraneales con efecto de masa (hematomas, higromas, contusiones). También permite visualizar zonas con vasoespasmo, fístulas vasculares y lesiones vasculares posteriores al trauma.
Tomografía axial computarizada: Constituye en la actualidad el estudio ecográfico más eficaz frente a este grupo de trastornos. Permite la visualización directa de lesiones intracraneales, su volumen y forma, así como las estructuras que afecta, y la visualización indirecta de otras lesiones, como el edema cerebral.
A continuación, se expone la clasificación de las lesiones encefálicas detectadas por la TAC craneal en los pacientes con TCE descrita por Marshall, también denominada como clasificación del Traumatic Coma Data Bank (TCDB): Distingue 4 tipos de lesiones difusas y 2 tipos de lesiones focales:
Lesión difusa tipo I: no se visualiza afección cerebral en la TAC craneal.
Lesión difusa tipo II: cisternas presentes, desplazamiento de línea media < 5 mm, no presencia de lesiones hiperdensas o mixtas > 25 ml.
Lesión difusa tipo III: cisternas ausentes o comprimidas, resto igual al tipo II.
Lesión difusa tipo IV: desplazamiento de línea media > 5 mm, resto igual al tipo II.
Lesión de masa no evacuada: cualquier lesión hiperdensa o mixta > 25 mL de volumen.
Lesión de masa evacuada: cualquier lesión evacuada mediante cirugía
Esta clasificación, además del valor diagnóstico y orientación en el tratamiento que brinda, tiene un valor pronóstico, demostrado mediante estudios con el Traumatic Coma Data Bank.
Resonancia magnética nuclear: Sus resultados resultan ser útiles en el diagnóstico de lesiones encefálicas del traumatismo craneal, pero el mayor tiempo que requiere la realización del estudio, y su mayor costo determinan que sólo sea empleado en ausencia de un tomógrafo, cuya mayor operatividad resulta ser determinante como medio ecográfico de elección en la actualidad en los pacientes con TCE. Otra desventaja de su uso, es que el paciente con TCE con inconciencia, no puede aportar información acerca de la posibilidad de que existan implantes metálicos corporales que contraindiquen la ejecución de la investigación.
Neumoventriculografía: Estudio prácticamente abandonado en la actualidad, debido a su invasividad y peligrosidad y a la disponibilidad de otros estudios más confiables, inocuos, y rápidos.
Electroencefalograma: Tiene poco valor en el estudio inmediato del TCE. Se puede utilizar para el estudio de la epilepsia postraumática y la muerte encefálica.
Potenciales evocados multimodales [(potenciales evocados somatosensitivos (PESS), potenciales evocados (PEV), potenciales evocados auditivos del tronco cerebral (PEATC)]:
Poseen más valor predictivo pronóstico (usados durante el seguimiento de los pacientes con TCE grave) que ejecutivo diagnóstico. No están disponibles en nuestro medio en las unidades de cuidados progresivos donde se realiza la atención de los pacientes. Ventajas: no requieren de cooperación ni se bloquean por fármacos. Disminuyen predicciones falsamente pesimistas.
Se pueden utilizar otros medios complementarios de estudio, como son los de laboratorio, que serán comentados más adelante en el tratamiento específico de algunas enfermedades.
TRATAMIENTO HOSPITALARIO
Servicio de urgencias
Evaluar ABC más estado neurológico (más importante que las lesiones en sí).
Evaluar aspectos relacionados a la cinemática del trauma.
Evaluar efectos de medicamentos o bebidas alcohólicas.
Para la conmoción cerebral y síndrome postraumático que pueden ser manejados por la guardia de Cirugía: vigilar cada 4 horas posibles signos de alarma neurológica (alteraciones de conciencia, pupilas y motilidad de extremidades), los cuales deben ser tratados sintomáticamente (analgésicos y antigravitatorios según necesidad) durante períodos prudenciales de tiempo en la sala de observaciones, y de ser preciso o requerirse, serán evaluados por la guardia de Neurocirugía a solicitud de la guardia de Cirugía General.
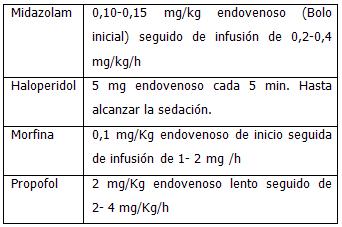
Si el paciente presenta agitación severa, debe ser sedado, de preferencia con Midazolam 0,10- 0,15 mg endovenoso en bolo inicial, seguido por infusión endovenosa de 0,2- 0,4 mg x Kg/h. Puede utilizarse también morfina 0,10 mg endovenoso de inicio, seguido por infusión de 1- 2 mg/h.
Evitar hipotensión, hipoxemia, hipercapnia y alteraciones del balance hidromineral y ácido-básico.
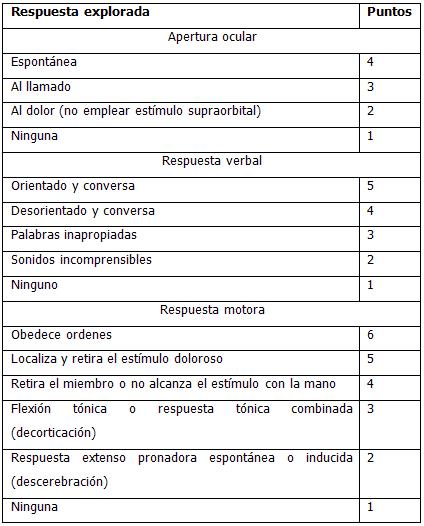
Evaluar escala de coma de Glasgow (ECG) y escala de trauma revisada.
TCE grave = ECG ≤ 8 puntos; ingreso en UCI Polivalente para neuromonitoreo.
TCE moderado = ECG entre 9-13 puntos, ingreso en UCI Quirúrgica.
TCE ligero = ECG = 14-15 puntos.
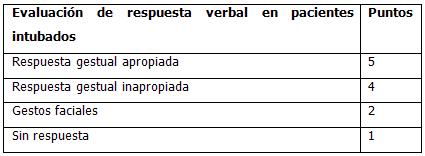
Las dificultades para la evaluación de la mejor respuesta verbal en pacientes sometidos a ventilación mecánica pueden ser obviadas parcialmente:
Aunque se pierde la respuesta de 3 puntos, permite una evaluación más objetiva, por lo que en los pacientes intubados resulta de mayor utilidad.
Criterios de gravedad en el TCE:
• Escala de Coma de Glasgow menor o igual a 8 puntos (después de reanimación cardiorrespiratoria y en ausencia de intoxicación alcohólica o por drogas)
• Deterioro de la conciencia en presencia de una de las siguientes alteraciones: anisocoria, defecto motor focal de origen neurológico, bradicardia e hipertensión arterial, cefalea severa progresiva en pacientes con fractura de cráneo, rigidez de la nuca o vómitos progresivos, convulsiones postraumáticas con recuperación demorada o status convulsivo.
• Trauma craneal penetrante con escala de Glasgow < 13 puntos.
• Pacientes con los siguientes hallazgos por TAC: cisternas de la base comprimidas o ausentes; desviación de la línea media > 5 mm; lesión de masa hiperdensa o mixta con volumen estimado > 25 ml o que desplaza la línea media > 5 mm.
Después de haber aplicado el puntaje por escala de Glasgow, se procederá de la siguiente forma:
A- Buscar la presencia de anisocoria o déficit neurológico focal en especial de progresión rápida:
a. Si existe: Se interpreta como posible masa intracraneal o contusión cerebral y el tratamiento incluye:
• Consultar neurocirujano de inmediato.
• TAC o angiografía carotídea de inmediato (en caso de deterioro rápidamente progresivo se valorará por parte del neurocirujano la exploración quirúrgica directa).
• Valorar posible intubación.
• Manitol 20 % 1 gr x Kg endovenoso a goteo rápido.
• Mantener tensión arterial media > 90 mm Hg y PO2 - 100 mm Hg.
• Tratamiento quirúrgico o ingreso en sala de cuidados progresivos (UCI-Q).
b. No existe: se sigue al siguiente paso.
B- Buscar la presencia de lesión abierta
a. Si existe: Se interpreta como posible fractura o lesión penetrante y se indica:
• Neurocirujano de urgencia
• Radiografía de cráneo anteroposterior, lateral y vista de Towne.
• TAC de urgencia.
• Mantener parámetros vitales en rangos óptimos.
• Manejo quirúrgico o ingreso en cuidados progresivos (UCI-Q).
b. No existe: se sigue al siguiente paso.
C- Buscar presencia de alteración de conciencia:
a. Si existe Se interpreta como posible contusión cerebral o masa intracraneal de poco volumen:
• Neurocirujano de urgencia.
• Radiografía de cráneo urgente.
• TAC electiva.
• Manitol 20 % 0,25 gr x Kg endovenoso.
• Ingreso en cuidados progresivos (UCI-Q)
b. No existe: se sigue al siguiente paso.
D- Buscar antecedente de pérdida transitoria de conciencia:
a. Si existe: Se interpreta como posible conmoción cerebral:
• Radiografía de cráneo
• TAC electiva
• Tratamiento sintomático (reposo, analgésicos, antinflamatorios, antivertiginosos).
• Ingreso en sala de observación por 8 horas (valoración por cirujano cada 2 h y al término de la observación. Si aparece cualquier signo relacionado en los acápites anteriores, llamar al neurocirujano. Si se mantiene muy sintomático, ingreso en sala de Neurocirugía, si mejoran los síntomas, egreso con tratamiento sintomático).
b. No existe: Se interpreta como trauma craneal leve o simple:
• Suturar heridas si existen.
• Tratamiento sintomático ambulatorio (reposo, analgésicos, anti-inflamatorios, antivertiginosos, antibióticos si heridas contaminadas).
Conducta general
TCE grave (ECG ≤ 8)
Descartar de urgencia lesión que ocupe espacio u otra condición para tratamiento neuroquirúrgico.
Iniciar cuidados y vigilancia intensivos.
Mantener signos vitales y de ventilación en rango normal.
Interconsulta con neurocirugía.
Evaluar realizar trépanos exploratorios para localizar la lesión e inmediatamente evacuarla. Si es posible, se puede incluso proceder a escariar antes de llegar al salón, para ir evacuando a través de él la parte líquida del hematoma.
Si no existen signos de focalización neurológica progresiva rápida, puede realizarse una TAC (o en su defecto una angiografía carotídea de urgencia), con el propósito de localizar la posible lesión con más precisión. En caso de existir lesión evacuable neuroquirúrgicamente, será llevado el paciente al quirófano para dicho procedimiento, y aquí se procederá además a instalar el catéter intracraneal para la medición de presión intracraneal (PIC), trasladándose luego a la UCI-P. Si no existe lesión evacuable y el paciente cumple los requisitos para medición de PIC, se procederá a insertar el catéter para ello y el paciente será ingresado en UCI-P.
Monitoreo de parámetros sistémicos y neurológicos:
El monitoreo de los parámetros sistémicos en el TCE grave no difiere del monitoreo de todo paciente grave en UCI-P. Por lo general se deben monitorizar los cuatro parámetros fundamentales por su significación específica en la prevención de las lesiones cerebrales secundarias:
a) Presión arterial, mediante método invasivo con catéter intra arterial (línea arterial).
b) Oxigenación sanguínea, mediante oximetría de pulso.
c) Ventilación, mediante el uso de capnografía y/o capnometría.
d) Temperatura.
Los métodos de monitorización neurológica abarcan tres aspectos fundamentales:
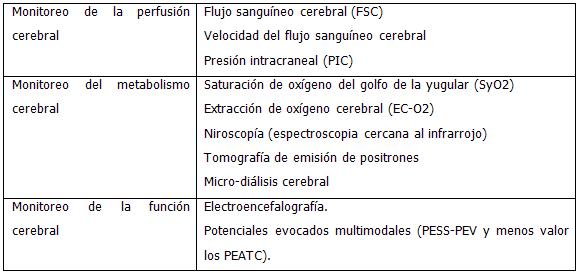
Monitoreo de la PIC
La PIC es uno de los parámetros más importantes en el pronóstico de un TCE grave. Su valor normal es de 0 a 10 mmHg. Los pacientes con PIC mayor de 20 mmHg tienen significativamente peor pronóstico que aquellas que no alcanzan esas cifras. Cuando los valores son superiores a 40 mmHg durante más de 15 minutos, son considerados como hipertensión intracraneal severa.
La monitorización de este parámetro es esencial para el manejo científicamente fundado del TCE. Su registro continuo nos permite conocer los valores de la PIC en cualquier momento, así como sus oscilaciones, sean fisiológicas (ondas respiratorias y cardiovasculares) o patológicas (ondas A, B o C de Lundberg), permitiendo guiar adecuadamente la terapéutica a aplicar, con lo cual no es necesario suministrar indiscriminadamente algunos tratamientos que pueden ser más perjudiciales que beneficiosos en determinadas condiciones, como son la hiperventilación o el Manitol (este último puede llegar a causar daño en la barrera hematoencefálica y a nivel renal si la osmolaridad plasmática rebasa los 320 mosm). Además, el monitoreo de la PIC permite conocer precozmente las alteraciones en el funcionamiento normal cerebral y el desarrollo de masas intracraneales, pudiéndose aplicar a tiempo los tratamientos requeridos para la solución de estos problemas. También brinda posibilita emitir pronósticos tempranos con respecto a la evolución de los pacientes.
Los criterios para el monitoreo de la PIC son los siguientes:
a) Pacientes con Escala de Glasgow para Coma ≤ 8 puntos y TAC de cráneo anormal (hematoma, contusión, edema, o ventrículos comprimidos).
b) Pacientes con Escala de Glasgow para Coma ≤ 8 puntos con TAC de cráneo normal y dos o más de los siguientes requisitos al ingreso: edad mayor de 40 años, posturas motoras uni o bilaterales, presión arterial sistólica menor de 90 mm de Hg.
Siempre que resulte técnicamente posible se utilizará el catéter intraventricular conectado a un transductor de presiones externas, lo que permite la reducción de la PIC mediante el drenaje del líquido cefalorraquídeo como método terapéutico y la recalibración periódica. Este método es actualmente el más barato y confiable. Los métodos intraparenquimatoso, subaracnoideo, subdural y epidural, se consideran menos confiables, pero serán usados si no puede emplearse el método de elección. Existen otros métodos para medir la PIC, como son los monitores de fibra óptica y los catéteres con micro-transductores incorporados, pero estos equipos son muy costosos y no están disponibles actualmente en nuestro medio.
La retirada del dispositivo de monitoreo de PIC se efectuará después del cese de todas las medidas empleadas para su normalización (Manitol, hiperventilación, sedación, etc.) y transcurridas 48 horas con PIC normal.
Se realizará diariamente análisis citoquímico y bacteriológico del líquido cefalorraquídeo en todo paciente con monitoreo de PIC intraventricular.
A continuación se comentan elementos de la morfología de una onda de PIC normal (medida con PIC < 20 mmHg)
Amplitud de la presión de pulso: Normal (4 mm Hg)
El simple análisis de la morfología de la onda de PIC registrada en el monitor apoya la orientación sobre el balance de las presiones dentro del cráneo.
La presión de pulso de la onda de PIC normal tiene un valor menor de 4 mm Hg. El aumento de este valor se puede encontrar durante aumentos de la PIC. Con cifras de PIC altas también varía la morfología de la onda, viéndose un aplanamiento de la onda de percusión, la cual es sobrepasada en valor por la onda tidal. Las ondas venosas desaparecen o se aplanan. El mantenimiento de la morfología de la onda a pesar de valores de PIC elevados puede verse en los patrones circulatorios cerebrales hiperémicos.
La escotadura dicrota normalmente debe coincidir con la onda T del ECG; su desplazamiento puede alertar sobre la posibilidad de desplazamiento de la línea media en el encéfalo.
Además, conociendo los diferentes valores mensurables en las ondas de PIC, podemos realizar diferentes cálculos como son el Índice Presión – Respiración, el Índice de Presiones de Pulso del líquido cefalorraquídeo y arterial, el Índice de Presión – Volumen, el Test de Miller, entre otros, que permiten inferir el estado de la autorregulación cerebral y de funcionamiento normal cerebral.
Presión de perfusión cerebral (PPC)
Una vez conocida la PIC del paciente, es muy fácil calcular la PPC si se conoce que esta es igual a la presión arterial (PA) media menos la PIC.
PPC = PA media - PIC
En el TCE la autorregulación vascular cerebral no se pierde, sino que los parámetros fisiológicos en los cuales puede funcionar están alterados. En un individuo normal, el flujo sanguíneo cerebral se mantiene constante en un rango de PA media entre 60 y 150 mmHg aproximadamente. En el TCE estos valores se desplazan hacia rangos superiores, funcionando el mecanismo autorregulatorio en valores de TA media superiores a 90 mmHg. Para que haya una respuesta vascular cerebral a los cambios de la TA sistémica, es necesario que la PPC esté en valores superiores a 70- 80 mmHg. Por tanto, es imprescindible que la PPC se mantenga por encima de este rango para conservar el control sobre la circulación cerebral.
Monitoreo del metabolismo cerebral
En el individuo normal el metabolismo cerebral está acoplado al flujo sanguíneo cerebral (FSC). Este acople puede o no mantenerse en los pacientes con un TCE grave, por lo que es de capital importancia el monitoreo de algunos parámetros que nos indiquen su integridad o no, de lo cual dependerá en mucho la respuesta que tenga el paciente ante determinadas medidas que se tomen en su cuidado.
Entre los parámetros que pueden calcularse está la saturación de 02 del golfo de la yugular (SyO2), la cual representa un monitor potencial de la circulación cerebral. Se calcula tomando muestras de sangre venosa directamente del golfo de la yugular (mediante catéter yugular introducido desde el cuello por vía retrógrada) y realizando gasometría. Su valor normal oscila entre 55 – 75 %. Los valores bajos de SyO2 (menor de 55 %) se pueden interpretar como signo sugestivo de isquemia cerebral. Los valores elevados (mayor de 75 %) sugieren patrón circulatorio cerebral hiperémico. Aún con valores normales obtenidos, no puede descartarse isquemia focal, ya que la sangre que se analiza es la drenada por gran parte del encéfalo, por lo que la isquemia muy local no influye en la saturación general.
Se debe cateterizar la vena yugular interna del lado más afectado o la predominante, determinándola mediante compresión alterna de ambas yugulares; la que cause mayor elevación de la PIC debido a su compresión es la dominante.
Diferencia arterio-yugular de 02 (Da-yO2): Una vez calculada la saturación de oxígeno en el golfo de la yugular, se calculará su diferencia con la saturación arterial de oxígeno, mediante la realización simultánea de gasometría arterial. Su valor normal es de 6,3 ± 2,4 (3,9-8,7) Vol. % para una PaCO2 de 40 mm Hg (si la PaCO2 es menor de 40 mm Hg, sumar 3 % a 6,3 por cada 1 mm de PaCO2 por debajo de 40; si la PaCO2 es mayor de 40 mmHg, restar 3 % a 6,3 por cada 1 mm de PaCO2 por encima de 40 mmHg). Si está disminuida (menor de 3,9 Vol. %), es sugestiva de patrón hiperémico de circulación cerebral. Si está aumentada (mayor de 9 Vol. %), es sugestiva de isquemia cerebral.
Extracción cerebral de O2 (EcO2): Se refiere a la fracción de oxígeno que es extraída por el encéfalo para su consumo metabólico, que en condiciones normales es de alrededor del 33 %. Se calcula mediante la siguiente fórmula: Da-yO2 EC- O2 = x100 CaO2
Su valor normal oscila entre 24 – 42 %.
Los valores bajos (menos de 24 %) son sugestivos de patrón circulatorio cerebral hiperémico.
Los valores altos (menos de 42 %) son sugestivos de isquemia o hipoxia cerebral.
Tasa metabólica cerebral de oxígeno estimada (TMC-02 e): Normalmente la tasa metabólica cerebral de oxígeno representa el acople entre el flujo sanguíneo y el metabolismo cerebrales, y se calcula a partir de los valores del flujo sanguíneo cerebral (FSC). Este parámetro es muy difícil de calcular en nuestro medio, requiriendo de tecnología no accesible o de métodos poco confiables, por lo que se calcula la tasa metabólica cerebral de oxígeno estimada, a partir de la siguiente fórmula:
PaCO2EC-O2(e)=Da-yO2x100.
Se utiliza un factor de corrección, multiplicando el resultado por 1,36 en los casos hiperémicos y por 0,77 en los casos con flujo normal o bajo.
El valor normal estimado es de 2,5 ± 1 ml/100 gr/ min.
El valor normal medido es de 3,3 ± 0,8 ml/100 gr/ min.
Diferencia arterio- yugular de Lactato (Da- y L): Se calcula hallando la concentración de lactato en la sangre extraída del golfo de la yugular y en la sangre arterial.
Su rango de valor normal es de – 0,17 ± 0,2 mmol/L.
Los valores aumentados se consideran diagnóstico de isquemia cerebral.
Existen otros métodos de medición de variables metabólicas cerebrales, como son la medición de saturación de oxígeno intraparenquimatosa, la niroscopía o espectroscopia cercana al infrarojo y la microdiálisis cerebral, que es capaz de medir concentraciones intraparenquimatosas de glucosa, lactato y glicerol. Estos estudios requieren equipos muy sofisticados y aún no hay disponibilidad de ellos en nuestro medio.
Ultrasonido Doppler trans-craneal:
Permite evaluar la velocidad de flujo sanguíneo cerebral (VFSC). Puede ser utilizado para monitorización, generalmente de la arteria cerebral media, y su empleo en el TCE grave permite identificar cambios característicos del aumento progresivo de la PIC y la disminución de la PPC (reducción de la velocidad de flujo y aumento del índice de pulsatilidad por descenso de la velocidad diastólica). Un aumento de la VFSC podría representar un estado de vasodilatación hiperémica en pacientes con edema cerebral e hipertensión intracraneal, o vasoespasmo en el curso de una hemorragia subaracnoidea. También resulta útil en el diagnóstico de muerte encefálica.
Conducta general en Cuidados Intensivos
Posición de la cabeza y el cuello: alineados con el resto del cuerpo, sin flexión, ni extensión excesiva. El collarín deberá ser retirado si aparece PIC elevada. Si el paciente no presenta hipotensión o una PPC baja, la cabeza debe elevarse de 20 a 30 grados sobre el plano de la cama. Si se va a realizar monitoreo de la PIC, la cabeza se debe mantener en posición neutra y a 00 de elevación.
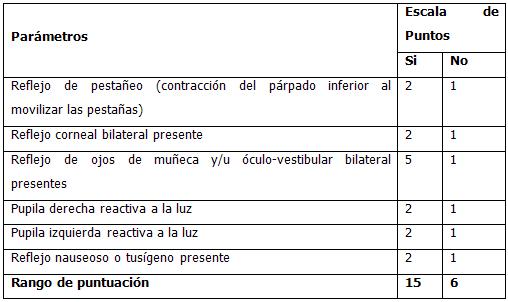
Examen clínico del paciente: Forma parte esencial de su manejo, ya que al complementarse con el neuromonitoreo, permite el diagnóstico de las lesiones del paciente, de su funcionamiento encefálico y de la aparición de complicaciones. Debe ser realizado periódicamente, comparando siempre los resultados obtenidos con los previamente anotados. Para sistematizar su realización, se debe aplicar la Escala de Coma de Glasgow (previamente descrita en el acápite de manejo a la llegada al Hospital).
Pueden además aplicarse otras escalas clínicas para la evaluación de parámetros neurológicos. Para evaluar la función del tallo encefálico puede utilizarse la conocida Escala de Pittsburg.
Sondaje vesical: Se debe medir la diuresis horaria, para poder reponer las pérdidas, y mantener estable el estado hemodinámico, lo cual garantiza que la PPC se mantenga dentro de parámetros aceptables (recordar que la PPC depende directamente de la TA media).
Abordaje venoso profundo: Permite una vía más estable para la reposición de líquidos, y la posibilidad de medir la presión venosa central (PVC). Se debe en este momento realizar además la cateterización retrógrada de la vena yugular interna para lograr la toma de muestras de sangre del golfo de la yugular. Esta técnica se realiza mediante punción directa de la vena yugular interna con trocar, penetrando por vía anterior a la rama esternal del músculo esternocleidomastoideo o por el vértice entre el triángulo conformado por sus dos ramas inferiores (triángulo de Sedillot), dirigiendo el trocar hacia arriba, hacia el conducto auditivo externo ipsilateral. Se pasa un catéter a través de la yugular en dirección superior, hasta que su avance se detenga en la base del cráneo (aproximadamente 10 - 15 cm). Se retira entonces el catéter entre 0,5 – 2 cm y se realiza radiografía lateral de cráneo y columna cervical. La punta del catéter debe ser visible por encima del arco de C- 2. En esta posición la sangre recogida de él representa aproximadamente los valores de saturación encefálicos. Si el catéter queda en posición baja, se incorpora sangre proveniente del cuello o tejidos epicraneales, que falsea la precisión de los valores obtenidos.
Aspiración de la vía aérea: Durante la aspiración de la vía aérea, se produce estimulación traqueobronquial, desencadenándose reflejos que provocan elevación transitoria de la PIC. Para evitar la elevación de la PIC, la aspiración de la vía aérea debe realizarse tomando las siguientes medidas:
Lidocaína: 1-1,5 mg/Kg endovenoso, 4-5 minutos antes de la aspiración, o 100 mg endotraqueal en el momento de la aspiración.
FiO2 = 1, durante 5 minutos previos a la aspiración.
Aspiraciones breves, repetidas si fuera necesario.
Si la PIC previa se encuentra elevada a pesar del tratamiento específico, se puede usar Tiopental 2-3 mg/Kg endovenoso lento.
Balance hidroelectrolítico estricto: Se debe realizar varias veces en el día, así como mantener ionogramas actualizados. La reposición de líquidos debe hacerse según la diuresis horaria, sobre todo cuando se utilizan depletantes, como el Manitol. Para reponer volumen pueden utilizarse soluciones cristaloides (NaCl isotónico o hipertónico en algunos casos) o coloides (gelatinas, albúmina, glóbulos). No deben utilizarse soluciones glucosadas, dato que ya fue comentado en el acápite de atención pre- hospitalaria.
Los objetivos a lograr son:
• TA media > 90 mmHg.
• Hematocrito entre 0,30 – 0,35 fr/Vol.
• Normovolemia.
• Electrolitos dentro de parámetros normales.
Debe vigilarse la presencia de hiponatremia, requiriéndose para su tratamiento la determinación de la osmolaridad plasmática. Serán tratadas las hiponatremias hipo-osmolares. Se debe tener cuidado al reponer sodio en las hiponatremias de más de 24 horas de evolución, debido al riesgo de mielinolisis. Ante un cuadro de hiponatremia persistente acompañada de hipotensión arterial y poliuria, debe tenerse en cuenta la posibilidad diagnóstica de un “síndrome de pérdida cerebral de sal”, que requiere tratamiento con NaCl hipertónico, sobrecarga de volumen e incluso con mineralocorticoides en ocasiones. La hipernatremia debe ser tratada con mucho cuidado, debido al riesgo de edema cerebral inducido por el tratamiento. También la hiponatremia puede ser producida por la presencia de un “síndrome de secreción inadecuada de hormona antidiurética”, que se caracteriza por hiponatremia con volumen sanguíneo aumentado o normal e hipo-osmolaridad del plasma, y cuyo tratamiento requiere reducción del volumen de agua corporal y uso de diuréticos de asa o Manitol. La hipernatremia, por el contrario, puede verse en estos pacientes, provocada por una “diabetes insípida”, generalmente por disfunción hipotalámica, encontrándose hipernatremia, hiperosmolaridad plasmática y poliuria, y requiriéndose para su tratamiento el uso de vasopresina acuosa subcutánea o intramuscular 5- 10 Uds. cada 4- 6 horas.
Ventilación mecánica: En el paciente con lesión encefálica grave la ventilación generalmente es insuficiente para mantener los parámetros hemogasométricos requeridos para su manejo adecuado. Además, la ventilación mecánica en estos casos actúa como arma a emplear para, mediante la modificación activa de los parámetros ventilatorios y hemogasométricos, actuar sobre los mecanismos que garantizan el funcionamiento de la circulación encefálica y así regular parámetros que puedan, por su alteración, comprometer la vida del paciente, como son la PIC, la PPC, el FSC, entre otros.
Los objetivos a alcanzar son:
a) PaO2 – 100 mmHg
b) PaCO2 – 35 mmHg
No debe convertirse en rutina hiperventilar a estos pacientes sin haber realizado estudios de los parámetros de neuromonitorización, ya que durante las primeras 24 – 48 horas posteriores a un trauma craneoencefálico grave existe una disminución fisiológica del FSC, y la hiperventilación indiscriminada sin conocer el patrón de circulación y metabólico cerebrales, puede, al producir vasoconstricción, provocar caída del flujo sanguíneo regional por debajo de límites aceptables por el cerebro y llevar a una lesión isquémica irreversible.
De ser posible, estimular la ventilación asistida (siempre que se puedan mantener dentro de límites adecuados los parámetros ventilatorios y hemogasométricos ya descritos), ya que los esfuerzos respiratorios espontáneos mejoran el retorno venoso. Si esto no es posible, utilizar modalidad volumen -control.
Deben evitarse los valores de presión positiva al final de la expiración (PEEP) mayores de 10 mmHg, ya que las presiones intratorácicas se transmiten retrógradamente por vía venosa, provocando aumentos de la PIC. De ser necesaria su aplicación, se requiere un neuromonitoreo completo para valorar su efecto.
Nutrición: Se recomienda comienzo precoz de la nutrición artificial en forma progresiva, con bajo aporte de glucosa, si es posible por vía enteral.
No se aconseja la nutrición parenteral hipercalórica porque afecta la hemodinamia cerebral. Son aconsejables los aminoácidos como aporte calórico fundamental en los pacientes con intolerancia a la nutrición enteral.
Evitar la hiperglicemia. Deben tratarse con insulina simple subcutánea los valores de glicemia superiores a 11 mmol/l. La hipoglicemia también es perjudicial, por lo que los valores de glicemia deben mantenerse dentro de rangos normales.
Control de la temperatura: Debe mantenerse la temperatura por debajo de 37 º C. Se recomienda el enfriamiento físico con aire acondicionado, paños helados, baños de alcohol, éter, lavado gástrico o enemas con agua helada y mantas de hipotensión. Si estas medidas provocan temblor y vasoconstricción, se debe relajar al paciente.
Sedación, analgesia y relajación: La sedación está indicada para el control de la excitación y de la hipertonía.
Se recomiendan las siguientes drogas:
La relajación debe evitarse de ser posible, ya que dificulta la evaluación neurológica del paciente y retarda el destete del ventilador. Puede utilizarse para el traslado de pacientes agitados o con signos de herniación transtentorial con crisis de rigidez.
La relajación está indicada en las siguientes situaciones:
• Hipertonía no resuelta con sedante.
• Lucha con el ventilador.
• Temblor por frío en el curso de medidas antitérmicas.
• Hipertensión intracraneal que no resuelve con otros métodos.
La analgesia debe utilizarse durante la realización de procedimientos dolorosos, aún en pacientes en coma, y en las primeras 48 horas del posoperatorio. Puede procurarse mediante dipirona u opiáceos.
Conducta específica en Cuidados Intensivos.
a) Medición constante de la PIC
b) Cuidados del catéter intracraneal (intraventricular o intraparenquimatoso).
c) Se acoplará el catéter intracraneal para medir PIC a un transductor y su lectura será reflejada en un monitor
d) Inserción de catéter en el golfo de la yugular para medir saturación de oxígeno y lactato.
e) Inserción de catéter intrarterial en arteria radial para monitorizar la presión arterial media (puede realizarse también por medio de método no invasivo, en caso de existir monitores con dicha modalidad disponibles).
f) Se realizará toma inmediata de muestra de sangre del catéter insertado en el golfo de la yugular y de sangre arterial, realizando gasometría a ambas.
Si PIC < 20 mm Hg:
Calcular patrón circulatorio cerebral.
Normohémico:
• Medidas generales
Oligohémico (hipoxia cerebral):
• Medidas generales.
• Mantener tensión arterial media > 90 mm Hg.
• Mantener PaCO2 entre 35 – 45 mm Hg.
• Mantener normovolemia.
• Anticálcicos (nimodipina: 2 mg endovenoso cada 1 h ó 60 mg vía oral cada 4 h.)
Hiperémico (perfusión de lujo):
• Medidas generales
Si PIC > 20 mm Hg:
Calcular patrón circulatorio cerebral.
Normohémico:
• Medidas generales.
• Drenaje de líquido cefalorraquídeo si el catéter está insertado en ventrículo cerebral.
• Hiperventilación ligera (PaCO2 – 30 mm Hg)
• Manitol 0, 25 gr/kg.
Oligohémico:
• Medidas generales.
• Drenaje de líquido cefalorraquídeo.
• PaCO2 35 – 45 mm Hg.
• Manitol 0, 25 gr/kg.
• Nimodipina 2 mg endovenoso cada 1 h ó 60 mg vía oral cada 4 h.
Hiperémico:
• Medidas generales
• Drenaje de líquido cefalorraquídeo.
• Hiperventilar (PaCO2 25 – 30 mm Hg.)
Si a pesar de dichas medidas se mantiene la PIC en cifras por encima de 20 mmHg por más de 30 minutos, se procederá a administrar barbitúricos a altas dosis (Tiopental 5 mg/Kg endovenoso lento inicial, continuar con infusión endovenoso 1–3 mg/kg/min. En el electroencefalograma se comprueba patrón de Burst- Suppression, alternando descargas con línea isoeléctrica) y proceder a la hipotermia moderada (tratar de reducir la temperatura corporal a 33 – 34 0C) con el objetivo de reducir lo más posible el metabolismo cerebral, y así realizar una neuroprotección eficaz, además de poder disminuir el volumen de sangre que necesita afluir al encéfalo.
Si a pesar de estas medidas la PIC se mantiene elevada por encima de 20 mm Hg por más de 30 minutos más, se procederá a llevar el paciente al quirófano, para realizar craneotomía descompresiva con plastia de duramadre, para disipar la presión intracraneal y aumentar posibilidad de que se mantenga el normal funcionamiento dentro del cráneo.
Si luego de realizados estos procedimientos no existe disminución de la PIC ni mejoría clínica del paciente, se debe manejar a este como posible donante de órganos, y mantener la terapéutica hasta que exista mejoría o se compruebe la muerte neurológica.
En caso de existir hemorragia subaracnoidea luego del trauma, se añadirá al tratamiento un anticálcico (nimodipina, 2 mg endovenoso cada 1 hora durante 7 a 10 días y continuar con 60 mg vía oral cada 4 horas durante 21 días.
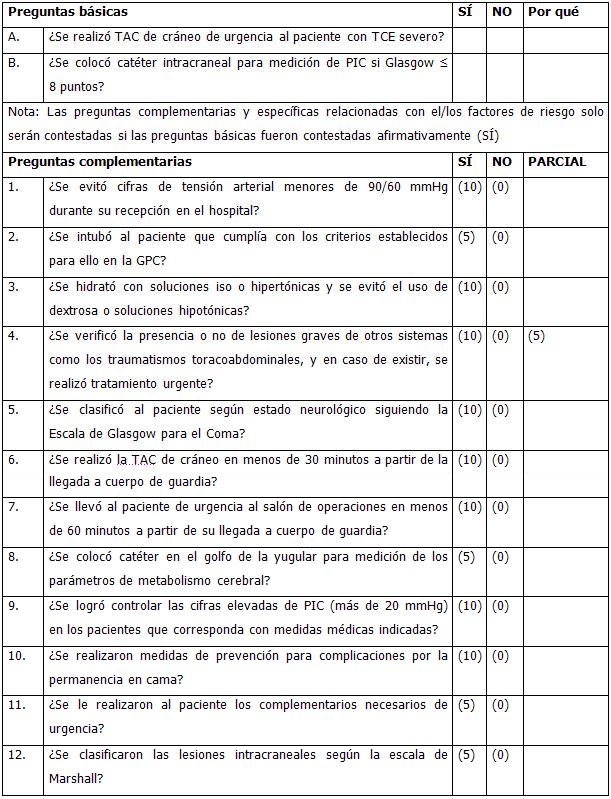
GUÍA DE EVALUACIÓN