INTRODUCCIÓN
La insuficiencia úteroplacentaria limita la disponibilidad de nutrientes y en particular la disminución del nivel del oxígeno (hipoxia) al feto.(1) El suministro de nutrientes comprometido y el estrés oxidativo trae como consecuencia un retraso del crecimiento intrauterino (RCIU).(1) En estas condiciones se modifica el flujo hemodinámico con alteraciones en el patrón de crecimiento del corazón y del árbol arterial.(2)
Durante la etapa prenatal el miocardio inmaduro presenta numerosos capilares por cardiomiocitos. A medida que ocurre la maduración esta relación disminuye; a una proporción de 1:1 capilar/miocito.(2,3) Estudios en fetos humanos(4,5) y animales afectados por retardo del crecimiento intrauterino (RCIU) refieren pocos cardiomiocitos e hipertrofia con remodelación ventricular,(6) lo cual sugiere que, si el número de cardiomiocitos disminuye significativamente, su tamaño aumenta para acomodarse al tamaño que adquirirá el corazón, necesario para su función en el adulto. Sin embargo, al presentar menos células de mayor tamaño, significan menos capilares y por lo tanto el miocardio será más vulnerable al daño isquémico.(3)
Existen evidencias de que estas modificaciones se acompañan de alteraciones en la maquinaria contráctil de los cardiomiocitos y en la matriz extracelular,(6) lo cual repercute en la función y las capacidades adaptativas del corazón en la vida adulta.(2,3,4,5,6)
Para prevenir los efectos del estrés oxidativo y la hipoxia en RCIU durante la vida prenatal se han empleado antioxidantes como las vitaminas E y C y otros tratamientos como ácido acetilsalicílico (ASA), metformina, con resultados contradictorios.(7) Los investigadores proponen evaluar posibles opciones terapéuticas eficientes para superar o prevenir la insuficiencia placentaria. En la actualidad se estima que en un 15 % de las gestaciones, nacen niños con retraso del crecimiento intrauterino (RCIU), su diagnóstico se realiza en estadios tardíos de la gestación y hasta el momento los tratamientos intraútero no son lo suficientemente efectivos para revertir esta situación.(6)
La eritropoyetina (EPO) es una glicoproteína cuya función primaria es estimular la eritropoyesis. Más allá de los conocidos efectos hematopoyéticos de la EPO, esta hormona también presenta efectos citoprotectores en tejidos no hematopoyéticos.(8,9) En el sistema cardiovascular, hay evidencia de que los receptores (EPOR) están presentes en la superficie de los cardiomiocitos y las células endoteliales.(10) Estudios en el corazón muestran que la eritropoyetina (EPO) tiene efecto protector del daño isquémico en varios modelos experimentales y en estudios clínicos.(11,12) Atribuido a las propiedades antinflamatorias y angiogénicas de la EPO, se ha observado una disminución en el tamaño del área de infarto, en la fibrosis miocárdica y mejoría en la función del ventrículo izquierdo en hipoxia.(12) Sin embargo, los datos clínicos no coinciden con los resultados de estudios sobre sujetos experimentales, por lo que es necesario continuar con los estudios clínicos y experimentales.(10)
Cuba patentó una eritropoyetina recombinante humana con bajo contenido de ácido siálico (NeuroEPO) suministrada por vía nasal para el tratamiento de enfermedades cerebro vasculares.(13) Esta tiene utilidades terapéuticas superiores porque tiene mayor afinidad con su receptor y elimina el riesgo de producir eritropoyesis, facilitando su respuesta fisiológica en la angiogénesis, la proliferación celular e inhibición de la apoptosis en zonas de isquemia cerebral.(14) La carencia de efectos eritropoyéticos de la NeuroEPO con bajo contenido de ácido siálico y sus múltiples mecanismos con actividad citoprotectora universal, hacen de ella un recurso muy sugerente para la evaluación de un efecto protector en los tejidos fetales y placentarios.(14)
Algunos investigadores han publicado trabajos que demuestran que la molécula eritropoyetina puede atravesar la circulación materna y llegar al feto.(15) Otros investigadores han encontrado que la EPO y su receptor se expresan tempranamente en el embrión, en varias de sus estructuras, lo cual pone de manifiesto la necesidad de proteger a estas estructuras en las primeras etapas de desarrollo.(16) Durante etapas tempanas de la gestación la EPO estimula la proliferación e inhibe la apoptosis en células de la decidua y el trofoblasto activando STAT 5 e inactivando p38.(17)
Teniendo en cuenta las evidencias del efecto protector de la NeuroEpo en los tejidos cardiacos con isquemia, (11) la implicación de la EPO en el desarrollo embrionario(17) y que existen reportes de que la EPO puede atravesar la placenta,(15) esta investigación se propuso como objetivo evaluar la influencia de la NeuroEPO en el desarrollo fetal y sus efectos protectores sobre el corazón en un modelo de insuficiencia placentaria en ratas.
MÉTODOS
Se realizó un estudio de tipo experimental preclínico, transversal, exploratorio. La investigación se desarrolló en el Departamento de Embriología del Instituto de Ciencias Básicas y Preclínicas Victoria de Girón, en el período de 2019 a 2022.
Se utilizaron 14 ratas de la especie Wistar obtenidas del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB) de Cuba, siguiendo los preceptos éticos establecidos.(18) Estas fueron alojadas en una jaula individual a 23 ºC en un ciclo de luz-oscuridad de 12 h respectivamente, con agua y alimento ad libitum (a placer, a voluntad, como gusten).
Las ratas fueron apareadas durante la noche, en las fases proestro y estro del ciclo estral. Se consideró el día cero de la gestación cuando se encontraron espermatozoides en el lavado vaginal realizado en la mañana posterior al apareamiento.(17)
Modelo de insuficiencia placentaria:
En el día 16 de gestación las ratas fueron sometidas al procedimiento quirúrgico. A todas las ratas gestadas se les realizó la ligadura de la arteria uterina derecha entre el segundo y tercer feto,(20) estableciendo una insuficiencia vascular en uno de los cuernos uterinos. El mismo día que se realizó la ligadura las ratas fueron distribuidas aleatoriamente en dos grupos experimentales. Los grupos conformados por siete madres cada uno: un grupo I (Control) inyectado con placebo (NaCl 0.9 % por vía subcutánea) y un grupo II tratado con NeuroEPO, utilizando una dosis de 0,5 mg/kg/día por vía subcutánea.(16) Este procedimiento se repitió por tres días en las mañanas hasta el día 18,5 EG.
Eutanasia y recogida de muestras:
En el día 20 de la gestación previa anestesia se realizó la laparotomía para obtener los cuernos uterinos, estudiar los fetos y sus placentas. Posteriormente, a las madres se les realizó eutanasia por punción intracardiaca bajo anestesia con tiopental sódico (50-60 mg/kg). Los fetos fueron divididos según el cuerno uterino donde se encontraban. Se tomó el cuerno izquierdo como control interno, conformando cuatro grupos: un grupo Control (n=35), un grupo con RCIU (n=20), un grupo Control NeuroEPO (n=38) y un grupo RCIU NeuroEPO (n=24).
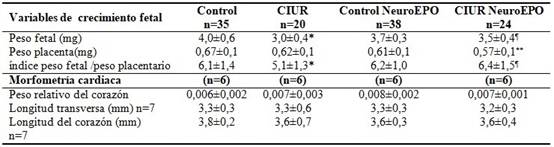
Las siguientes variables se determinaron en los fetos y sus placentas: peso placentario (mg), peso fetal (mg), peso del corazón (mg), peso relativo del corazón (peso corazón/peso fetal), longitud transversa y longitudinal del corazón (mm). El número de los cardiomiocitos, el número de vasos sanguíneos y la cuantificación de fibras colágenas se realizó con un examen histológico en láminas teñidas con H/E.
Procedimientos:
En toda la descendencia se determinó el peso del feto y de su placenta. A una muestra de seis fetos seleccionados al azar por grupo de cada cuerno se les realizó la toracotomía y se les tomó fotografía del corazón dentro del tórax. Fue utilizada una cámara fotográfica Motic acoplada a estereoscopio con un objetivo de 2X para la medida longitudinal y transversal del corazón.
Los corazones de cinco fetos por grupos fueron seleccionados al azar y se fijaron en formalina tamponada al 10 %. Posteriormente, los corazones fueron incluidos en parafina y cortados a 5 micrómetros (µm) a nivel de los ventrículos con un micrótomo Spencer Lens Company. Los cortes fueron colocados en láminas y teñidos con hematoxilina-eosina (H/E). En las cinco láminas seleccionadas por grupos, se fotografiaron siete campos por corte con un objetivo de 100X para contar del número de los cardiomiocitos. Además, se fotografiaron cinco campos por corte con un objetivo de 40X para el conteo de los vasos sanguíneos. Las fotografías se tomaron con una cámara Motic (Moticam 10.0 MP) acoplada a un microscópico Motic (Motic BA310). En las imágenes digitalizadas se realizó el conteo celular y de vasos sanguíneos mediante el empleo del software libre ImageJ (http://rsb.info.nih.gov/ij/).
Para cuantificar la cantidad de fibras de colágeno se utilizó un microscopio de polarización con un objetivo de 10x, se fotografiaron tres campos por cada lámina. Las fotografías se tomaron con una cámara NIKON acoplada a un microscópico de polarización NIKON (eclipse CL-S/Ci-L). Las fibras colágenas son birrefringentes a la luz polarizada y permite ver las fibras colágenas en color amarillo. En las imágenes digitalizadas se realizó la cuantificación de las fibras colágeno con la ayuda del software Image-Pro Plus 6.0®, (Mediacybernetics, USA) mediante el marcador DOI (Densidad Óptica Integrada). Los resultados de la densidad óptica integrada (DOI) se presentaron como el promedio de los datos obtenidos de los 15 campos.(21)
Los datos se presentan en figuras y gráficos, con medidas de tendencia central y de dispersión. Las pruebas estadísticas aplicadas fueron: prueba de Shapiro-Wilk para identificar normalidad y el test de Kruskal-Wallis para comparar variables no paramétricas variables. Se consideró significancia estadística de p<0.05. Se usó como soporte informático el programa estadístico Microsoft Office Excel 2013 y GraphPad Prism 5.01.
RESULTADOS
Se observó una disminución del peso fetal en el grupo RCIU al compararlo con el grupo Control, con diferencias significativas. En el grupo RCIU tratado con NeuroEPO aumentó el peso fetal al compararlo con el grupo RCIU, pero no recuperó el peso a los niveles del Control. El peso de la placenta fue menor en el grupo RCIU NeuroEPO. Este resultado modificó el índice peso fetal/peso placenta, el cual aumentó en este grupo con diferencias respecto a los demás grupos. Las variables morfométricas del corazón no se modificaron entre los grupos. (Tabla 1).
Los resultados son presentados como media o mediana más la desviación estándar, fueron analizados por Kruskal-Wallis. (*) Diferencia significativa entre Control y RCIU, (**) Diferencias significativas entre Control y RCIU con NeuroEPO, (¶) Diferencia significativa entre RCIU y RCIU NeuroEPO. (P<0.05)
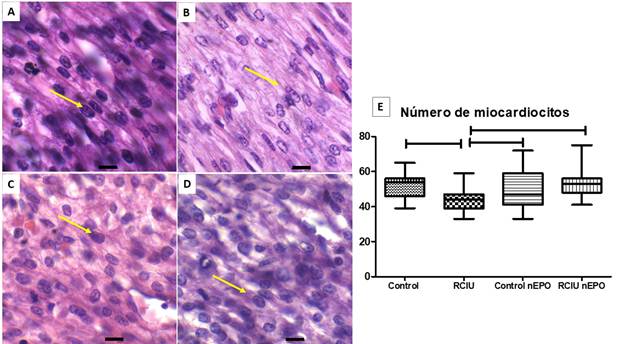
En la figura 1, se observan los cardiomiocitos en los cuatro grupos. Al comparar la imagen del grupo Control con respecto al grupo RCIU se evidencia un menor número de cardiomiocitos en el grupo RCIU. Mientras el grupo de RCIU tratado con NeuroEPO aumenta el número de células respecto al grupo de RCIU. En el gráfico (figura 1E) se cuantificó el número de cardomiocitos, el grupo RCIU presenta una disminucion de esta variable con respecto al grupo Control y al grupo RCIU tratados con NeuroEPO con diferencias significativas. (Fig. 1, Graf.1E).
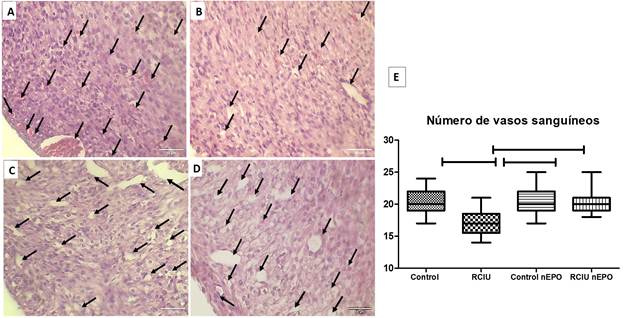
El grupo con RCIU presentó menor cantidad de vasos sanguíneos respecto al grupo Control y al grupo RCIU tratados con neuro-EPO. En el gràfico 2 F se cuantificó el número de los vasos sanguíneos en los cuatro grupos. El grupo RCIU presenta disminución del número de vasos sanguíneos con diferencias significativas respecto a los grupo Control y grupo RCIU tratado con neuro-EPO. (Fig. 2, Gràf. 2F).
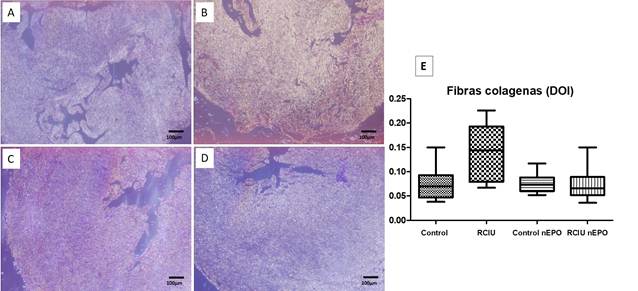
El grupo con RCIU presentó mayor concentración del color amarillo (fibras colagenos birefrigentes) al ser comparada con los otros tres grupos de estudio. En el desarrollo normal las fibras colágeno deben estar concentradas alrededor de las válvulas del corazón. Al observar la distribución de las fibras colágeno en el grupo RCIU estas se encuentran diseminadas por todo el tejido cardíaco. Estos resultados hacen pensar que el grupo RCIU presentó alterada la cantidad y la organización de las fibras colágeno. El gráfico representa la cantidad de fibras colágeno calculada por DOI en los cuatro grupos. El grupo RCIU mostró mayor cantidad de fibras colágeno con diferencias significativas respecto al resto de los grupos. La administración del NeuroEPO en el grupo RCIU disminuye las fibras colágeno en el corazón fetal con RCIU semejante a los valores del Control. (Fig. 3).
DISCUSION
El modelo empleado con la ligadura de la arteria uterina derecha entre el segundo y tercer feto ocasionó una disminución del flujo sanguíneo provocando hipoxia y una disminución de nutrientes, con efectos negativos en el crecimiento fetal en las ratas. El peso disminuido en el grupo RCIU con ligadura entre el segundo y el tercer feto avala este modelo en ratas.
La administración de NeuroEPO no logró un peso similar al control en las crías con RCIU, pero consiguió pesos superiores al grupo con RCIU al que no se le suministró NeuroEPO. En la literatura revisada muchas intervenciones se han centrado en la prevención y/o el tratamiento de la preeclampsia con resultados relacionados al RCIU, debido a la fisiopatología común. En una revisión sistemática realizada se determinó que la aspirina(ASA) administrada en mujeres con factores de riesgo para presentar preclamsia previene su aparición, y disminuye la restricción del crecimiento fetal de forma significativa. También en un modelo en ratas gestadas con reducción del flujo uterino y tratadas con ASA, se logró mejorar el crecimiento fetal. A pesar de que el ASA ha demostrado cierta mejoría para estos pacientes, las terapias para aumentar el crecimiento fetal y mejorar la mala placentación y el flujo sanguíneo uterino continúan en estudio.(7) En un metaanálisis de ensayos clínicos en humanos donde aplicaron tratamientos con ASA, con heparina de bajo peso molecular, con melatonina y con n-acetilcisteína una vez realizado el diagnóstico de RCIU se encontró que el peso fetal no mejoró.(7) Sus resultados son similares a los obtenidos en esta investigación.
Las placentas menos pesadas se apreciaron en el grupo RCIU tratado con NeuroEPO y en consecuencia la proporción de peso fetal/placentario que mide eficacia placentaria fue significativamente mayor para el grupo RCIU tratado con NeuroEPO, lo que indica que las placentas fueron capaces de aportar más gramos al feto por gramo de placenta. Estudios de mediciones de transferencia placentaria en vivo demuestran que las placentas menos pesadas muestran mayor transporte activo por gramos de placenta. Además, aumenta la expresión de genes que codifican las isoformas de los transportadores de aminoácidos del Sistema A. Estos cambios en el trasporte de nutrientes pudieran ser la causa de que las placentas más ligeras tienen una mayor eficiencia. La NeuroEPO suministrada a estas madres pudiera haber propiciado cambios adaptativos en la placenta con flujo disminuido para garantizar el transporte de nutrientes y permitir mejor crecimiento y el desarrollo fetal a pesar de las condiciones intrauterinas adversas.
El peso relativo del corazón y sus dimensiones no se modificaron en los grupos. Se encontraron variaciones a nivel celular en el corazón del grupo RCIU como disminución del número de cardiomiocitos, de vasos sanguíneos y aumento de las fibras colágenas que se recuperó con la administración de NeuroEPO. Estos resultados confirman que la disminución del flujo sanguíneo provoca alteración en el desarrollo fetal y la morfología cardiaca.(2,3,4,5,6)
Los investigadores han encontrado una fuerte asociación entre el RCIU y la remodelación cardíaca y arterial en estado subclínico desde etapas muy tempranas en el desarrollo.(4) En un estudio en ratas gestadas con diferentes edades gestacionales y grados de severidad de hipoxia, encontraron disminución del peso fetal e incremento del peso del corazón con alteración en la función y contractilidad cardiaca en el adulto lo cual favoreció la isquemia cardiaca. Hay estudios que explican la disminución de los cardiomiocitos y las alteraciones del metabolismo cardiaco en las crías con RCIU. Desde el punto de vista molecular, los investigadores plantean que en recién nacidos con hipoxia aumenta significativamente el factor HIF 1 alfa (factor inducible por hipoxia Alfa) y el promotor del endotelin 1 con su receptor, ambos intervienen en la proliferación celular y maduración del cardiomiocito. Esta vía se encuentra modificada en el RCIU pero aún se desconoce cómo disminuye la proliferación celular. Por otro lado, dos proteínas del ciclo celular están desreguladas. La ciclina D2 se encuentra disminuida y aumentada la concentración de p27, como consecuencia se reduce la proliferación de los cardiomiocitos, pero no la maduración ni el tamaño del cardiomiocito. Otros estudios modelos en animales plantean que la desnutrición fetal en la última semana de gestación aumenta el porcentaje de apoptosis en los cardiomiocitos debido a un aumento de los receptores de muerte FAS los cuales activan las caspasas 3 y disminución de la proteína BCL-2. Recientemente, se estudió un posible mecanismo epigenético que contribuye a la disminución de las células cardiacas con hipoxia. Ellos encontraron un aumento de la expresión de mRNA-210 que suprime la expresión de receptores glucocorticoides exacerbando la muerte celular.
La binucleación o maduración del cardiomiocito está mediada por el factor de crecimiento de insulina 1 (IGF-1). Se ha evidenciado que en el RCIU está disminuida, pero está aumentado el IGF-2 que favorece el crecimiento del cardiomiocito.(6) Esto tiene gran importancia porque se pierde la relación número y volumen del cardiomiocito con respecto al volumen capilar óptimo. Estos datos demuestran que un crecimiento subóptimo en el útero altera la expresión de diferentes receptores y la activación de vías de señalización que pudieran alterar el corazón del adulto.(1)
El número del vaso sanguíneo en el grupo RCIU fue menor respecto al grupo Control. Este resultado concuerda con un estudio experimental en ratas de 10 semanas expuestas a hipoxia crónica intraútero, donde se encontró una disminución de la densidad de capilares y alteración en la relajación cardiaca, con incremento del patrón contráctil del corazón. Otro estudio experimental en recién nacidos de ratas de madres con ligadura de la arteria y vena uterina encontraron disminución de la longitud de los vasos, pero no de su densidad. El crecimiento inadecuado de la vasculatura cardiaca puede impactar adversamente en el suministro de sangre al miocardio y puede afectar el crecimiento cardíaco. La reducción en el número de cardiomiocitos de la descendencia con RCIU puede ser la consecuencia de una disminución del crecimiento capilar.(5) Si en el miocardio disminuye la cantidad de capilares podría ser más vulnerable a la isquemia coronaria a largo plazo, teniendo en cuenta que la capacidad de la angiogénesis disminuye cuando el miocardio alcanza la madurez.
Esta investigación también mostró un aumento de fibras colágeno en el grupo RCIU respecto al grupo Control. Otros autores estudiaron crías de ratas adultas sometidas a ambientes pobres en oxígeno durante la gestación, mostrando alteraciones en la remodelación cardíaca con aumento de fibras colágeno. En fetos de oveja se demostró que la hipoxia provocó un aumento MMP-9 y el inhibidor de la metaloproteinasa 2 (TIMP-2) mostrando un desbalance en la matriz extracelular con incremento el depósito de colágeno. El incremento de las fibras colágeno pudiera ser el primer mecanismo que aumente el grosor de la pared del corazón, esto pudiera afectar el flujo coronario y la conducción eléctrica.
Lo expuesto sugiere que en el grupo RCIU no se modifica el peso ni el tamaño del corazón con respecto al control. Sin embargo, hay un desbalance entre el número de células y el número de vasos sanguíneos, los cuales disminuyen y al mismo tiempo hay un aumento en la cantidad de fibras colágenas; lo que pudiera incrementar la vulnerabilidad a desarrollar enfermedades cardiovasculares en otras etapas de la vida.
Al administrar la NeuroEPO al grupo con RCIU, aumentó el número de cardiomiocitos, aumentó el número de vasos sanguíneos y se redujo la cantidad de fibras colágeno. Este estudio tiene la limitante que no fue posible medir las concentraciones de NeuroEPO en sangre fetal. Por tanto, en presencia de los cambios morfológicos en el tejido cardiaco fetal es posible asumir que esta molécula atravesó la membrana placentaria. La NeuroEPO administrada a la rata gestada pudo llegar al feto y lograr sus efectos protectores en el corazón. Muchos estudios han sugerido que las propiedades antinflamatorias de esta molécula pueden mejorar la contractilidad del cardiomiocito, estimular la diferenciación de las células cardiacas a partir de las células madres.(11) La EPO también favorece la angiogénesis al estimular el factor de crecimiento endotelial vascular (VEGF).(10) La administración de la eritropoyetina fue asociada con una mejora de la función cardiaca y la neovascularización por incremento de la expresión del factor VEGF, con reducción del tamaño del infarto miocardio. Otro estudio en que se administró la eritropoyetina asialica a células miocárdicas dañadas (in vitro) reveló su efecto protector, utilizando la vía de señalización fosfatidilinositol 3-quinasa (PI3K/Akt), la cual conduce a la supresión del gen de Mst1 y FOXO3; la inihibicion de estos genes disminuye la apoptosis y promueve así la supervivencia celular del cardiomiocito.
En nuestro estudio experimental la molécula NeuroEPO logró regular el equilibrio en la formación de los cardiomiocitos, la formación de los vasos sanguíneos y la formación de fibras colágenas en fetos con RCIU. Estos conocimientos pudieran favorecer futura investigaciones que permitan dilucidar los mecanismos subyacentes a la adaptación cardiaca fetal en estas condiciones y posteriormente presentar nuevas intervenciones en pacientes con RCIU.
Agradecimientos
A los profesionales del Centro de Inmunología Molecular de Cuba, en particular a la Dra. Teresita Rodríguez, por proporcionar la NeuroEPO y el vehículo para la realización del estudio. Al personal técnico del Bioterio del Instituto de Ciencias Básicas y Preclínicas “Victoria de Girón”, por la atención y manejo de los animales. Al Dr. Víctor M. Rodríguez, por su contribución en los procedimientos de cirugía experimental. A la profesora Sonia Clapés Hernández por su entrega incondicional.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Contribuciones de los autores
Conceptualización: Nínive Núñez López,
Curación de datos: Nínive Núñez López, Aida María Suárez Aguiar, Julito Dos Santos Dos Santos, Laura López Marín.
Análisis formal: Nínive Núñez López, Aida María Suárez Aguiar, Julito Dos Santos Dos Santos, María Antonia Cruz García, Claudia Joffre Frías, Carmen Inés Morales Paneque
Investigación: María Antonia Cruz García, Claudia Joffre Frías
Metodología: Nínive Núñez López, Laura López Marín.
Visualización: Carmen Inés Morales Paneque, Laura López Marín.
Redacción del borrador original: Nínive Núñez López, Aida María Suárez Aguiar, María Antonia Cruz García, Claudia Joffre Frías
Redacción, revisión y edición: Nínive Núñez López, Aida María Suárez Aguiar, María Antonia Cruz García, Claudia Joffre Frías.
Financiación
Universidad de Ciencias Médicas de la Habana. ICBP Victoria de Girón. La Habana. Cuba.