INTRODUCCIÓN
En la década de los años 40 del pasado siglo, el antimicrobiano más utilizado por los médicos para tratar infecciones por Staphylococcus aureus era la penicilina. Con el pasar de los años se registraron las primeras cepas que eran productores de Beta-lactamasas. Posteriormente surgió la meticilina, fármaco que tenía el objetivo de combatir las cepas resistentes, sin embargo, en 1961 Barber confirmó en el Reino Unido la primera cepa de Staphylococcus aureus resistente a la meticilina.(1) Con posterioridad, en Chile, se dio uno de los más claros reconocimientos cuando Ledermann explicó el suceso e identificó, la cepa de forma aislada en 1967, la concentración inhibidora mínima de meticilina con una cantidad mayor de 6,25 µg/mL, denominada como resistente.(2)
En los años 90 la mayoría de las infecciones por Staphylococcus aureus resistente a la meticilina (SARM) tenían lugar únicamente en ambientes hospitalarios, sin embargo, en 1993 se registró la presencia de SARM en procesos infecciosos de aborígenes australianos sin hospitalización previa, lo que confirmó nuevas y distintas cepas a las que estaban asociadas a los ambientes hospitalarios, actualmente el SARM de origen comunitario ha aumentado de forma alarmante en estos entornos.(3)
Los datos de prevalencia de SARM mostrados en un trabajo realizado en España en el 2017, ajustados a las franjas en edades pediátricas, oscilan entre el 14,9 % (0-5 años) y el 16,4 % (5-18 años). En el informe de 2019, la tasa de bacteriemia por SARM en España fue del 19,2 %, aunque esta era menor a la reportada en 2015 (25 %). La prevalencia de SARM es mayor en edades avanzadas de la vida (mayores de 65 años) porque fue del 22,8 %, tampoco es despreciable en edades pediátricas (0-4 años: 12 %; grupo de edad de 5 a 18 años: 15,7 %).(4)
En Cuba, se realizó un estudio con el objetivo de evaluar el sistema semiautomatizado DIRAMIC-10 en relación con los métodos convencionales de discodifusión para la detección específica de SARM. Fueron analizados 113 aislamientos clínicos de Staphylococcus spp. DIRAMIC-10 detectó 75 cepas de SARM con el disco de oxacilina y 8 con el disco de cefoxitina, se estableció que el 73,5 % de los aislamientos clínicos de estafilococos corresponden a cepas de SARM.(5)
En 2022 en Lima, Perú, se evaluaron las resistencias de Staphylococcus. aureus en infantes menores de 2 años, se tomó una muestra nasofaríngea de 894 niños de entre 2 meses a 2 años, la resistencia a antibióticos se evaluó con el método Kirby-Bauer, es decir, se realizaron pruebas de susceptibilidad bacteriana frente a varios fármacos, los resultados arrojaron 176 pruebas positivas para Staphylococcus aureus y tres de las cuales fueron positivas para SARM. Los datos que el estudio arrojó sobre la resistencia del Staphylococcus aureus a los siguientes antibióticos fueron: eritromicina: 34,66 %, trimetoprim-sulfametoxazol: 0 %, penicilina: 90,34 % y Clindamicina: 21,02 %.
El Staphylococcus aureus y el SARM tienen un nivel aún bajo de portación nasal, pero se registró un predominio de Staphylococcus aureus en niños de 6 meses.(6)
Estudios realizados por la Universidad Central del Ecuador muestran que en el 2013 la edad con mayor frecuencia de casos positivos para SARM fue de 60 a 80 años con predominio en el sexo masculino,(7) sin embargo, en estudios realizados por la Universidad de Cuenca durante los años 2017 y 2018, la prevalencia de SARM fue de 26,92 %. En los hombres hubo mayor prevalencia con un 56,96 % y el grupo de edad con mayor representatividad fue el de 25-64 años con un 34,18 %, el servicio de pediatría representó el 27,85 %.(8) En las últimas 2 décadas se ha observado un aumento discreto en la prevalencia de Staphylococcus aureus como agente etiológico de varios procesos infecciosos. En niños hospitalizados es el agente etiológico del 1 % de las neumonías adquiridas en la comunidad y el 15 % de las neumonías típicas de etiología bacteriana.(9)
La problemática radica en que el SARM se ha extendido a nivel mundial en diversos entornos comunitarios como: escuelas, guarderías de niños y en consecuencia en sus hogares, con una mayor facilidad de trasmisión cada vez. Con el tiempo, las células bacterianas van adquiriendo factores de virulencia que facilitan su diseminación en la comunidad, además, las resistencias a los medicamentos se vuelven notorias ante la ausencia de una respuesta positiva a la terapia con antibióticos. Por lo cual, es importante el análisis de casos relevantes y actualizados para comprender la constante evolución de la interacción entre las células bacterianas en el cuerpo humano. Como aspecto general, una buena higiene es esencial para evitar el contagio de cualquier tipo de agente microbiano, el dilema se centra especialmente en la población infantil, quienes constantemente aprenden y exploran el mundo con hábitos que facilitan la infección y propagación epidemiológica de cualquier patógeno oportunista.
El objetivo de este trabajo es: aportar información actualizada y relevante sobre la epidemiología y evolución de los casos clínicos por el Staphylococcus aureus resistente a la meticilina.
DESARROLLO
Se realizó una revisión bibliográfica en bases de datos dedicados a la investigación clínica para obtener trabajos que incluyeran la presencia del Staphylococcus aureus resistente a la meticilina en pacientes en edad pediátrica en los últimos 5 años. Los criterios de selección de los artículos incluyeron:
- Infección adquirida en la comunidad en un niño previamente sano.
- Diagnóstico microbiológico.
- Tratamiento antimicrobiano.
- Evolución.
Estos factores se analizaron de conjunto para la obtener similitudes y diferencias de los cuadros clínicos con el propósito de visualizar su evolución, lo que permitió tener un enfoque objetivo. Se encontraron 22 investigaciones acerca del tema y se utilizaron 6 que cumplieron con los criterios de selección.
Casos clínicos
- Caso 1.
En el 2017, un niño de 6 años, fue remitido a un hospital pediátrico de atención terciaria por un historial de 6 días de dolor abdominal inferior derecho y la presencia de fiebre. Los análisis de sangre revelaron una inflamación severa con un recuento elevado de glóbulos blancos, velocidad de sedimentación globular (105 mm/h) y proteína C reactiva (143 mg/L). Los hallazgos radiográficos mostraron abscesos hepáticos y abscesos de tejidos blandos alrededor del fémur izquierdo. Se comenzó terapia antibiótica con sulbactam y cefoperazona sódicos. En el cultivo de sangre se identificó al Staphylococcus aureus resistente a la meticilina, sensible a la vancomicina, entonces se realizó drenaje transhepático del absceso y se administró vancomicina intravenosa (15 mg/kg, cada 8 h.), sin embargo, el paciente no mejoró tras 10 días de tratamiento. Se realizó una incisión urgente y drenaje de abscesos de partes blandas alrededor del fémur izquierdo, la bacteriología de los abscesos reveló la presencia de SARM. El paciente evolucionó favorablemente y se realizó ecografía de seguimiento 7 semanas después del drenaje percutáneo inicial, se mostró resolución de los abscesos hepáticos.(10)
- Caso 2.
En el 2018, una paciente de sexo femenino, de 4 años, sin antecedentes patológicos de importancia fue llevada a consulta médica. Sus síntomas inician con área de celulitis en el glúteo derecho, fue evaluada en el área de salud y su tratamiento inicial consistió en la administración de amoxicilina, después apareció toma articular y urticaria diseminada, por lo que fue ingresada en la Unidad de Cuidados Intensivos (UCI) con signos inflamatorios en articulación del codo y rodilla derecha, pectoral y cadera izquierda, polipnea, taquicardia, trastornos en la perfusión y estertores húmedos bilaterales con necesidad de apoyo ventilatorio, uso de inotrópicos y antibioticoterapia combinada con vancomicina y ceftriaxona, así como fluidoterapia, su evolución fue desfavorable y falleció a las 12 horas de estadía en sala. En los rayos X de tórax se informaron imágenes sugestivas de distrés pulmonar. Se realizó un hemocultivo y se identificó SARM resistente con sensibilidad a vancomicina.(11)
- Caso 3.
En el 2019, un lactante de 7, meses sin antecedentes médicos significativos fue llevado a consulta por un historial de 3 días de tos, fiebre y mala alimentación. Una ecografía de tórax reveló derrame pleural en el lado derecho. El drenaje arrojó 180 mL. de líquido seropurulento con cocos gram positivos al microscopio. Cinco días después, se presentó un neumotórax del lado derecho, que se resolvió con un drenaje torácico anterior adicional. La microbiología reveló Staphylococcus aureus resistente a la meticilina no multirresistente, el tratamiento antimicrobiano inicialmente consistió en cefotaxima y vancomicina, que posteriormente, se cambió a cotrimoxazol debido a la mejoría del paciente. Diez días después del ingreso hubo una hemorragia pulmonar aguda con origen en el drenaje torácico. Una angiografía pulmonar por tomografía computarizada mostró un hematoma peripulmonar y dilatación aneurismática de la rama subsegmentaria de la arteria que irriga el lóbulo inferior derecho. Se controló con intubación urgente y altas presiones ventilatorias. En la angiografía se identificó un pseudoaneurisma en la rama segmentaria posterior del lóbulo inferior derecho. Se cateterizó selectivamente el vaso de alimentación segmentario con un microcatéter Progreat y se embolizó con un tapón microvascular. La angiografía final no mostró flujo residual en el pseudoaneurisma, pero sí, flujo conservado en el resto de las ramas segmentarias de la arteria pulmonar inferior derecha. La ecografía de seguimiento no mostró flujo residual dentro del aneurisma. El paciente completó un curso de 6 semanas de cotrimoxazol oral.(12)
- Caso 4.
En el 2021, un lactante menor de diez meses, sin antecedentes personales de importancia acudió a consulta por eritema y edema en dedo pulgar tercio medio de la mano izquierda y sin limitación funcional. No hubo síntomas vigentes, con adecuada tolerancia de la vía oral, por lo cual se decidió iniciar manejo con cefalexina a dosis de 50 mg/Kg al día, en las 48 horas posteriores presentó fiebre y persistencia de edema en aumento con una coloración verdosa a nivel central. Se cambió la medicación por clindamicina a dosis de 30 mg/Kg al día. Ostentó mejoría clínica progresiva, con drenaje espontáneo del absceso. Se tomó muestra para tinción gram y cultivo de secreción. Se Obtuvo una resolución paulatina de signos inflamatorios. No había dolor a la palpación en el dedo comprometido y hubo resolución de signos de respuesta inflamatoria, hubo descenso de leucocitos y proteína C reactiva (PCR), cultivo de secreción positivo para SARM, sensible a clindamicina. El paciente egresó a las 72 horas y se completó con medicación ambulatoria.(13)
- Caso 5.
En el 2021, una niña de 12 años, sin antecedentes patológicos personales y familiares de importancia clínica, con una presentación inusual de SARM de origen comunitario y tres días después de un traumatismo cerrado leve en el muslo derecho, acudió al hospital de referencia con fiebre, dolor en el muslo derecho, dificultad para respirar y dolor torácico. Presentó piomiositis en el muslo derecho, complicada con trombosis venosa profunda, embolia pulmonar séptica y neumonía necrosante. Tras 12 horas de incubación, en el hemocultivo creció el SARM sensible a la vancomicina, pero resistente a los otros antibióticos anti-SARM, sin embargo, tras cinco días de deterioro clínico con vancomicina, el paciente fue tratado con éxito con linezolid y se observó mejoría tras 48 horas de iniciar el segundo tratamiento antibiótico.(14)
- Caso 6.
En el 2022, un niño de 3 años con escabiosis recurrente, acudió al Servicio de Urgencias por un cuadro febril. Los análisis de sangre mostraron leucocitosis neutrofílica y aumento significativo de PCR y procalcitonina. En el examen médico, el muslo derecho estaba extremadamente doloroso a la palpación, había perdido la flexión de la rodilla y no podía estar de pie, por lo que se realizó una resonancia magnética y fue evidente la osteomielitis bacteriana aguda de metáfisis y diáfisis distal del fémur derecho con colección purulenta subperióstica asociada y piomiositis y fascitis concomitantes del muslo derecho distal. Los hemocultivos fueron positivos para SARM sensible a la vancomicina. Dado que se confirmó el diagnóstico de escabiosis, se administró terapia local con permetrina y tratamiento prolongado con vancomicina y cefazolina por vía intravenosa, su estado mejoró lentamente.(15)
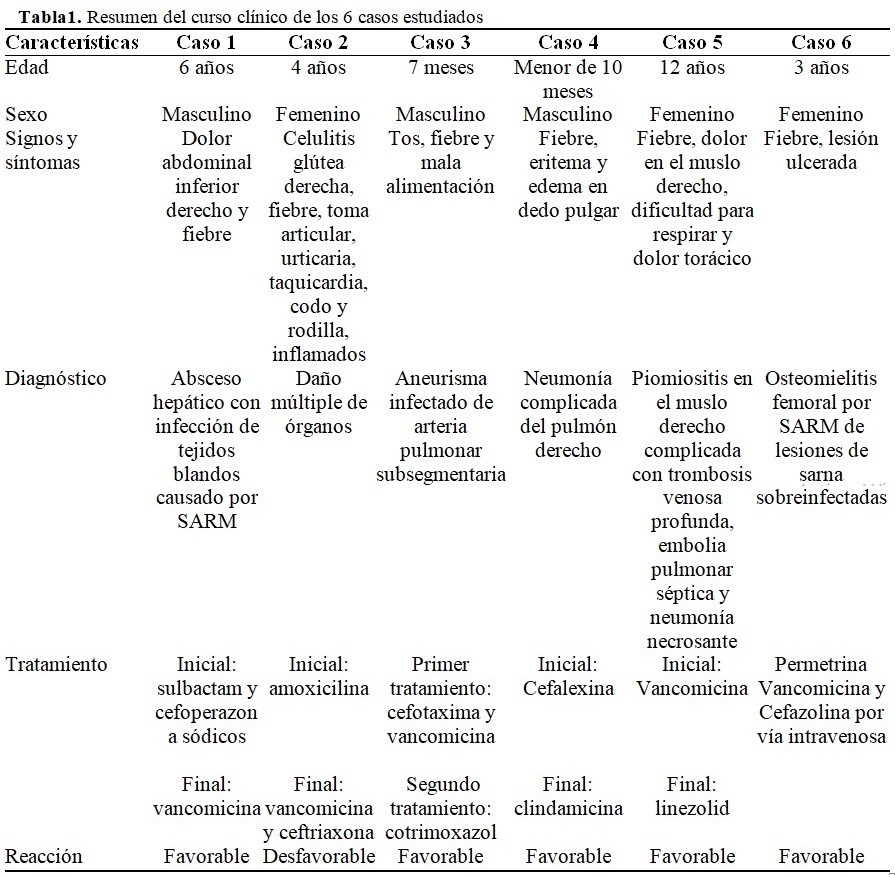
Para tener una visión objetiva de los resultados de cada caso se analizaron los resultados en una tabla comparativa que mostró de manera resumida las características de cada uno de los casos estudiados y su curso clínico. (Tabla 1).
El promedio de edad de los casos fue de 5 años. La edad temprana parece desempeñar un factor de riesgo importante para contraer un cuadro infeccioso de gravedad si no se trata a tiempo. Es evidente cómo existen más complicaciones en pacientes neonatos y en edad preescolar. En el caso clínico 2, la paciente de 4 años tuvo resultados desfavorables por la rápida diseminación de SARM a múltiples órganos, aun cuando, se administró terapia antibiótica combinada de vancomicina-ceftriaxona, esta susceptibilidad reducida a la vancomicina se asocia mucho más a una mayor duración de la bacteriemia que a los factores de resistencia bacterianos.(16) Esta menor susceptibilidad también se correlaciona en el caso clínico 5, la monoterapia con vancomicina no surge efecto y se ve limitado por la concentración mínima inhibitoria (CMI) recomendada en niños, esto pudo ocasionar deterioro clínico sin respuesta positiva a la medicación, por lo cual, hubo un cambio de terapia con linezolid para obtenerse resultados favorables.
Los medicamentos utilizados con mejor respuesta ante la infección por SARM en pacientes en edad pediátrica fueron: la vancomicina, cefalosporinas de primera generación, cotrimoxazol, clindamicina y linezolid. Con relación a cepas multirresistentes de SARM, la vancomicina y el linezolid muestran buena respuesta antibacteriana mientras se controlen las CMI≤15mg/L recomendadas en esta población (lo que está potencialmente asociado con toxicidad).(17) En cepas de SARM no multirresistentes, la terapia puede incluir antibióticos reportados como sensibles, sin riesgo de ocasionar efectos secundarios en el paciente a causa de la quimioterapia.
Un recuento de síntomas estableció a la fiebre como principal indicador y signo de alarma de un proceso infeccioso en el 100 % de los pacientes estudiados, sin embargo, a pesar de que en todos los casos la infección fue de origen comunitario, el cuadro clínico inicial se localiza en la dermis que posteriormente avanza a un cuadro infeccioso más avanzado o sistémico. Otros factores de importancia clínica son los signos de infección local (calor, rubor y dolor). La colonización inicial de las cepas bacterianas desencadena un proceso infeccioso restringido a una región, el nido inicial de una infección probablemente puede provenir de la piel, lo que provoca celulitis, fascitis, miositis y bacteriemia. Consecuentemente, la bacteriemia puede alterar la integridad de múltiples órganos y dar lugar a múltiples cuadros clínicos. La presencia de múltiples abscesos también puede ser considerado como un signo alarmante de infección local, con riesgo de diseminación y origen de trombosis venosas, aneurismas e infecciones de tejido óseo.(10)
El tiempo de resolución de un proceso infeccioso es un factor importante para delimitar la infección o permitir su evolución clínica con diseminación a otros órganos, genera un alto impacto en el pronóstico del paciente. La identificación rápida del agente microbiológico y la eliminación de los focos de infección son imperativos para brindarle un buen soporte clínico al paciente, se debe procurar la resolución del caso en el menor tiempo posible, para lo cual, son indispensables los métodos de diagnósticos moleculares que proporcionen resultados fiables en horas en lugar de días.(18) En el primer caso clínico, el paciente presentó múltiples abscesos ubicados en el hígado y tejidos blandos alrededor del fémur izquierdo, sin embargo, inicialmente fracasa el tratamiento con vancomicina intravenosa porque no se drenaron los abscesos adicionales en los tejidos blandos. De igual manera, en el segundo caso clínico se trata a una paciente de cuatro años con celulitis en glúteo derecho que no fue tratada a tiempo, por lo cual, en ausencia de tratamiento antibiótico las cepas de SARM provocaron daño múltiple de órganos terminando con la vida de la paciente.
El fracaso de la vancomicina en el caso 2 y 3 puede deberse a la baja concentración del medicamento en los pulmones y la dificultad de alcanzar un nivel terapéutico superior (>15 mg/L). Un trabajo de investigación que evaluó la farmacocinética y la penetración tisular de vancomicina y linezolid a múltiples órganos reveló que la vancomicina tiene una baja biodisponibilidad en el tejido pulmonar, mientras que su concentración en el revestimiento epitelial varía entre el 5 y el 25 % de las concentraciones plasmáticas, lo cual es un factor a tomar en cuenta en casos que cursen con neumonía por SARM.(18)
Los antibióticos con más utilización en el tratamiento de SARM son: vancomicina y daptomicina, linezolid, rifampicina o fluoroquinolonas. La duración del tratamiento está medida por el foco de la infección y su adecuado control, si existe bacteriemia se debe descartar la endocarditis infecciosa con hemocultivos de control hasta que estos se presenten 100 % negativos. En la bacteriemia no complicada, son necesarios 14 días de tratamiento desde el primer hemocultivo negativo, mientras que si es complicada serán 28 días.(19)
Las infecciones bacterianas de la piel son raras en pacientes adultos inmunocompetentes afectados por escabiosis, sin embargo, el Staphylococcus aureus es una de las bacterias que causa mayor cantidad de infecciones bacterianas secundarias; en la población pediátrica, el impétigo asociado a Streptococcus Beta-hemolíticos del grupo A y Staphylococcus aureus es bastante común, pero el Staphylococcus aureus está involucrado en casi todos estos procesos infecciosos.(20) Esta condición le otorga mayor importancia al seguimiento de la evolución clínica de los pacientes con escabiosis ante la sospecha de un cuadro infeccioso mixto que involucra especies bacterianas virulentas.
La frecuencia de un absceso hepático por SARM es raro y la recuperación es extremadamente complicada. Las bacterias más comunes asociadas a un absceso hepático piógeno incluyen la Escherichia coli, la Klebsiella pneumoniae y Streptococcus del grupo D. Cuando el hemocultivo de un niño con estado febril es positivo para SARM, es importante investigar la fuente de la infección e iniciar terapia antibiótica dirigida. En el caso 1, aunque la sensibilidad de SARM a la vancomicina fue evidente, los abscesos hepáticos tuvieron que ser drenados debido a su gran tamaño. La terapia antibiótica puede mostrar efectividad en el tratamiento de abscesos hepáticos,(21) pero una limitante puede ser el tamaño exagerado del absceso. Probablemente el paciente no respondió a la terapia inicial por la formación de abscesos en los tejidos blandos alrededor del fémur izquierdo que aún no habían sido drenados.
Si bien la edad, los antecedentes patológicos y el sitio inicial del proceso infeccioso junto con los signos y síntomas pueden brindar un panorama importante sobre el pronóstico y posibles complicaciones del paciente, la ausencia de estos datos limita el criterio médico para la toma de decisiones. En el contexto de un aneurisma parainfeccioso presentado en el caso 3, es una complicación extremadamente rara que debe considerarse en cualquier paciente que curse con neumonía y hemorragia pulmonar de inicio agudo con origen desconocido.(12)
Las infecciones por SARM solían ser un hecho estrictamente restringido a pacientes hospitalizados, donde evidentemente, se puede establecer la infección de origen intrahospitalario. Los casos clínicos estudiados en este trabajo muestran un preocupante nivel de reportes en la población infantil sin haberse detectado un vínculo previo con el ambiente hospitalario, estos seis niños presentaron infecciones por SARM y uno de ellos perdió la vida por afectación multiorgánica. La presencia de SARM de origen comunitario en niños como agente etiológico de infecciones de piel y tejidos blandos aumenta significativamente, esta realidad se convierte en un problema de salud en la población, por su elevada frecuencia y resistencia a la terapia antibiótica y por sus complicaciones.(22)
Se recomienda una buena higiene, y atención adecuada, con medidas de salubridad en pacientes en edades pediátricas, para evitar su contagio y el de sus familiares, y sobre todo al personal de salud, quienes estrictamente deberán tener un constante lavado de las manos, uso de guantes quirúrgicos y mascarillas, para de esta manera evitar la transmisión a la comunidad. De igual manera, la realización de controles microbiológicos en áreas hospitalarias y áreas pediátricas (guarderías, centros infantiles, etc.), ya que estos espacios pueden llegar a ser un foco de contagio.
CONCLUSIONES
Los pacientes en edades pediátricas tienen mayor riesgo de adquirir Staphylococcus aureus resistente a la meticilina por su edad, sin embargo, su mortalidad hasta la actualidad se identifica baja, pero esto no quiere decir que no se tenga el riesgo de contagio a personas adultas e inmunocomprometidas que están en su entorno. La estricta vigilancia, los controles adecuados, la correcta y habitual higiene en todos los entornos comunitarios son factores fundamentales para evitar la infección de origen comunitario por el Staphylococcus aureus resistente a la meticilina, principalmente en pacientes de edad pediátrica.
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Los roles de autoría:
1. Conceptualización: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
2. Curación de datos: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
3. Análisis formal: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
4. Adquisición de fondos: Esta investigación no contó con la adquisición de fondos.
5. Investigación: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
6. Metodología: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
7. Administración del proyecto: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
8. Recursos: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
9. Software: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
10. Supervisión: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
11. Validación: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
12. Visualización: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
13. Redacción del borrador original: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
14. Redacción, revisión y edición: Segundo Moisés San Lucas Coque, Sareli Anahi Aguilar Armendariz, Juan Diego Galarza López.
REFERENCIAS BIBLIOGRÁFICAS
1- Callisaya HJ, Sarmiento Z, Choque CH. Prevalencia de Portadores Nasales de Staphylococcus aureus en el personal de limpieza del Hospital Obrero. Biofarbo[Internet]. 2007[citado 27/10/22];55(15):[aprox. 6p.]. Disponible en: https://pesquisa.bvsalud.org/portal/resource/pt/lil-507159.
2- Aguayo A, Quezada M, Mella S, Riedel G, Opazo A, Bello H, et al. Bases moleculares de la resistencia a Meticilina en Staphylococcus aureus. Rev Chil Infectol[Internet]. 2018[citado];35(1):[aprox. 7p.]. Disponible en: https://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182018000100007.
3- Chaves F. Emergencia de infecciones pediátricas por Staphylococcus aureus resistente a Meticilina asociadas a la comunidad: ¿debemos dar la alerta? Enferm Infecc Microbiol Clin[Internet]. 2010[citado 30/10/22];28(10):[aprox. 3p.]. Disponible en: https://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-articulo-emergencia-infecciones-pediatricas-por-staphylococcus-S0213005X10002879.
4- Garriga L, Borrull AM, Pérez C, Montero C, Collazo I, Moya S, et al. Tasa de Staphylococcus aureus resistentes a Meticilina en urgencias pediátricas en España. Anales Pediatría[Internet]. 2022[citado 30/10/22];97(2):[aprox. 7p.]. Disponible en: https://www.analesdepediatria.org/es-tasa-staphylococcus-aureus-resistentes- Meticilina-articulo-S169540332100223X.
5- García GB, Tamayo AMZ. Detección de aislamientos clínicos de Staphylococcus aureus resistente a Meticilina. Revista CENIC Cienc Biol[Internet]. 2019[citado 30/10/22];50(2):[aprox. 7p.]. Disponible en: https://www.redalyc.org/journal/1812/181263501007/html/.
6- Aguirre PC, Li VM. Resistencia antibiótica de Staphylococcus aureus en portadores nasales menores de 2 años en Lima, Perú[Internet]. Lima:Repositorio UPCH;2022[citado 30/10/22]. Disponible en: https://repositorio.upch.edu.pe/handle/20.500.12866/11771.
7- Vaca SD, Cruz SM, Íñiguez SO, Vaca SD, Cruz SM, Iñiguez SO, et al. Prevalencia de Staphylococcus aureus meticilino resistente en el personal de salud de un Hospital de Especialidades en Quito-Ecuador. Rev San Gregorio[Internet]. 2021[citado 30/10/22];1(45):[aprox. 12p.]. Disponible en: https://revista.sangregorio.edu.ec/index.php/REVISTASANGREGORIO/article/view/1515.
8- Aucay GJ, Cárdenas PE. Prevalencia de Staphylococcus aureus meticilino resistente en muestras del laboratorio de microbiología del Hospital Vicente Corral Moscoso, 2017[Internet]. Cuenca:Repositorio Institucional CUENCA;2018[citado 30/10/22]. Disponible en: https://dspace.ucuenca.edu.ec/handle/123456789/34441.
9- Martín I, Aguilera D, García A, Baquero F. Neumonías adquiridas en la comunidad por Staphylococcus aureus resistente a Meticilina en lactantes. Enferm Infecc Microbiol Clin[Internet]. 2019[citado 30/10/22];37(8):[aprox. 2p.]. Disponible en: https://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-articulo-neumonias-adquiridas-comunidad-por-staphylococcus-S0213005X18303768.
10- Wu X, Ye YZ, Wang CQ, Wang AM, He LY, Yu H, et al. A case report of hepatic abscesses with soft tissue infection caused by methicillin resistant Staphylococcus aureus in a young child. Medicine. 2017;96(50):e9260.
11- Hernández W, Padrón JE, Pérez A, González J, Riesgo L, Barrabí I, et al. Staphylococcus aureus resistente a Meticilina. Rev Cub Med Trop[Internet]. 2018[citado 30/10/22];70(2):[aprox. 8p.]. Disponible en: https://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0375-07602018000200011&lng=en&nrm=iso&tlng=es.
12- Martin BJ, Stephanie H, Muddassir R, Brent MI, Benjamin A, Peter B, et al. Successful embolization of an infected aneurysm of a subsegmental pulmonary artery in an infant with necrotizing MRSA pneumonia. Radiol Case Rep. 2019;14(9):1079-83.
13- Mantilla L, Buitrago E, Guerrero C, Navarroa YA, Alvarado JL. Infecciones por Staphylococcus aureus resistente a Meticilina en niños adquirida en la comunidad. Rev Univ Ind Santander Salud[Internet]. 2021[citado 30/10/22];53(1)[aprox. 2p.]. Disponible en: https://www.scielo.org.co/scielo.php?pid=S0121-08072021000100600&script=sci_abstract&tlng=es.
14- Alshengeti A, Alamri R, Tharwat R, Alahmadi H, Alawfi A, Arkoubi M, et al. An Unusual Presentation of Community-Acquired Methicillin-Resistant Staphylococcus aureus Infection in a Child Treated With Linezolid. Cureus. 2021;13(10):e18830.
15- Sartorio MU, Munari AM, Carlucci P, Erba P, Calcaterra V, Fabiano V, et al. MRSA Femoral Osteomyelitis from Superinfected Scabies Lesions: A Pediatric Case Report. Int J Environ Res Public Health. 2022;19(2):1007.
16- Canty E, Carnahan B, Curley T, Anususinha E, Hamdy RF, Ericson JE, et al. Reduced Vancomycin Susceptibility, MRSA and Treatment Failure in Pediatric Staphylococcus aureus Bloodstream Infections. Pediatr Infect Dis J. 2021;40(5):429-33.
17- Zhang T, Cheng H, Pan Z, Mi J, Dong Y, Zhang Y, et al. Desired vancomycin trough concentration to achieve an AUC0-24 /MIC ≥400 in Chinese children with complicated infectious diseases. Basic Clin Pharmacol Toxicol. 2019;126(1):75-85.
18- Struelens MJ. Rapid identification of methicillin-resistant Staphylococcus aureus (MRSA) and patient management. Clin Microbiol Infect. 2006;12(9):23-6.
19- Stein GE, Wells EM. The importance of tissue penetration in achieving successful antimicrobial treatment of nosocomial pneumonia and complicated skin and soft-tissue infections caused by methicillin-resistant Staphylococcus aureus: vancomycin and linezolid. Curr Med Res Opin. 2010;26(3):571-88.
20- Calderón J, Moral SF, Santiago AD. Protocolo para el manejo de las infecciones graves por Staphylococcus aureus. Med Prog Form Méd Cont Acredit. 2022;13(50):2937-44.
21- Esposito L, Veraldi S. Skin bacterial colonizations and superinfections in immunocompetent patients with scabies. Int J Dermatol. 2018;57(10):1218-20.
22- Herbert DA, Fogel DA, Rothman J, Wilson S, Simmons F, Ruskin J, et al. Pyogenic liver abscesses: successful non-surgical therapy. Lancet. 1982;1(8264):134-6.