INTRODUCCIÓN
El virus de inmunodeficiencia humana (VIH) está agrupado en el género de los Lentivirus, perteneciente a la familia de los Retrovirus, subfamilia orthoretroviridae. Se clasifica, además, en base a las características genéticas y diversos antígenos virales en HIV-1 y HIV-2. Los análisis filogenéticos y epidemiológicos muestran que tanto el VIH-1 como el VIH-2 evolucionaron a partir de virus de inmunodeficiencia de primates no humanos pertenecientes a zonas de África Central y Oriental respectivamente y en la población humana se introdujeron alrededor de 1920 a 1940.(1)
El virus ingresa al cuerpo a través de membranas mucosas intactas, piel o membranas lesionadas y por inoculación parenteral. Cuando la transmisión se produce por vía sexual, el virus se une primero a las células dendríticas o a los macrófagos/monocitos; posteriormente, al cabo de cinco a seis días ya se encuentran en ganglios linfáticos regionales y a los 10 a 14 días se diseminan por todo el cuerpo, inclusive a nivel del sistema nervioso.(2)
La respuesta inmune humoral se produce entre las tres y seis semanas luego del contagio, con síntomas similares a otras enfermedades virales como la mononucleosis (fiebre, agrandamiento de ganglios linfáticos, fatiga, síntomas gastrointestinales) que pueden durar de dos a seis semanas en la fase aguda seguida por una fase crónica asintomática que puede durar años. La neutropenia es común en la fase aguda.(1)
Pese a los esfuerzos por controlar y erradicar la enfermedad, la prevalencia de infección por el VIH continúa siendo uno de los problemas de salud de primera importancia a nivel mundial; es así que, para el 2017, según reportes del Programa Conjunto de las Naciones Unidas contra el Sida (UNAIDS, por sus siglas en inglés) existen cerca de 36 900 000 personas viviendo con VIH; 940 000 muertes relacionadas a la enfermedad y 1 800 000 nuevos casos de infección alrededor del mundo.(3)
En Ecuador, el Ministerio de Salud Pública (MSP) reportó en 2017 un total de 49 215 casos de VIH/sida desde 1984 hasta el 2016 de los cuales 37 748 casos fueron VIH y 11 793 casos fueron sida, además, se han registrado 17 574 fallecimientos por esta causa.(4)
Existen ciertas neoplasias cuya aparición se ha asociado directamente con el VIH; según el Centro de Control de Enfermedades de Estados Unidos (CDC) se considera al sarcoma de Kaposi, las lesiones cervicales premalignas, el linfoma de Burkitt, el linfoma largo difuso de células B, el linfoma plasmoblástico, el linfoma primario de SNC y, en especial, el linfoma no Hodgkin como las enfermedades más fuertemente asociadas a la inmunodepresión conferida por este virus, incluyéndose en la categoría de neoplasias definitorias de síndrome de inmunodeficiencia adquirida (sida).(5)
Según registros del CDC estadounidense, el sarcoma de Kaposi y el linfoma no Hodgkin contribuyeron a la mayoría de casos de neoplasias definitorias de VIH en la era previa a la terapia antiretroviral de gran actividad (TARGA). El tipo más común de linfoma no Hodgkin (LNH) en pacientes que viven con VIH fue el linfoma largo difuso de células B seguido por el linfoma primario del sistema nervioso central. Para estas personas el riesgo de desarrollar una de estas afecciones se incrementa 90 veces con respecto a aquellos sin tratamiento antirretroviral.(5)
En Ecuador, el registro de este tipo de neoplasias asociadas a VIH es limitado; sin embargo, es preciso mencionar que el linfoma no Hodgkin corresponde a la neoplasia no sólida que ocupa el primer lugar en incidencia en nuestro país con tendencia a seguir manteniendo un incremento proyectado del 3 % anual para el año 2030.
Los linfomas no Hodgkin corresponden a un grupo de desórdenes malignos que surgen a partir de las células del sistema inmune y se manifiestan predominantemente como linfadenopatías o tumores sólidos. Su clasificación es compleja y se encuentra en constante evolución con más de 50 subtipos listados por la Organización Mundial de la Salud (OMS).(6)
Los linfomas pueden desarrollarse a partir de las células T, aunque la gran mayoría de ellos derivan de las células B y están causados por diferentes alteraciones a nivel genético e incluso asociadas a infecciones virales como la infección por virus del Epstein Barr, H. pylori y virus de la hepatitis C.(7) La mayoría se presenta con linfadenopatía, esplenomegalia o crecimiento de alguna masa tumoral que cause sintomatología asociada a compresión; otro grupo de pacientes puede presentar los llamados síntomas “B” caracterizados por fiebre, sudoración y pérdida de peso progresiva.
Su diagnóstico se realiza a través de estudios de laboratorio e imagen que incrementan la sospecha clínica pero no son específicos, pudiendo mostrar citopenias aisladas o franca pancitopenia en caso de compromiso extenso de la médula ósea. La química sanguínea podrá mostrar afectación en las pruebas de función renal o hepática en caso de diseminación tumoral a estos órganos. La prueba de LDH (lactato deshidrogenasa) también puede mostrarse elevada; sin embargo, ninguno de estos parámetros son específicos para el diagnóstico.(6)
En cuanto al diagnóstico diferencial, es importante diferenciar desde el punto de vista clínico, si las adenopatías son únicas o múltiples, siempre tomando en cuenta la presencia de procesos infecciosos locales, enfermedades inflamatorias sistémicas.
El diagnóstico definitivo se realiza mediante biopsia por punción con aguja fina del nódulo afectado, puede también realizarse biopsia de médula ósea aunque es preferible la realización de un conteo sanguíneo completo previo con el fin de descartar LLC (leucemia linfocítica crónica), uno de los diagnósticos diferenciales más frecuentes. El tratamiento es individualizado y dependiente del estadio clínico de la enfermedad, siempre valorando la respuesta al tratamiento en relación con los criterios de respuesta de Lugano. En pacientes con intención curativa se puede realizar a través de seis a ocho ciclos de ciclofosfamida, doxorubicina, vincristina y prednisona (CHOP) en un intervalo de tres semanas de tratamiento o la utilización de R-CHOP con el uso de rituximab en dependencia del estadio de la enfermedad, sobre todo en etapas iniciales.(8,9)
Es importante mencionar que los linfomas no Hodgkin suelen asociarse a un profundo estado de inmunosupresión, por lo general en sujetos con conteo de linfocitos TCD4 menores a 200 células/uL y en aquellos con enfermedades definitorias de sida.(10)
En ciertas revisiones se menciona que el riesgo de padecer LNH en sujetos con tal inmunosupresión es de 100 a 200 veces mayor que en la población general.(11)Pese a la implementación de TARGA con mayor eficacia y adherencia en los PPV en las últimas décadas condicionaría a una disminución de la incidencia de ciertas neoplasias como la mencionada en este caso, la información actual no es del todo contundente en aseverar esta hipótesis.(10,12)Al reducir la carga viral e incrementar el recuento linfocitario mediante el uso de TARGA sería esperable una disminución en la incidencia no solo de procesos infecciosos y comorbilidades vinculadas al VIH, sino también de las neoplasias definitorias del virus. Se cuenta con escasos datos en la literatura sobre la aparición del linfoma no Hodgkin en pacientes con adecuado control de la enfermedad y sobre todo en aquellos en los que luego de muchos años de mostrar controles sin carga viral detectada desarrollan este tipo de neoplasias, algo que no resulta frecuente.(13)
Llama sumamente la atención la presencia de este tipo de neoplasia luego de 20 años de diagnosticado el VIH y sobre todo luego de más de diez años de adecuados controles y sin cargas virales detectadas, lo cual ameritó la publicación de este caso.
PRESENTACIÒN DEL CASO
Paciente femenina de 58 años de edad, nacida en Manta y residente en Quito, sin hábitos nocivos, no alergias reportadas, diagnosticada de infección por virus de inmunodeficiencia humana en el año 2000, y que en el momento de acudir a consulta se encontraba en estadio B3.
Permaneció en controles periódicos en el Hospital Enrique Garcés; a lo largo de su historial clínico recibió varios esquemas antiretrovirales acordes a las guías de tratamiento de la época. Durante el curso de su enfermedad presentó una respuesta clínica adecuada sin infecciones oportunistas; su respuesta inmunológica fue aceptable, sin embargo sus conteos de linfocitos CD4 durante los últimos cinco años no llegaron a ser mayores de 400 células en varias muestras. Cabe destacar que en los últimos diez años no presentó carga viral detectada, es así que de forma general tuvo un adecuado control de la enfermedad.
Presentó, además, varias comorbilidades asociadas como dislipidemia, hipotiroidismo y osteoporosis que recibieron adecuado control y tratamiento. Su cuadro clínico comenzó en mayo del 2018, al presentar un dolor continuo (EVA 4/10) de localizado en región lumbar derecho, que fue atribuido al exceso de trabajo y esfuerzo físico y para lo cual recibió tratamiento analgésico con alivio esporádico de la sintomatología. La situación se incrementó en octubre del 2018, con aumento del dolor a 8/10 acompañado de parestesias, debilidad del miembro inferior derecho y dificultad para la deambulación por lo que acudió a casa de salud donde se le realizaron sus controles habituales y se decidió su ingreso.
Los hallazgos destacables al examen físico evidenciaron una adenopatía de 2,5 x 2,5 cm a nivel de región inguinal derecha, móvil, de consistencia firme, bordes suaves, no adherida a planos profundos, no dolorosa a la palpación. Al examen motor llamó la atención la disminución marcada de la fuerza en miembro inferior derecho así como disminución de la sensibilidad a nivel crural del mismo lado y disestesias en S1, S2, y S3, además de marcha disbásica relacionada al dolor.
Debido al cuadro clínico presentado fue evidente sospechar una enfermedad compresiva espinal; sin embargo, al tratarse de una paciente portadora de VIH, se consideró un contexto más amplio en cuanto al abordaje diagnóstico. Se tomó al dolor lumbar junto con la presencia de un ganglio de características y tamaño anómalos como los problemas principales a analizar.
Es preciso mencionar que a su ingreso no presentó fiebre, sudoración nocturna, tos, pérdida de peso u otro tipo de sintomatología constitucional, los signos vitales se encontraron dentro de parámetros normales, tórax con expansión adecuada, corazón y pulmones sin afección aparente, no vìsceromegalias y tampoco alteraciones a nivel ginecológico.
Teniendo en cuenta la presencia de estos problemas, se tomaron en cuenta factores como la edad y comorbilidades subyacentes, sin descartar como hipótesis diagnósticas principales la presencia de una hernia discal, enfermedades infecciosas como tuberculosis lumbar, neoplasias relacionadas y no relacionadas a VIH y enfermedades del metabolismo óseo que expliquen los problemas encontrados.
La biometría hemática inicial no reveló citopenias, la fosfatasa alcalina se encontró dentro de parámetros normales así como la VSG y el calcio sérico. Tomando en cuenta, además, la presencia de adenopatías clínicamente significativas a nivel inguinal se realizaron estudios para la determinación de enfermedades asociadas frecuentemente a VIH, pero, las pruebas de hepatitis B y C, CMV, Epstein Barr, VDRL, Toxoplasma IgG- IgM fueron negativas.
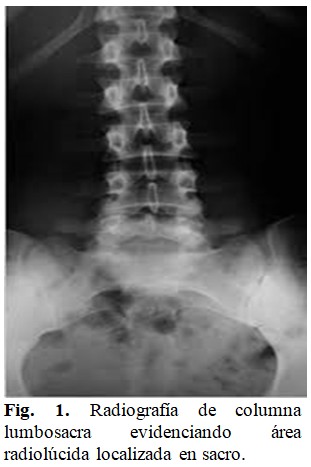
Se realizó rayos X de columna lumbosacra evidenciando área radiolúcida localizada en sacro. (Fig. 1).
Este estudio se complementó con RMN de columna, pelvis y caderas mediante la que se reportaron lesiones nodulares captantes de contraste a nivel de la base de la apófisis transversa izquierda de T9 y derecha de T11, altamente sugestivas de implantes secundarios; a nivel lumbo-sacro implantes secundarios de primario a determinar a nivel de esqueleto axial y apendicular proximal con afectación ganglionar retroperitoneal. Otro de los hallazgos muy llamativos fue la presencia de una gran masa que comprometía el sacro en especial al lado derecho y que se extendía por el agujero ciático descendiendo hacia la región glútea acompañada de adenomegalias iliacas externas. A nivel L5-S1 se hizo evidente stop de conducto medular con infiltración de tumor hacia filum terminal.
Con estos hallazgos se catalogó como una radiculopatía por compresión extrínseca. En los estudios de imagen ampliamente se sospecha de una causa tumoral por lo que se solicitó estudios que descartaran tuberculosis ósea, para este efecto se realizaron tanto lipoarabinomanano en orina y quantiferon, los cuales fueron negativos. Cabe recalcar que al momento de presentar estos hallazgos la paciente presentó un control que no reportó carga viral y CD4 mayor a 300 células.
El siguiente paso realizado fue la obtención de una biopsia de ganglio inguinal derecho que reportó inicialmente una neoplasia maligna indiferenciada, infiltrativa, constituida por células de núcleos pleomorfos. En la inmunohistoquímica los siguientes marcadores tumorales resultaron positivos: CD45, CD20, CD68, por lo que se definió como un linfoma no Hodgkin difuso de células grandes e inmunofenotipo B con un KI 67(índice de proliferación celular) del 60 %.
Con el diagnóstico tumoral, se realizó un escaneo tomográfico completo para estadiaje, en el que fueron encontrados hallazgos muy marcados, con adenomegalias y conglomerados adenomegálicos metastásicos para-aórtico-cava e inter-aórticos-cava en retroperitoneo inferior que se extienden hasta la bifurcación ilíaca y conglomerados adenomegálicos metastásicos ilíacos externos. En la TAC de pelvis, además, se encontró extensa osteólisis agresiva con una masa sólida concomitante que en conjunto fue de aproximadamente 8,5 x 7 cm de diámetros mayores infiltrando el músculo glúteo mayor, piriforme, espinoso, y articulación sacro ilíaca ipsilaterales.
Posterior a los hallazgos descritos el siguiente paso realizado fue la estatificación de la enfermedad neoplásica, dada la infiltración a medula ósea reportada en los estudios anteriores, por lo que fue catalogado como estadio clínico IV metastásico, según la clasificación de Ann Arbor.
Su evolución durante y posterior al diagnóstico oncológico fue tórpida, luego de las valoraciones preliminares fue referida a un hospital oncológico de tercer nivel de atención en el cual se le brindó manejo de soporte y dirigido al dolor oncológico; sin embargo, fue agravando su cuadro con infecciones del tracto urinario a repetición que llevaron a lesión renal aguda y consecuentemente trastornos hidroelectrolíticos frecuentes. Finalmente, desarrolló una cuadro de neumonía intrahospitalaria asociada a gérmenes atípicos sobre base de una neutropenia profunda relacionada con su cuadro neoplásico, lo que ocasionó su deceso.
DISCUSIÓN
En el caso descrito se muestra una presentación poco habitual de una enfermedad oncohematológica como es el linfoma no Hodgkin. Si bien es cierto que su presentación en el contexto del VIH es definitoria de sida, su aparición en una paciente portadora del virus que ha llevado controles adecuados y sin carga viral detectada por varios años, es poco habitual e infrecuente.
El abordaje diagnóstico fue adecuado; sin embargo, inicialmente, como se muestra en el caso en cuestión, la sospecha clínica fue dirigida hacia una afección discal debido a la presencia de dolor, impotencia funcional de extremidades y parestesias a ese nivel, por lo que investigar las casusas más frecuentes de esta presentación sindrómica fue oportuno.
Posteriormente, la realización de estudios de imagen es lo indicado para la estatificación de la neoplasia, teniendo en cuenta que en el caso del linfoma no Hodgkin la sensibilidad para la determinación de infiltración ósea o en médula ósea de la PET/Tc es elevada, manifestándose como un aumento de captación focal de FDG o como un aumento difuso con alteraciones focales de captación tal como lo indica Tamayo et. al(14) en su estudio sobre la utilidad de este método diagnóstico en el manejo clínico de linfomas.
Los datos bibliográficos en relación con la presentación del linfoma no Hodgkin en pacientes portadores de VIH son escasos, sobre todo cuando se presenta en pacientes que se consideran dentro de un régimen de terapia antiretroviral adecuado, sin recaídas de ninguna clase por más de cinco años; lo anterior muestra que es necesario este tipo de reportes los cuales permiten considerar del desarrollo de diversos tipos de enfermedades neoplásicas asociadas al VIH, independientemente del control de la enfermedad de cada paciente, por lo que su manejo y estudio deben ser individualizados.
Existe información limitada que describa la aparición de este tipo de neoplasias en pacientes que no presentan cargas virales detectadas como es el caso de nuestra paciente, en este sentido existen varios reportes bibliográficos que mencionan aun datos debatibles entre el efecto de la terapia antiretroviral y la incidencia de la mortalidad del LNH asociado al sida.(8)
Si bien es cierto, las personas afectadas por el virus de inmunodeficiencia humana tienen más probabilidad alrededor del mundo de presentar enfermedades neoplásicas con el consiguiente aumento de la morbimortalidad que ello implica en relación a los pacientes sin dicho antecedente, no es del todo común que se desarrolle un linfoma en un paciente con adecuado control de su enfermedad infecciosa de base y sin detección de carga viral por largo tiempo.
En este sentido, resulta entendible que el diagnóstico diferencial inicial no se enfocara específicamente en una enfermedad tumoral de inicio, basándose en la clínica de la paciente de dolor lumbar y parestesias de miembro inferior compatible con un cuadro compresivo medular, una de las primeras opciones en este caso fue sospechar en un proceso herniario a nivel discal.
Sin embargo, el abordaje realizado fue correcto, con estudios iniciales por imagen que determinaron un proceso ocupativo a nivel medular del que, por supuesto, se continuó el estudio correspondiente; una vez descartado un proceso herniario, el siguiente paso en cuanto al proceso diagnóstico fue la investigación de un proceso tumoral primario o secundario a otra localización.
Específicamente el linfoma no Hodgkin representa la mayor causa de mortalidad asociada a cáncer relacionado al VIH; sin embargo, desde la introducción de la terapia antiretroviral combinada la supervivencia de los pacientes con VIH se incrementó considerablemente.(8)
En el contexto del VIH es importante mantener una conducta siempre de alerta en el manejo del paciente. Pese a las pruebas de laboratorio, que en muchos de los casos son definitorias y sirven de guía estricta en el manejo de ciertas afecciones, el criterio clínico prevalece en la mayoría de estos.
La posibilidad del desarrollo de neoplasias definitorias de sida en pacientes con adecuado control clínico, virológico y farmacológico siempre está presente, pese a que no es común. Se requiere de más estudios con el fin de determinar de forma más objetiva el impacto y la incidencia de estas complicaciones en pacientes portadores de VIH.
Conflicto de intereses
Los autores plantean que no poseen conflicto de intereses.
Contribuciones de los autores
Conceptualización de ideas: Edwin Marcelo Miranda Solís, Juan Fernando Orozco Herrera.
Visualización: Edwin Marcelo Miranda Solís, Juan Fernando Orozco Herrera.
Redacción del manuscrito original: Edwin Marcelo Miranda Solís, Juan Fernando Orozco Herrera.
Redacción, revisión y edición: Edwin Marcelo Miranda Solís, Juan Fernando Orozco Herrera.
Financiación
Sin financiamiento externo.
REFERENCIAS BIBLIOGRÁFICAS
1.Seitz R. Human Immunodeficiency Virus (HIV). Transfus Med Hemotherapy. 2016;43(3):203-22.
2.Krishnan A, Zaia JA. HIV-associated non- Hodgkin lymphoma: Viral origins and therapeutic options. Hematology. 2014;2014(1):584–9.
3.Qiao Y, Xu Y, Jiang D, Wang X, Wang F, Yang J, et al. Epidemiological analyses of regional and age differences of HIV/AIDS prevalence in China, 2004–2016. Int J Infect Dis. 2019;81:215-20.
4.Terán R, Araujo V, Celi A, Gómez A, Cevallos N, Suaste K, et al. Prevención, diagnóstico y tratamiento de la infección por el virus de inmunodeficiencia humana (VIH) en adolescentes y adultos. Guía práctica Clínica[Internet]. Quito: Ministerio de Salud Pública del Ecuador; 2019[citado 23/12/2022]. Disponible en:
https://www.salud.gob.ec/wp-content/uploads/2019/06/gpc_VIH_acuerdo_minis terial05-07-2019.pdf
5.Ji Y, Lu H. Malignancies in HIV-Infected and AIDS Patients. Advances in Experimental Medicine and Biology. 2017;1018:167-79.
6.Bowzyk Al-Naeeb A, Ajithkumar T, Behan S, Hodson DJ. Non-Hodgkin lymphoma. BMJ. 2018;362:1-7.
7.Rodríguez-Muñoz J, Moreno S. Strategies for the cure of HIV infection. Enferm Infecc Microbiol Clin. 2019;37(4):265–73.
8.Bigger E, Abramson JS, Sohani AR, Zola M, Kayembe MKA, Medhin H, et al. Impact of HIV infection on the clinical presentation and survival of non-Hodgkin lymphoma: A prospective observational study from Botswana. J Glob Oncol. 2018;2018(4):24-9.
9.Miralles P, Navarro JT, Berenguer J, Gómez Codina J, Kwon M, Serrano D, et al. GESIDA/PETHEMA recommendations on the diagnosis and treatment of lymphomas in patients infected by the human immunodeficiency virus. Med Clin (Barc)[Internet]. 2018[citado 23/12/2022];151(1):39.e1- 39.e17. Disponible en: http://dx.doi.org/10.1016/j.medcli.2017.11.037
10.Corti M, Villafane M. Linfomas No Hodgkin asociados al SIDA. Sah. 2013;17(2):153– 8.
11.Abbar B, Veyri M, Solas C, Poizot-Martin I, Spano JP. HIV and cancer: Update 2020. Bull Cancer[Internet]. 2020[citado 23/12/2022];107(1):21–9. Disponible en: https://doi.org/10.1016/j.bulcan.2020.01.001
12.Gobert A, Veyri M, Poizot-Martin I, Lavolé A, Solas C, Paliche R, et al. Cancer et VIH : actualités 2017. Bull Cancer[Internet]. 2018;105(3):256–62. Disponible en: https://doi.org/10.1016/j.bulcan.2018.02.002
13.Vachiat A, McCutcheon K, Tsabedze N, Zachariah D, Manga P. HIV and Ischemic Heart Disease. J Am Coll Cardiol. 2017;69(1):73–82.
14.Tamayo P, Martín A, Díaz L, Cabrero M, García R, García-Talavera P, et al. 18F-FDG PET/CT in the clinical management of patients with lymphoma. Rev Esp Med Nucl Imagen Mol[Internet]. 2017[citado 23/12/2022];36(5):312–21. Disponible en: http://dx.doi.org/10.1016/j.remn.2017.03.004