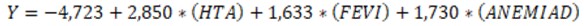INTRODUCCIÓN
La toxicidad asociada al tratamiento de quimioterapia y radioterapia eleva la morbilidad, y en consecuencia, la mortalidad en pacientes oncológicos. Este es un fenómeno continuo con inicio desde el comienzo del tratamiento mismo. La toxicidad muestra comportamiento agudo y crónico, con expresión clínica dependiente de factores celulares, tisulares, ambientales e intrínsecos de cada individuo.(1, 2)
Los tumores son ecosistemas complejos que evolucionan en respuesta a perturbaciones intrínsecas, extrínsecas y la expresión génica está regulada por ambos. Los mecanismos extrínsecos se originan de microambientes desiguales, mientras los intrínsecos incluyen la variabilidad de célula a célula en las alteraciones genotípicas y las variaciones no genéticas o fenotípicas, dadas por la modificación epigenética, la expresión génica plástica y la transducción de señales. Entonces los factores intrínsecos y extrínsecos generan heterogeneidad intratumoral.(3, 4)
En un estudio que incluyó a 110 pacientes con cáncer de mama, tratadas con docetaxel, epirrubicina y ciclofosfamida, completando seis ciclos de quimioterapia, se reportaron náuseas, disgeusia, neuropatía periférica, pérdida de apetito, mialgia y edema periférico, todos los efectos tóxicos con repercusión sobre la calidad de vida. Hasta el 56,7 % de las pacientes requirieron ingreso por las toxicidades sufridas durante el primer ciclo.(5)
Banfill y colaboradores,(6) en una revisión de la toxicidad cardiaca por radioterapia toráxica, informaron del daño con insuficiencia cardiaca congestiva inducida por radiación, infarto del miocardio y daño valvular. De forma menos frecuente describen: pericarditis con y sin derrame, dolor toráxico cardiogénico y arritmias por afectación al sistema de conducción. Mientras Kopčalić y colaboradores(7) abordaron la toxicidad generada por la radioterapia en pacientes con cáncer de próstata, con aumento estadísticamente significativo (p< 0,001) en los grados de toxicidad aguda genitourinaria y gastrointestinal a lo largo del tiempo.
Por tanto, la evaluación integral preoperatoria del paciente oncológico con tratamiento de quimioterapia y radioterapia neoadyuvante tiene como objetivo predecir la toxicidad. En consonancia con lo anterior, el objetivo del presente estudio es diseñar un modelo predictivo de toxicidad de la quimioterapia y radioterapia en el paciente oncológico quirúrgico.
MÉTODOS
Se realizó un estudio observacional analítico, de casos y controles, en los pacientes oncológicos quirúrgicos que cumplieron los criterios de inclusión para la predicción de toxicidad preoperatoria, en el periodo de enero a diciembre de 2022, en el Hospital Provincial Docente Oncológico María Curie, de Camagüey. Un total de 408 pacientes cumplieron con los criterios de inclusión (paciente oncológico quirúrgico electivo de 20 a 65 años, paciente con quimioterapia y radioterapia neoadyuvante) y exclusión (embarazada, puérpera, historia clínica incompleta), de ellos, 238 sin toxicidad y 170 con toxicidad.
La muestra fue seleccionada de forma aleatoria mediante el paquete estadístico Statistical Package for the Social Sciences (SPSS) versión 25.0 con error aceptable y valor de confianza del 95 %. Esta quedó constituida por el 80 % del universo, 334 pacientes, de ellos, 197 sin toxicidad (grupo control) y 137 con toxicidad (grupo de estudio).
Las variables del estudio fueron dicotomizadas, a excepción de la edad, tratada como variable Dummy: toxicidad (si, no); edad (grupos etarios: 20-35 años, 36-50, 51-65); sexo (masculino, femenino); índice de masa corporal (IMC): obesidad- IMC≥30, no obesidad- IMC<30); hipertensión arterial (si, no); diabetes mellitus (si, no); enfermedad cerebrovascular (si, no); enfermedad pulmonar (si, no); dislipidemia (si, no); enfermedad renal (si, no); anemia (si, no); acoholismo (si, no); Eastern Cooperative Oncology Group (ECOG):(8) ECOG≤2, ECOG≥3; y fracción de eyección del ventrículo izquierdo (FEVI): FEVI<50, FEVI≥50; procesamiento de la información y análisis estadístico.
Se confeccionó la base de datos con la información recolectada, la cual se procesó de forma automatizada con el paquete estadístico SPSS 25.0. Para el diseño del modelo predictivo, se realizó estimación de factores de riesgo y predictores de toxicidad mediante regresión logística binaria, con el método Wald hacia delante y cargando de 10 a 15 posibles factores.
Se seleccionó el modelo de mejor ajuste: menor número de variables en la ecuación, especificidad y sensibilidad. Se realizó la curva Receiver Operating Characteristic (ROC) y se calculó del área bajo la curva.
La investigación fue sometida a consideración y aprobada por el Consejo Científico y el Comité de Ética de la investigación del Hospital Provincial Docente de Oncología María Curie. Se tuvo en cuenta la adherencia a Convenios Internacionales sobre principios éticos de las investigaciones en seres humanos, se respetaron los principios promulgados en la Declaración de Helsinki.
RESULTADOS
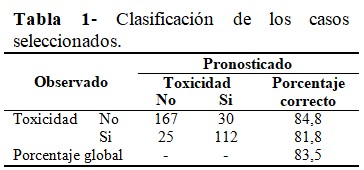
La clasificación de los casos seleccionados de la variable toxicidad acorde a lo observado y lo pronosticado mostró que el modelo, en el paso tres, predice un porcentaje global de 83,5 % con respecto a los valores observados. La sensibilidad fue de 81,8 (verdaderos positivos) y la especificidad de 84,8 (verdaderos negativos). En conclusión, el modelo presentó buen poder discriminativo. (Tabla 1).
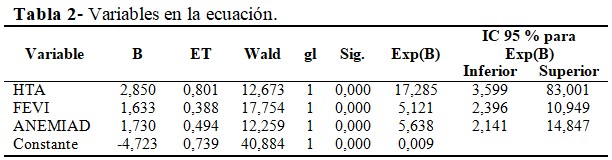
Al analizar las variables (hipertensión arterial (HTA), FEVI, anemia (ANEMIAD) y el valor de la constante) en la ecuación en el paso tres, se observó que un paciente oncológico quirúrgico con hipertensión arterial tendrá aproximadamente 17 veces, Exp (B)=17,285 más probabilidad de desarrollar toxicidad por quimioterapia y radioterapia que uno sin hipertensión, si se mantienen constantes el resto de las variables. (Tabla 2).
A partir de los coeficientes de regresión (B) obtenidos se construyó la ecuación de regresión logística para predecir toxicidad en el paciente oncológico quirúrgico (Y).
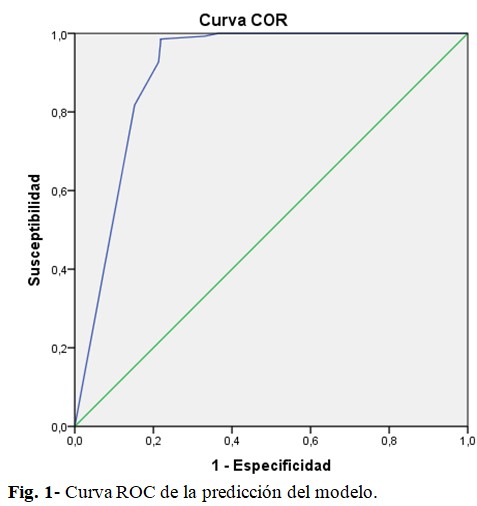
La comparación de la predicción con la realidad, mediante curva ROC determinó un área bajo la curva de 0,901 IC 0,867-0,935, o dicho de otro modo, del 90 %, es decir, el modelo resultó satisfactorio en su capacidad de predecir toxicidad en el paciente oncológico quirúrgico. (Fig. 1).
DISCUSIÓN
La toxicidad se define como “cualquier efecto adverso con atribución posible, probable o definitiva al tratamiento”.(9) Las toxicidades relacionadas con el tratamiento del cáncer se categorizan según el órgano o sistema afecto. Se describen la toxicidad hematológica, cardiotoxicidad, hepatotoxicidad y nefrotoxicidad de forma frecuente, aunque cualquier tejido es susceptible a daño.(10)
Cuando la toxicidad presenta un grado ≥3, acorde a CTCv5 (Common Toxicity Criteria for Adverse Events - version 5), se considera grave, lo que condiciona retraso o anulación de tratamientos, ajuste de dosis o de secuencia de tratamientos. Con impacto en la calidad de vida de los pacientes y riesgo preoperatorio elevado.
En un estudio longitudinal de cohorte realizado en 224 pacientes con cáncer de mama en tratamiento con quimioterapia y seguidas en consulta de cardio-oncología, se estudiaron los factores de riesgo de cardiotoxicidad precoz. El diagnóstico de falla cardiaca por cardiotoxicidad se basó en la FEVI, siendo positiva una disminución de al menos el 5 % en la FEVI con valores menores al 55 % y signos o síntomas de falla cardiaca o una disminución de al menos el 10 % en esta con valores menores del 55 % y sin la presencia de signos o síntomas. Entre los factores de riesgo que se asociaron, se hallaron: HTA con riesgo relativo (RR) de 2,7 IC 1,2-5,8, dislipidemia RR 3,9 IC 1,9-7,9 y obesidad RR 2,1 IC 1,1-4,1. En el modelo de regresión logística, los predictores seleccionados por el método Wald hacia delante fueron: HTA, hipertrofia ventricular izquierda, diabetes mellitus, edad de 65 años y más y dislipidemia. El estudio sugiere el probable beneficio de la medicación cardioprotectora.(11)
Por su parte, Roncancio y colaboradores(12) señalaron la ausencia de escalas que valoren de forma conjunta el riesgo cardiovascular y de cardiotoxicidad en pacientes con cáncer, con subestimación del riesgo real. Entonces se hace necesaria una adecuada valoración clínica previa a la quimioterapia, que combine biomarcadores, electrocardiograma y ecocardiograma, en la búsqueda de compromiso subclínico de la función ventricular.
En una revisión sistemática de HTA y neoplasias mieloproliferativas, Găman y colaboradores(13) hallaron que la HTA resulta la comorbilidad más frecuente asociada a este tipo de cáncer: 57 % de los casos en Estados Unidos y hasta el 72 % si son veteranos; 63 % en Italia y cerca del 90 % en Paquistán. Además, señalan el riesgo de complicaciones trombóticas, hemorrágicas y el daño en órganos diana. Mención aparte recibió la hipertensión inducida por fármacos, entidad infradiagnosticada con frecuencias entre el 1 al 12 %.
Por su parte, Abdel-Razeq y colaboradores(14) plantean que la anemia es frecuente en pacientes con régimen de quimioterapia y radioterapia; citan a la Encuesta Europea de Anemia por Cáncer (ECAS) que encontró un 39 % de pacientes con anemia. Por ende, constituye un predictor confiable de toxicidad de la médula ósea (mielotoxicidad), dada su frecuencia elevada y fácil diagnóstico por el método clínico, apoyados con la determinación de hemoglobina, hierro sérico y lámina periférica.
La gravedad ocasionada por los efectos de la administración de quimioterápicos y radioterapia depende de las características del paciente, tipo de enfermedad tumoral, estadio, estado general, enfermedades asociadas; por consiguiente, es indudable la necesidad del abordaje integral de las toxicidades en el paciente oncológico quirúrgico.
Se obtuvo una función de regresión logística que permitió la estimación de la probabilidad de toxicidad en pacientes oncológicos quirúrgicos electivos, lo cual proporcionó una herramienta para su predicción desde el preoperatorio.
Conflictos de intereses:
Los autores declaran que no tienen conflictos de intereses con respecto a la investigación.
Contribución de autores:
Conceptualización: Juan Carlos Arranz Pozo, Zaily Fuentes Díaz
Curación de datos: Juan Carlos Arranz Pozo, Zaily Fuentes Díaz, Orlando Rodríguez Salazar
Análisis formal: Zaily Fuentes Díaz, Orlando Rodríguez Salazar, Tania Puerto Pérez
Investigación: Zaily Fuentes Díaz, Migdolis Savigne Daudinot
Metodología: Juan Carlos Arranz Pozo, Zaily Fuentes Díaz, Orlando Rodríguez Salazar
Administración del proyecto: Zaily Fuentes Díaz
Validación: Zaily Fuentes Díaz, Tania Puerto Pérez
Visualización: Orlando Rodríguez Salazar
Redacción – borrador original: Juan Carlos Arranz Pozo, Zaily Fuentes Díaz
Redacción – revisión y edición: Juan Carlos Arranz Pozo, Zaily Fuentes Díaz, Migdolis Savigne Daudinot, Orlando Rodríguez Salazar, Tania Puerto Pérez
Financiación:
Hospital Provincial Docente Oncológico María Curie. Camagüey, Cuba