INTRODUCCIÓN
La enfermedad cerebrovascular isquémica (ECVI) no solo es causa de discapacidad motora, sino también muestra secuelas no motoras como la depresión. De hecho, la depresión posterior al ictus (DPI) es el principal factor de mal pronóstico durante la recuperación funcional por dicha afección. Esta se asocia con la afectación cognitiva, deterioro en las actividades de la vida diaria, peor calidad de vida y mayor mortalidad.(1) Además, afecta alrededor de un tercio de los sobrevivientes de accidentes cerebrovasculares. Su frecuencia durante el primer año oscila entre un 28 % y 43 %; y disminuye ligeramente después de este período de tiempo. Sin embargo, se conoce poco si es diferente en aquellos pacientes con historia previa de depresión.(2)
La tendencia a subestimar la presencia de DPI en la comunidad se puede atribuir al uso de un solo instrumento de detección, lo que disminuye la especificidad del diagnóstico.(3)
Durante la ECVI aguda y no aguda hay liberación de moléculas al torrente sanguíneo debido al daño y recuperación del tejido cerebral, respectivamente. Algunas son específicas del sistema nervioso central (enolasa neuronal, proteína S 100 B dependiente de calcio, proteína acídica glial fibrilar) y otras tienen actividad inespecífica para este tejido (proteína C reactiva, interleuquinas, albúmina, copeptina, dímero D, metaloproteinasa de la matriz-9, apolipoproteínas); las cuales han sido empleadas como marcadores para el diagnóstico y pronóstico de esta enfermedad.(4,5) También en los síntomas depresivos por eventos cerebrovasculares participan mecanismos neuroendocrinos e inmunológicos o inflamatorios, en los que quizás se liberan algunas de estas moléculas.(6)
Aunque los estudios acerca de la asociación de síntomas depresivos con la liberación de sustancias han avanzado de manera significativa(4,7) y no escasean herramientas neuropsicológicas para medir la depresión; estos no son concluyentes en cuanto a la forma específica del uso de determinada escala neuropsicológica en asociación con los niveles de biomarcadores hemoquímicos en la enfermedad cerebrovascular isquémica.
Por esta razón el objetivo de este trabajo es evaluar la asociación de marcadores inflamatorios y de disfunción endotelial con la depresión de pacientes con ECVI.
MÉTODOS
El diseño del estudio fue observacional, analítico, prospectivo, de corte transversal en pacientes con diagnóstico confirmado de ECVI en fase aguda y no aguda, atendidos en consulta externa y en las salas de ictus del Instituto de Neurología y Neurocirugía (INN) y del Hospital Comandante Manuel Fajardo, del año 2017 al 2019.
La muestra de pacientes, seleccionada por muestreo aleatorio simple, incluyó individuos adultos, de uno y otro sexo y cualquier color de la piel. Se formaron dos grupos de pacientes con ECVI en fase aguda (primeros 7 días del inicio de los síntomas de isquemia cerebral) y ECVI en fase no aguda (≥30 días-3 años).
Además, los pacientes cumplieron con los siguientes criterios inclusión: tener habilidades comunicativas conservadas para la evaluación neuropsicológica y estudios hemoquímicos y de orina completos. Se excluyeron: individuos con enfermedad cerebrovascular hemorrágica o hemorragia intracerebral por metástasis, tumor cerebral o aneurisma y con enfermedades neoplásicas, inflamatorias, colagenopatías, entre otras.
Los pacientes fueron examinados y entrevistados previamente por un especialista en Neurología. Se recogieron informaciones de variables demográficas (edad, sexo, color de la piel) y factores de riesgo. Para la confirmación imagenológica se realizó una tomografía axial computarizada de cráneo simple (TAC simple) o una resonancia magnética cerebral. La clasificación etiológica del tipo de ictus isquémico se realizó a través de la escala neurológica Trial of ORG-10172 in Stroke Treatment (TOAST) (aterotrombótica, cardioembólico, lacunar, inhabitual e indeterminado) y la localización del infarto mediante la escala Oxfordshire Community Stroke Project (infarto total, parcial y lacunar de circulación anterior, e infarto total de circulación posterior).
La severidad neurológica del evento isquémico se determinó a través de la aplicación de la National Institute of Health Stroke scale (NIHSS, por sus siglas en inglés,), la que se evalúa con una puntuación 0-42. Para evaluar la discapacidad para las actividades de la vida diaria se utilizó el índice de Barthel (0-100 puntos).
Para medir grado de depresión se aplicaron, a cada paciente, las siguientes escalas: inventario de Beck (ninguna: 0-10; leve: 11-18; moderada: 19-25 y grave: >26 puntos) y el test de Hamilton (no deprimido: 0-7, ligera/menor: 8-13, moderada: 14-18, severa: 19-22, muy severa: ≥23 puntos).
Se determinaron las concentraciones sanguíneas de marcadores inflamatorios [proteína C-reactiva (PCR), alfa-1-antitripsina (AAT), complemento C3 y complemento C4] y de disfunción endotelial (microalbuminuria),(8) para el cual se extrajo una muestra de sangre venosa periférica (10 mL) bajo condiciones de ayuno y aproximadamente 5 mL de la primera micción de la mañana, respectivamente. Las muestras de sangre se distribuyeron en tubos secos que se centrifugaron a 2000 rpm durante 10 minutos para la obtención del suero y se conservaron a -20oC por no más de 30 días hasta su procesamiento. Las de orina de centrifugaron a 2000 rpm y también se guardaron a temperatura de -20oC por no más de 30 días hasta su procesamiento.
Se determinó la normalidad de las variables con la prueba de Kolmogorov–Smirnov. Para variables cualitativas se aplicó la prueba de c2 y para las continuas student 's o prueba no paramétrica de Mann–Whitney según la normalidad de la variable. Las correlaciones se calcularon mediante el coeficiente de Spearman. Los cálculos estadísticos se realizaron en el programa STATISTICA 10.0 para Windows (StatSoftInc, 2000). El nivel de significación estadística aceptada fue de p<0,05.
El proyecto fue elaborado atendiendo a los acuerdos de: Declaración de Helsinki de la Asociación Médica Mundial (Wma) (2013) con la previa aprobación del consejo científico del INN. Además, todos los participantes firmaron y recibieron una copia del consentimiento. Los resultados y las fuentes de obtención de los datos fueron manejados de manera discreta teniendo en cuenta los principios éticos de confidencialidad y privacidad.
RESULTADOS
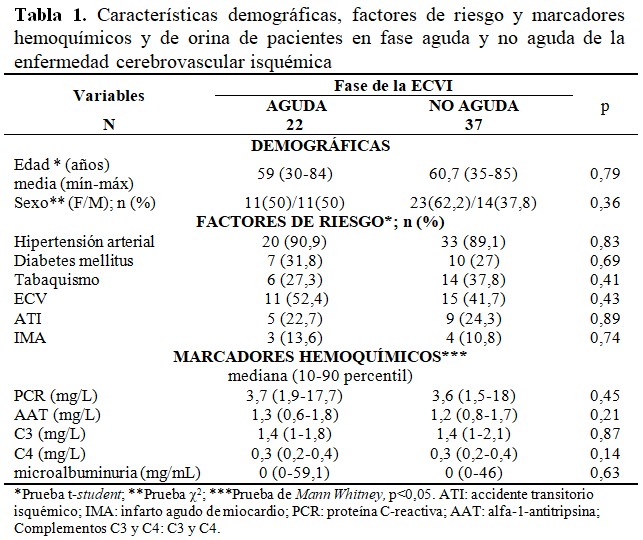
Las variables demográficas no mostraron diferencias significativas entre los grupos de estudio. Tampoco se encontraron diferencias estadísticas para los factores de riesgo. La HTA fue el principal factor. Las concentraciones de las proteínas inflamatorias y de disfunción endotelial no tuvieron diferencias estadísticas entre los grupos de pacientes con ECVI en fase aguda y no aguda. (Tabla 1).
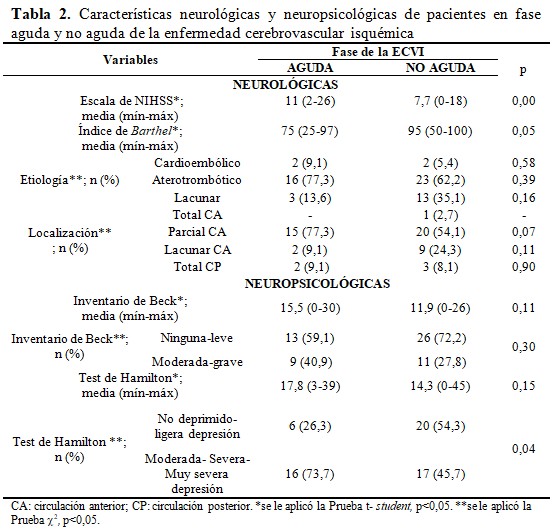
La escala del NIHSS fue superior estadísticamente en los pacientes de la fase aguda del ictus respecto a la no aguda. Sin embargo, la discapacidad para las actividades de la vida diaria no tuvo significación comparando ambos grupos de individuos. La etiología y localización de ictus fue con mayor frecuencia aterotrombótica y parcial de circulación anterior, respectivamente; pero sin cambios estadísticos. Las puntuaciones de las pruebas neuropsicológicas no mostraron diferencias estadísticas entre las dos fases del ictus. De acuerdo al inventario de Beck, los pacientes en la fase aguda de la ECVI tuvieron con mayor frecuencia un grado de depresión leve (31,8 %). Sin embargo, en la fase no aguda, la frecuencia más alta de los pacientes no tuvo depresión (40,5 %). Mientras que, con el test de Hamilton, los individuos en fase aguda de la ECVI tenían en mayor porcentaje depresión moderada (27,3 %), a diferencia de los que estaban en fase no aguda que no presentaban depresión. (Tabla 2).
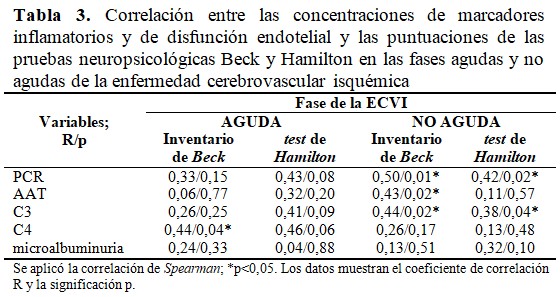
En la fase aguda de ictus se halló una correlación directa y significativa entre la concentración de complemento C4 de estos pacientes y la puntuación del inventario de Beck. Mientras que en la fase no aguda de la ECVI resultó significativa la asociación de la PCR, AAT y complemento C3 con el inventario de Beck. A su vez, en esta fase el complemento C3 se relacionó estadísticamente con el test de Hamilton. (Tabla 3).
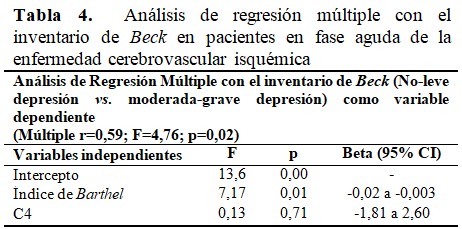
Las concentraciones del complemento C4 no se relacionaron de manera independiente con el grado de depresión, evaluado mediante el inventario de Beck, aunque para el índice de Barthel si tuvo una correlación significativa con la severidad de la depresión. (Tabla 4).
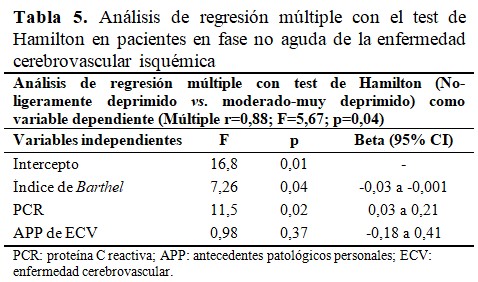
El análisis multivariado para evaluar la relación entre el grado de depresión como variable dependiente y como continuas el índice de Barthel, la PCR y el antecedente de ECV; mostró una asociación independiente de esta proteína y de la escala de discapacidad para las actividades de la vida diaria con la severidad de la depresión medida por el test de Hamilton. (Tabla 5).
DISCUSIÓN
Es conocido que la depresión se encuentra relacionada con una mala evolución neurológica de los pacientes con ECVI y la alta mortalidad.(2) Las estadísticas señalan frecuencias de DPI hasta alrededor del 30 % de estos pacientes, aunque pueden variar de acuerdo al período de evaluación. De tres meses y al año de evolución de la enfermedad, la DPI puede oscilar entre un 15 y 50 % de los casos; así como del 39 % al 52 % en seguimientos de 1 a 5 años.(9)
La inflamación es uno de los principales mecanismos relacionados con la evolución de los pacientes con ictus, lo que pudiera asociarse con la extensión del daño y sus complicaciones.(10) Sin embargo, existen criterios controversiales acerca del papel beneficioso o dañino de las moléculas involucradas en este mecanismo ya que algunas poseen ambos efectos. Por un lado se sugiere que contribuyen con la infiltración de leucocitos para eliminar los restos de tejido dañado durante la fase aguda de esta enfermedad y por otro en su fase no aguda parece promover efectos regenerativos. Sobre este último, se describe disminución de la concentración de la PCR(7) y C3(11) en la fase no aguda del ictus. En cambio, en este trabajo no se observó una menor concentración de dichas proteínas desde el punto de vista estadístico y de manera significativa en el grupo de la fase no aguda del ictus respecto a los pacientes de la fase aguda. Además, se plantea que este comportamiento quizás se deba a problemas con la metodología del estudio.(12) En nuestro caso, no haber realizado una investigación con un diseño longitudinal resultó una limitante de este trabajo, lo que quizás impidió observar cambios significativos para las concentraciones de estas moléculas entre las fases aguda y no aguda de la ECVI.
En cuanto a la DPI en pacientes con ECVI, Donata y colaboradores en 2019(12) refirieron una media en la puntuación del test de Hamilton de 5,4±6,9 puntos en la primera semana del evento agudo; mientras que, encontraron un aumento significativo de la puntuación de esta prueba (9,2±7,8 puntos) cuatro años después del evento. Dicha variación en las puntuaciones se correspondió con un aumento de depresión en el transcurso del tiempo,(12) lo que no se encontró concordancia entre el resultado observado en este trabajo con el de los autores antes mencionados. Es probable que este comportamiento se deba a la limitación en el diseño del estudio de la presente investigación. También pudieran influir los diferentes períodos evaluativos posteriores al evento agudo.
No obstante, Gao y colaboradores(13) en su estudio longitudinal no observaron diferencias estadísticas en la puntuación del test de Hamilton durante un seguimiento de nueve meses (p>0,05). Por lo que, estos hallazgos contradictorios de la literatura pudieran deberse a otras razones, entre las que se incluyen: la experiencia de los especialistas que aplican las pruebas neuropsicológicas, antecedentes de depresión, rehabilitación, apoyo familiar, entre otros.
Por otro lado, Donata y colaboradores(12) identificaron en la etapa aguda de la ECVI una mayor frecuencia de pacientes deprimidos, evaluados por el test de Hamilton (69 %) y por el inventario de Beck (57 %); lo que también se halló en esta investigación, aunque en porcentajes más elevados (Hamilton: 81,8 % y Beck: 72,7 %). Además, hubo concordancia con estos autores(12) en relación con el grado de depresión ya que los pacientes de este estudio también presentaron fundamentalmente depresiones leve y moderada. Mientras tanto en la fase no aguda del ictus, a pesar de la limitante del presente estudio, se encontró una disminución de la frecuencia de pacientes con alta severidad de la depresión en la fase no aguda para cada una de las pruebas neuropsicológicas, lo cual resultó significativo para el test de Hamilton.
En cuanto a la asociación de proteínas inflamatorias y de disfunción endotelial, no se encontraron trabajos que relacionaran el complemento C4 con la depresión. Sin embargo, se observó en un estudio previo que las concentraciones de C4 se elevaron con la severidad neurológica en la etiología cardioembólica;(14) así como con una peor evolución neurológica, independientemente del tipo de ictus isquémico.(15) A pesar de este hallazgo en la ECV, con el resultado del multivariado del presente estudio se pudiera hipotetizar que la relación de C4 y la depresión en esta enfermedad no parece asociarse con la discapacidad para las actividades de la vida diaria.
Del complemento C3, tampoco se hallaron referencias acerca de su relación con la depresión. No obstante, se ha planteado que existen dos vías inmunológicas innatas sistémicas (complemento y coagulación) que tienden a inhibirse a los tres meses cuando los síntomas del ictus son leves. A propósito del tema, Mu y colaboradores(6) señalaron que en los mecanismos de ocurrencia de la depresión después del ictus están involucrados principalmente factores inmunes, respuesta inflamatoria, citoquinas, entre otras; tales como las interleuquinas inflamatorias, factor de necrosis tumoral y PCR.
Acerca de la PCR, se han referido diferencias estadísticas entre los grados de depresión, medidos por el test de Hamilton y las concentraciones de PCR; siendo mayores sus valores en las depresiones moderada y severa respecto a la leve.(6) También, Yang y colaboradores(16) en 2016 describieron, en un grupo de pacientes con depresión después de un ictus, aumento de las concentraciones de PCR, así como una correlación significativa con la puntuación del test de Hamilton, la que también tuvo significación en el análisis multivariado. Por tanto, el hallazgo con esta proteína en este trabajo fue similar a lo observado a los estudios anteriores; en los cuales explican que los factores inflamatorios afectan la concentración, función y transporte de los monoaminoneurotransmisores (serotonina y norepinefrina), los que mantienen la excitabilidad en el sistema nervioso central y evitan la depresión.(6)
Además, estos factores pueden afectar el eje del sistema límbico-hipotálamo-pituitaria-adrenal, y por consiguiente la liberación de cortisol, el cual inhibe la liberación de citoquinas inflamatorias. A su vez, que altera la generación del factor neurotrófico derivado de cerebro, responsable de la regulación de la depresión y neuroplasticidad.(6) No obstante, Lee y colaboradores(17) en el 2021 no encontraron diferencias para las concentraciones de PCR entre pacientes con y sin síntomas depresivos luego de tres meses de un evento agudo de ictus. Estos hallazgos controversiales pudieran estar relacionados con la presencia de polimorfismos descritos para la PCR, los cuales parecen asociarse con la depresión posterior a un ictus. Al respecto se plantea que el gen que codifica para esta proteína, localizado en el brazo largo del cromosoma 1, es una región muy polimórfica con más de 40 variantes conocidas. Sobre el polimorfismo rs3091244 en el alelo G, ubicado en la región promotora del gen, Chen y colaboradores(18) encontraron relación de este con un alto riesgo temprano de depresión después de un ictus a diferencia de la presencia de esta variante en el alelo A rs3091244, la cual reduce este riesgo.
Acerca de la AAT, no se identificaron trabajos del tema, pero es conocido que esta proteína participa en el proceso inflamatorio del ictus. De hecho, Bartosik-Psujek y colaboradores(19) hallaron su máximo incremento el 7mo día después del evento de ictus isquémico. Aunque pudiera sugerirse que al igual que otras proteínas del proceso del inflamatorio, la AAT quizás también se asocia con los mecanismos inmunológicos de la depresión.
Por tanto, en la etiología de la depresión posterior a un ictus parece persistir la neuroinflamación, con incremento de moléculas proinflamatorias y disminución de la señal de citoquinas antiinflamatorias. Además, de que la inmunodepresión periférica observada en este estado provoca activación de cascadas moleculares centrales que incluye el paso de citoquinas a través de la barrera sangre-líquido cefalorraquídeo o la biodisponibilidad de inmunoglobulinas y leucocitos. Conjuntamente con este mecanismo, también, la neuroanatomía, o sea las características de las neuronas, factores bioquímicos y la neurogénesis parecen participar en la depresión de esta enfermedad. La acumulación de lesiones en el lóbulo frontal izquierdo y ganglios de la base pudieran interrumpir las vías del control del estado de ánimo o de las monoaminas, así como generar un hipercortisolismo que induce a la disminución de transportadores de serotonina.(20)
A pesar de la limitante del diseño del estudio y el pequeño tamaño de muestra, el tema de esta investigación resulta esencial, pues pudiera esclarecer las contradicciones sobre la PCR y la presencia o no de depresión en la ECVI, el riesgo. Además, aporta datos sobre el probable papel de esta proteína en la depresión de estos pacientes; así, contribuye a incentivar investigaciones en el futuro con el propósito de buscar nuevas herramientas para el seguimiento de la depresión en la ECV.
A partir de los hallazgos de este trabajo se pudo concluir que en la severidad de la depresión en pacientes con ECVI en fase aguda y no aguda parece tener participación la PCR. Además, puede que su mecanismo esté relacionado con la discapacidad para las actividades de vida diaria.
Agradecimientos
Le agradecemos a la Dr. C. María de la Caridad Menéndez Saínz, Ms.C. Rebeca Fernández Carriera, Téc. Mirelys Peña Nolasco, del Departamento de Neurobiología del Instituto de Neurología y Neurocirugía por el apoyo en el trabajo de procesamiento de muestras y con la determinación de marcadores hemoquímicos.
Conflicto de intereses
Los autores declaran que no poseen conflicto de intereses
Contribuciones de los autores
Conceptualización de ideas: Marianela Arteche Prior, Julcileia Imara D. de Carvalho Muenho.
Curación de datos: Julcileia Imara D. De Carvalho Muenho, Marianela Arteche Prior, Asdrubal Arias Morales, Danay Martínez Puentes.
Análisis formal: Marisol Peña Sánchez.
Investigación: Julcileia Imara D. de Carvalho Muenho.
Metodología: Marisol Peña Sánchez, Alina González-Quevedo Monteagudo.
Visualización: Julcileia Imara D. De Carvalho Muenho.
Redacción del borrador original: Marisol Peña Sánchez, Julcileia Imara D. De Carvalho Muenho, Danay Martínez Puentes.
Redacción, revisión y edición: Alina González-Quevedo Monteagudo.
Financiación
Instituto de Neurología y Neurocirugía. La Habana. Cuba.