INTRODUCCIÓN
En la actualidad, las enfermedades se van incrementando de forma exponencial, por lo que son necesarios tratamientos farmacológicos eficaces y seguros que permitan mejorar la calidad de vida del paciente. En este sentido, un aspecto limitante es el factor económico, sobre todo en países en vías de desarrollo, en donde se evidencian incumplimientos en los tratamientos farmacoterapéuticos establecidos por el médico prescriptor.(1,2)
Al respeto, una estrategia que permitiría incrementar la adherencia terapéutica, es la incorporación de medicamentos intercambiables en cada nación, porque de esta manera, el paciente con escasos recursos podría acceder a una salud de calidad, que garantice su recuperación en corto tiempo.(3,4)
De esta manera, la intercambiabilidad requiere de los estudios de bioequivalencia, que representa una demostración de la calidad, seguridad y eficacia de un medicamento multifuente que se dispensa en establecimientos farmacéuticos bajo su denominación común internacional a un bajo precio, respecto a un medicamento innovador, que registra una patente de exclusividad de 20 años. Los parámetros farmacocinéticos evaluativos en un estudio de bioequivalencia están relacionados con la medición de la concentración máxima, tiempo máximo y área bajo la curva. Asimismo, en la actualidad, también se consideran los estudios in vitro en los procesos de intercambiabilidad de medicamentos, y los parámetros evaluativos que se incluyen son los modelos independientes, factor de diferencia (f1) y factor de similitud (f2), regidos por consideraciones técnica establecidas por organismos competentes.(5,6,7)
Por consiguiente, la bioexención representa la sustitución de un estudio in vitro por uno in vivo con propósito de intercambiabilidad, permitido preferencialmente para medicamentos clase 1, según el sistema de clasificación biofarmacéutica, y que posteriormente se ha extendido para clase 2 y 3.(8,9)
Los estudios previos indican que existe poca información disponible en Perú sobre medicamentos bioequivalentes, por tal motivo, se hace relevante la necesidad de que los organismos gubernamentales realicen mayor cantidad de estudios in vivo e in vitro con la finalidad de tener un listado de medicamentos intercambiables, tal como sucede en otros contextos sanitarios.
Por tanto, la revisión bibliográfica aborda una temática relevante en el área de salud pública, debido a que identifica aquellos medicamentos bioequivalentes disponibles en el estado peruano, cuya información va a permitir que el paciente tenga acceso a una formulación de menor costo y logre completar su esquema terapéutico. Por este motivo, el estudio propone identificar medicamentos intercambiables disponibles en Perú, según la búsqueda realizada en bases de datos de alta relevancia científica durante los años 2000-2022.
MÉTODOS
Este estudio se basa en la revisión bibliográfica de artículos de alto impacto, publicados desde el año 2000 hasta el 2022, a través de las bases de datos Scopus, Scielo y Pubmed. Esta fundamentada en la recolección, evaluación, análisis y argumentación de la información obtenida en cada artículo seleccionado.(10,11)
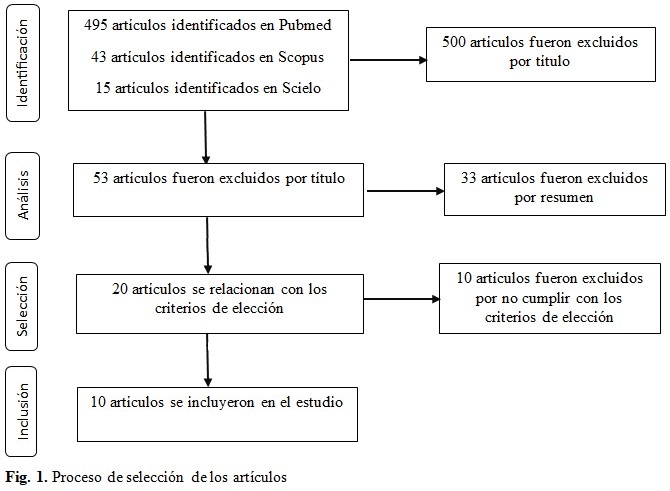
Como estrategia de búsqueda se utilizaron los términos "Therapeutic equivalence", “Drug interchangeability”, “in vitro bioequivalence”, “(bioequivalence [MeSH Terms]) AND (drugs, generic[MeSH Terms])”; idioma español e inglés, periodo de publicación 22 años. Se incluyeron artículos originales con información relacionada al control biofarmacéutico e intercambiabilidad de productos multifuentes con respecto al producto de referencia. La búsqueda inicial arrojó 553 resultados, siendo eliminados 500 artículos ya que contenían información irrelevante. De los 20 artículos restantes fueron eliminados 10 por que no tenían acceso abierto y no eran medicamentos peruanos. Por último, fueron seleccionados 10 artículos, tal como se visualiza en la figura 1.
DESARROLLO
Una de las prioridades de la Organización Mundial de la Salud (OMS) es que los medicamentos desarrollados sean seguros, eficaces y de fácil acceso para toda la población. Debido a ello, crece la necesidad de implementar la fabricación de medicamentos genéricos, con el fin de sustituir a los medicamentos innovadores para tratar diferentes enfermedades que padece el ser humano.(12) En este sentido, se debe entender por medicamento genérico aquel que sale al mercado farmacéutico después que ha vencido la patente del medicamento innovador y resulta ser intercambiable en términos de eficacia, seguridad y calidad; mientras que, el medicamento innovador es aquel que tiene la molécula original y en base a documentación cumple con los criterios de eficacia, seguridad y calidad. Por otra parte, el medicamento multifuente es aquel que aún no ha demostrado ser intercambiable con el medicamento innovador y puede o no ser un equivalente terapéutico.(13)
Asimismo, la intercambiabilidad de medicamentos en el Perú se inició con la promulgación de la Política Nacional de medicamentos, a través del Ministerio de Salud, el 29 de diciembre del 2004. Se basa en la aplicación de estudios relacionados a la biodisponibilidad y bioequivalencia en medicamentos de alto riesgo sanitario. En el 2009 se promulga la ley 29459, en los artículos 4 y 10, donde se especifica el cumplimiento de estudios de bioequivalencia en los medicamentos. En el año 2011 se aprueba el decreto supremo 016-2011-SA, que establece que, para el registro y reinscripción de medicamentos de categoría 1 y 2, deben estar incluidos los estudios de equivalencia terapéutica. En base a esto, en el año 2015 se publica el reglamento que regula la intercambiabilidad de medicamentos, siendo aprobado en el 2018 a través del Decreto Supremo N° 024-2018-SA.(14)
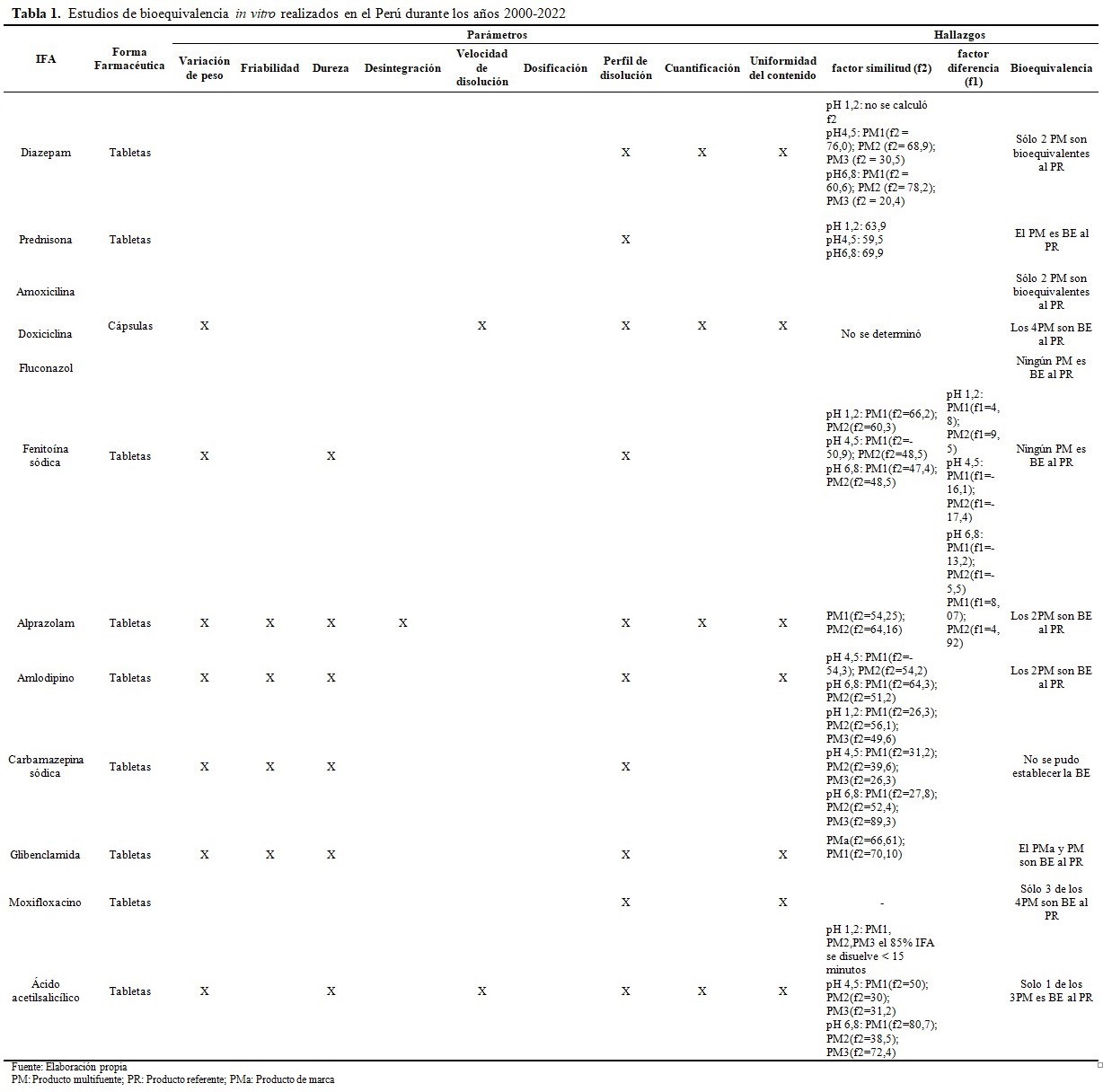
A continuación, en la tabla 1 se presentan los resultados obtenidos de los artículos seleccionados para el análisis. Se evaluaron 12 artículos y se observó que solo 9 Ingrediente Farmacéutico Activo (IFAs) eran bioequivalentes, 4 resultaron ser no bioequivalentes y en 1 no se pudo establecer la bioequivalencia entre el Producto Multifuente (PM) y el Producto Referente (PR). En cada IFA se realizaron diferentes ensayos, como variación de peso(5,7,15,16,17,18,19), friabilidad(7,18,19,20), dureza(5,7,16,17,18,19), desintegración(17), velocidad de disolución(5,15), dosificación, perfil de disolución(5,6,7,15,16,17,18,19,20,21), cuantificación(5,15,16,20) y uniformidad de contenido(5,6,7,15,17,18,20), evidenciándose que algunos no cumplían con el perfil de disolución, ya que al analizar el factor similitud(f2) y factor diferencia (f1), se encontraron valores inferiores y superiores al rango establecido de 50-100 y 0-15, respectivamente. (Tabla 1).
En base a los resultados obtenidos en la tabla 1, se evidenció que diazepam cumple con el control de calidad en relación con identificación y cuantificación del IFA, además, con respecto al perfil de disolución se observó que era de disolución rápida a pH 1.2, por lo que no se determinó f2, por otra parte, el PM 3 es de disolución lenta a pH 4.5 y 6.8, debido a ello existe la probabilidad que su biodisponibilidad sea ineficiente, por tanto no es intercambiable con el PR, a diferencia del PM1 y PM2.(20)
En el análisis de prednisona se reportó que en los porcentajes disueltos a pH 1.2, 4.5 y 6.8 existe similaridad entre el PM y PR, lo que indica el compromiso de las diferentes industrias farmacéuticas al utilizar principios activos y excipientes de calidad, de tal forma que asegure la eficacia terapéutica, además, el f2 encontrado para cada pH está dentro del rango 50-100, por ende, ambos productos son intercambiables.(21)
Además, también se ha evaluado la equivalencia terapéutica en 3 PM tales como, amoxicilina, doxiciclina y fluconazol, siendo sometidos a diferentes ensayos de calidad como, variación de peso, cuantificación, uniformidad de contenido y perfil de disolución, evidenciándose que los 3 PM cumplen con el rango de aceptación en los 3 primeros ensayos, pero en la prueba de perfil de disolución, fluconazol demostró ser no bioequivalente, mientras que amoxicilina a pH 1.2 presentaba una disolución rápida, siendo característico ya que es un medicamento de clase 1 (SCB) pero sólo 2 PM mostraron ser bioequivalentes al PR, por otra parte, los 4 PM de doxiciclina demostraron ser bioequivalentes al PR.(15)
Al mismo tiempo, se evaluó la equivalencia terapéutica de fenitoína sódica, mediante pruebas de control de calidad como variación de peso, dureza, contenido de IFA y perfil de disolución, evidenciándose que sólo existía diferencia en el perfil de disolución a pH 4.5 y 6.8, siendo solo equivalente terapéutico a pH 1.2, por el contrario, las demás pruebas estaban dentro del rango establecido.(16)
En alprazolam se realizaron pruebas fisicoquímicas como variación de peso, dureza, friabilidad, desintegración, cuantificación, uniformidad de contenido, velocidad y perfil de disolución, observándose que ningún PM excedía los rangos establecidos para cada prueba, por lo tanto, todos los PM analizados son equivalentes al PR.(17)
Por otra parte, se evaluó amlodipino, determinándose la variación de peso, dureza, friabilidad y estaban dentro del límite de aceptación con un coeficiente de variación menor al 5 %. En relación con el perfil de disolución, los PM de amlodipino mostraron liberarse más del 85 % a los 15 min a pH 1.2; mientras que a pH 4.5 y 6.8 fue inferior; además, el f2 a pH 4.5 y 6.8 estaba dentro del rango (50-100), por ende, las formulaciones demostraron ser bioequivalentes al PR.(18)
También se han reportado estudios de equivalencia biofarmacéutica en carbamazepina, se evaluaron pruebas fisicoquímicas como dureza, friabilidad, variación de peso, uniformidad de contenido, todas mostraron estar dentro del rango de aceptación, a diferencia del test de disolución, en el cual se evidenció que los valores de f2 en los PM eran menores a 50 en los 3 medios de disolución (pH: 1.2; 4.5 y 6.8) y por ende no se pudo establecer la bioequivalencia con el PR.(19)
Por su parte, Alvarado et al.(7) analizaron la equivalencia biofarmacéutica de glibenclamida de cuatro países, uno de ellos Perú, además, incluyeron pruebas de dureza, friabilidad, variación de peso, uniformidad de contenido y perfil de disolución, en donde se observó que la velocidad de disolución era lenta, debido a que el medicamento pertenece a la clase 2 (baja solubilidad, alta permeabilidad) y al aplicar f2, se demostró que las tabletas de glibenclamida solo son equivalentes biofarmacéuticos pero a pH 6.8, por tanto, deben realizarse pruebas de biodisponibilidad relativa, con el fin de demostrar la intercambiabilidad.
Chumpitaz et al.(6) analizaron 4 PM de moxifloxacino adquiridos en Lima, pero manufacturados en diferentes países como India, Brasil y Perú, para ello se realizaron pruebas de control de calidad, así como el perfil de disolución, con la finalidad de demostrar la intercambiabilidad, pero al evaluar f2, solo 3 PM cumplían con las especificaciones a excepción del PM manufacturado en la India, lo que indica que en el Perú existe al menos 1 PM que no es intercambiable con el PR.
Bendezú et al.(5) analizaron la bioequivalencia in vitro del ácido acetilsalicílico y en relación con las pruebas de control como variación de peso, dureza, friabilidad, uniformidad de contenido estaban dentro del rango, y en la prueba de disolución se evidenció que en los 3 PM se disolvieron en un porcentaje mayor al 85 % en menos de 15 minutos, por tal razón, no se determinó f2 a pH 1.2; sin embargo, a pH 4.5 solo fue similar el PM 1 y a pH 6.8 fueron similares en el perfil de disolución, el PM 1 y PM 3, debido a ello, sólo el PM 1 es intercambiable con el PR.
CONCLUSIONES
Según los artículos de investigación analizados, la intercambiabilidad es un tema prioritario en la salud pública de una nación; sin embargo, se hace difícil tener un listado de medicamentos bioequivalentes accesibles a pacientes con escasos recursos económicos, por tal motivo, el estado peruano debe asociarse con el sector privado, con el propósito de gestionar los recursos necesarios para ejecutar estudios in vitro, considerando las facilidades que brindan los organismos reguladores con los medicamentos clase 1 y 3 del sistema de clasificación biofarmacéutica.
Los controles de calidad biofarmacéutica se establecieron en los medicamentos que fueron intercambiables, asegurando, de esta manera, el cumplimiento de las buenas prácticas de manufactura en el desarrollo de las formulaciones farmacéuticas.
La información obtenida de los diferentes estudios permite concientizar a la población sobre la importancia de tener medicamentos de calidad dentro de un país, que puedan cumplir con su propósito farmacoterapéutico, y que no necesariamente la recuperación del paciente se encuentre asociado a medicamentos con alto costo.
Conflicto de intereses
Los autores declaran que no presentan conflicto de intereses.
Contribuciones de los autores
Conceptualización: Ericson Félix Castillo Saavedra, Franklin Jhony Julián Méndez, Veronica Yamilet Coronel Vega, Cecilia Elizabeth Reyes Alfaro, Rosa María Salas Sánchez. .
Visualización: Ericson Felix Castillo Saavedra, Cecilia Elizabeth Reyes Alfaro, Rosa María Salas Sánchez..
Redacción: Franklin Jhony Julián Méndez, Veronica Yamilet Coronel Vega..
Redacción, revisión y edición: Ericson Félix Castillo Saavedra, Franklin Jhony Julián Ericson Felix Castillo Saavedra, Veronica Yamilet Coronel Vega..
Financiación
Autofinanciado.
REFERENCIAS BIBLIOGRÁFICAS
- Machado R, Reis T, Ueta J, Joel L. Use and access to medications for type 2 diabetes mellitus in elderly: a population-based household survey. Cien Saude Colet [revista en Internet]. 2021 [cited 28 Jan 2023]; 26(suppl 3): [aprox. 7 p]. Available from: https://pubmed.ncbi.nlm.nih.gov/34787200/
- Marew T, Richmond F, Belete A, Gebre – Mariam T. Trends and challenges in access to essential medicines in Ethiopia and the contributions of local pharmaceutical production. Ethiop J Health Sci [revista en Internet]. 2022 [cited 30 Jan 2023]; 32(5): [aprox. 15 p]. Available from: https://pubmed.ncbi.nlm.nih.gov/36262708/
- Glerum P, Neef C, Burger D, Yu Y, Maliepaard M. Pharmacokinetics and generic drug switching: A regulator's View. Clin Pharmacokinet [revista en Internet]. 2020 [cited 22 Jan 2023]; 59(9): [aprox. 5p]. Available from: https://pubmed.ncbi.nlm.nih.gov/32557345/
- Gozzo L, Caraci F, Drago F. Bioequivalence, drugs with narrow therapeutic index and the phenomenon of Biocreep: A critical analysis of the system for generic substitution. Healthcare (Basel) [revista en Internet]. 2022 [cited 15 Jan 2023]; 10(8): [aprox. 5p]. Available from: https://pubmed.ncbi.nlm.nih.gov/35893214/
- Bendezú M, García J, Chávez H, Muñoz A, Jauregui J, Mucha M. In Vitro bioequivalence of acetylsalicylic acid and implications in public health. Dissolution Technol [revista en Internet]. 2022 [cited 30 Jan 2023]; 29(3): [aprox. 5p]. Available from: http://dissolutiontech.com/issues/202208/ASA.pdf
- Chumpitaz V, Moreno L, Ruiz E, Franco C, Flores M, Chávez L. Therapeutic equivalence evaluated through in vitro studies of multisource drugs: A moxifloxacin case study in Lima, Peru. Dissolution Technol [revista en Internet]. 2022 [cited 10 Jan 2023]; 1(29): [aprox. 9p]. Available from: http://dissolutiontech.com/issues/202202/Moxifloxacin.pdf
- Alvarado A, Muñoz A, Bendezú M, García J, Palomino J, Ochoa G, et al. In Vitro biopharmaceutical equivalence of 5 mg glibenclamide tablets in simulated intestinal fluid without enzymes. Dissolution Technol [revista en Internet]. 2021 [cited 15 Jan 2023]; 28(1): [aprox. 12 p]. Available from: http://dissolutiontech.com/issues/202102/20-00022Glibenclamide.pdf
- Miranda C, Aceituno M, Fernández M, Mendes G, Rodríguez Y, Llauró, Cabrera – Pérez M. ICH Guideline for Biopharmaceutics Classification System-Based Biowaiver (M9): Toward Harmonization in Latin American Countries. Pharmaceutics [revista en Internet]. 2021 [cited 25 Jan 2023]; 13(3): [aprox. 10 p]. Available from: https://pubmed.ncbi.nlm.nih.gov/33801796/
- Metry M, Polli J. Evaluation of Excipient Risk in BCS Class I and III Biowaivers. AAPS J [revista en Internet]. 2022 [cited 13 Jan 2023]; 24(1): [aprox. 5 p]. Available from: https://pubmed.ncbi.nlm.nih.gov/34988701/
- Cué M, Díaz G, Díaz A, Valdés M. El artículo de revisión. Rev Cubana de Salud Pública [revista en Internet]. 2008 [cited 04 Feb 2023]; 34(4): [aprox. 10p]. Available from: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-34662008000400011
- Vera O. Como escribir artículos de revisión. Rev Med La Paz [revista en Internet]. 2009 [cited 04 Feb 2023]; 15(1): [aprox. 6p]. Available from: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1726-89582009000100010
- Cabrera M, Miranda C, Fernández M. Bioequivalencia in vitro: una oportunidad para el desarrollo y comercialización de los medicamentos genéricos nacionales. Revista Cubana de Farmacia [revista de Internet]. 2022 [cited 08 Feb 2023];55(1): [aprox. 11p]. Available from: https://revfarmacia.sld.cu/index.php/far/article/view/743/461
- Rodriguez L, Cruz L, Cruz C, Alva P. Calidad biofarmacéutica e intercambiabilidad de medicamentos. Ars Pharm [revista de Internet]. 2021 [cited 08 Feb 2023];62(3): [aprox. 13p]. Available from: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S2340-98942021000300315#B10
- Perez E, Gomes H. Intercambiabilidad de medicamentos en el Perú: Panorama actual y perspectivas futuras. Rev Peru Med Exp Salud Publica [revista de Internet]. 2021 [cited 08 Feb 2023]; 38(2): [aprox. 7p]. Available from: https://rpmesp.ins.gob.pe/index.php/rpmesp/article/view/7322
- Grande M, Taipe S, Villodas C, Rodríguez J, Moreno L. Equivalencia terapéutica evaluada mediante estudios in vitro de medicamentos multifuentes: estudio de casos de amoxicilina, doxiciclina y fluconazol en Lima, Perú. Rev Peru Med Exp Salud Publica [revista de Internet]. 2019 [cited 04 Feb 2023]; 36(1): [aprox. 6p]. Available from: https://rpmesp.ins.gob.pe/index.php/rpmesp/article/view/3912
- Alvarado A, Muñoz A, Miyasato J, Alvarado E, Loja B, Villanueva L, et al. In vitro therapeutic equivalence of two multisource (generic) formulations of sodium phenytoin (100 mg) available in Perú. Dissolution Technol [revista de Internet]. 2020 [cited 04 Feb 2023]; 4(27): [aprox. 7p]. Available from: http://dissolutiontech.com/issues/202011/DT202011_A04.pdf
- Rodríguez L, Alva P, Malca J, Ricardo E, Caballero J. Estudio comparativo de la calidad biofarmacéutica de alprazolam 0,5 mg comercializadas en el mercado peruano. Mem. Inst. Investig. Cienc. Salud [revista de Internet]. 2020;18(3): [aprox. 12p]. Available from: http://scielo.iics.una.py/pdf/iics/v18n3/1812-9528-iics-18-03-43.pdf
- García J, Bendezú M, Pineda M, Muñoz A, Saravia M, Alvarado A. Quality attributes and in vitro bioequivalence of amlodipine (5 mg) tablets in Ica, Peru. Dissolution Technol [revista de Internet]. 2021; 4(28): [aprox. 10p]. Available from: http://dissolutiontech.com/issues/202111/Amlodipine_ms.pdf
- Alvarado A, Muñoz A, Bendezú M, Palomino J, García J, Alvarado C, et al. In vitro biopharmaceutical equivalence of carbamazepine sodium tablets available in Lima, Perú. Dissolution Technol [revista de Internet]. 2021; 2(28): [aprox. 10p]. Available from: http://dissolutiontech.com/issues/202105/Carbamazipine.pdf
- Herrera O, Grande M. Equivalencia terapéutica de tabletas de diazepam dispensadas en la ciudad de Ica, Perú. Rev Med Hered [revista de Internet]. 2012; 23(3): [aprox. 6p]. Available from: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1018-130X2012000300003
- Casanova L, Castillo E, Reynoso E, Ayala C. Estudio comparativo de perfiles de disolución de tabletas de prednisona 20 mg comercializados en Perú. Mem. Inst. Investig. Cienc. Salud [revista de Internet]. 2018; 16(3): [aprox. 9p]. Available from: http://scielo.iics.una.py/scielo.php?script=sci_arttext&pid=S1812-95282018000300013