INTRODUCCIÓN
La neumonía asociada al ictus (NAI) constituye la infección de mayor impacto en la morbilidad y mortalidad del paciente con ictus isquémico, su frecuencia varía considerablemente en la literatura, con rangos de 1,4 % a 57 %.(1,2)
El grupo de consenso multidisciplinario Pneumonia in Stroke ConsEnSus (PISCES) define a la NAI como el espectro de neumonía que se desarrolla en los primeros siete días después del inicio del ictus en pacientes sin ventilación mecánica.(3)
A partir del año 2006 investigadores de diferentes regiones del mundo han desarrollado 13 índices de predicción de NAI basados en factores relevantes desde el punto de vista patogénico, presentes en las primeras 24 h del ingreso del paciente.(4,5,6,7,8) Tres de ellos, el Acute Ischaemic Stroke- Associated Pneumonia Score (AIS-APS),(4) el Prestroke Independence, Sex, Age, NIHSS (ISAN)(5) y el Age, Atrial fibrillation, Dysphagia, Severity [NIHSS], Sex (A2DS2)(6) tienen los mejores resultados en los estudios de validaciones externas, así como adecuada capacidad de discriminación, motivos por los cuales son los más aceptados en la práctica e investigaciones médicas.(7,8,9)
Sin embargo, estos principales índices de predicción tienen determinadas limitaciones, como la heterogeneidad en los criterios diagnósticos empleados para la NAI; que derivan de estudios retrospectivos no diseñados inicialmente para evaluar específicamente la NAI; incluyen pacientes tanto con ictus isquémicos como hemorrágico; y sus resultados no homogéneos en los diferentes estudios de validación, lo cual limita su utilidad clínica. Además, no incluyen parámetros inmunonutricionales que ayuden a mejorar la estimación de riesgo; ni se han aplicado ampliamente a pacientes de diferentes razas y áreas geográficas, lo cual limita su utilidad y seguridad.(4,5,6,7,8,9)
En Cuba no existen estudios de validación para estos índices internacionales, ni se dispone de un índice adaptado a las condiciones clínicas y epidemiológicas de la población.Todo lo anterior sugiere la necesidad de realizar investigaciones que permitan identificar con exactitud los factores predictivos del desarrollo de la neumonía asociada al ictus isquémico (NAII), así como diseñar un índice adaptado a las características de la población; aspectos a los que pretende contribuir el presente estudio, cuyo objetivo es diseñar y validar un nuevo índice predictivo de neumonía asociada al ictus isquémico.
MÉTODOS
Se realizó un estudio observacional, analítico, de cohorte prospectiva en pacientes con ictus isquémico atendidos en los servicios de Medicina Interna, Neurología, Ictus, Terapia Clínica y Terapia Intermedia, del Hospital General Provincial Universitario Carlos Manuel de Céspedes, del municipio de Bayamo, provincia de Granma, desde el 1ro de enero de 2015 hasta el 31 de julio de 2019.
Los parámetros para el cálculo del tamaño de la muestra se especificaron en un estudio previo;(10) según estos, se decidió investigar 725 pacientes. Dicha muestra se dividió aleatoriamente en dos partes: una de 509 (el 70,2 %) pacientes (cohorte de derivación), con vistas a realizar los análisis estadísticos univariado y multivariado (con todas las variables que constituyeron factores de riesgo en el análisis univariado), estimar la función de regresión logística y crear el índice predictivo; y la otra con 216 (29,8 % restante) pacientes, para validarlo (cohorte de validación).
Fueron incluidos todos los pacientes de 18 años o más, hospitalizados con diagnóstico de ictus isquémico según los criterios de la American Heart Association/ American Stroke Association;(11) con una puntuación en la escala de Glasgow mayor de 9 puntos; en los cuales no se constataron elementos de incubación, ni de infección respiratoria al momento del ingreso. Se excluyeron las gestantes, pacientes portadores del VIH o sida definido, paciente con ictus de más de 48 horas de evolución antes de su ingreso hospitalario, disfagia preexistente, antecedente de enfermedades hematológicas malignas o hepáticas (hepatopatías agudas y crónicas, así como la cirrosis hepática) y antecedente de neoplasias.
Se consideraron los criterios de neumonía asociada al ictus propuestos por el grupo de consenso PISCES, basados en criterios clínicos y de imagen;(3) también se consideró incluir el diagnóstico microbiológico. Los criterios se detallan a continuación:
I-Criterios clínicos diagnósticos: los que se presentan después de las primeras 48 horas, al menos uno de los tres siguientes: fiebre > 38 grados centígrados sin otra causa reconocida; leucocitosis > 12,0 x 109/L o leucopenia < 4,0 x 109/L; adultos ≥ 70 años con alteración del estado mental sin otra causa reconocida, incluyendo específicamente el deterioro neurológico. Más al menos dos de los siguientes criterios: aparición de un nuevo esputo purulento, o cambio en sus características (color, olor, cantidad y consistencia) en un período de 24 horas, incremento de las secreciones respiratorias o en la necesidad de aspiraciones; nuevo episodio de tos, disnea o taquipnea (frecuencia respiratoria > 25/min); auscultación sugestiva (crepitantes, subcrepitantes y sibilantes); deterioro del intercambio gaseoso (desaturación de oxígeno (O2) [ejemplo, presión arterial de oxígeno/fracción inspirada de oxígeno (PaO2/FiO2) ≤ 240] o aumento de las demandas de O2).
II-Criterios de imagen: ≥ dos radiografías de tórax seriadas con al menos uno de los elementos siguientes: infiltración, consolidación o cavitación nueva o progresiva y persistente. En pacientes sin enfermedad cardiaca o pulmonar, una radiografía de tórax fue suficiente. Cuando la radiografía de tórax inicial fue normal, se realizó otra entre el segundo y séptimo día.
III-Criterios microbiológicos diagnósticos: cultivo positivo no cuantitativo del esputo; microorganismo aislado en dos o más hemocultivos positivos con idéntica sensibilidad al encontrado en secreciones y sin otra fuente de infección probable.
Variable dependiente: la neumonía asociada al ictus isquémico.
Variables independientes: edad (años cumplidos), sexo masculino; fumador activo; alcoholismo; antecedentes de enfermedad pulmonar obstructiva crónica (EPOC), diabetes mellitus (DM), hipertensión arterial (HTA), cardiopatía isquémica crónica (CIC), fibrilación atrial (FA), insuficiencia cardiaca, ictus previo (IP), disfagia neurogénica al ingreso;(12) todas fueron operacionalizadas como variables cualitativas nominales dicotómicas: (0) ausentes y (1) presente. Puntuación en la escala de NIHSS al ingreso (cuantitativa), la extensión y topografía del infarto cerebral según la clasificación de Oxfordshire Community Stroke Project.(13) El tipo de microorganismo se consideró cualitativa nominal dicotómica: (0) ausencia y (1) presencia de determinados gérmenes. Marcadores biológicos (cuantitativas): las cifras de hemoglobina (Hb) dado en g/L, conteo de leucocitos x109/L, conteo de linfocitos (%), conteo global de linfocitos (CGL) mm3, conteo de plaquetas x109/l, cifras de alanina aminotransferasa (ALT o TGP) dado en UI, aspartato aminotransferasa (AST o TGO) dado en UI, colesterol en mmol/L, albúmina sérica en g/L, proteínas totales en g/L, glucemia en mmol/L, creatinina en μmol/L, urea en mmol/L.
Para la identificación de los factores de riesgo con influencia independiente de la aparición de la NAII, se realizó un estudio multivariado mediante la técnica de regresión logística binaria.
Construcción y validación del nuevo índice
En la construcción del índice se consideraron solamente las variables que resultaron significativas en el análisis multivariado. A cada una de las retenidas por el modelo generado mediante la regresión logística binaria, se le asignó un puntaje mediante la amplificación de su coeficiente de regresión, se multiplicó por 10 y se aproximó a números enteros, los cuales a su vez se agruparon en categorías de riesgo de acuerdo con la morbilidad. Una vez confeccionado el índice predictivo se sometió a un estudio de eficacia diagnóstica, y se generaron curvas receptor- operador (ROC, por sus siglas en inglés).
Al índice diseñado se le evaluó la validez de contenido, presentación, construcción y criterio. Fue validado en una muestra aleatoria de 216 pacientes, y comparado con los índices A2DS2 e ISAN.
Este proceso se realizó con el algoritmo incluido en el paquete estadístico SPSS en su versión 25.0 para Windows. Antes de ser incluidos en el estudio, se solicitó a cada paciente, o en su defecto (en caso de deterioro importante de nivel de conciencia o afasia severa), al familiar, su consentimiento informado verbal y escrito. El estudio fue aprobado por el Consejo Científico y Comité de Ética del Hospital.
RESULTADOS
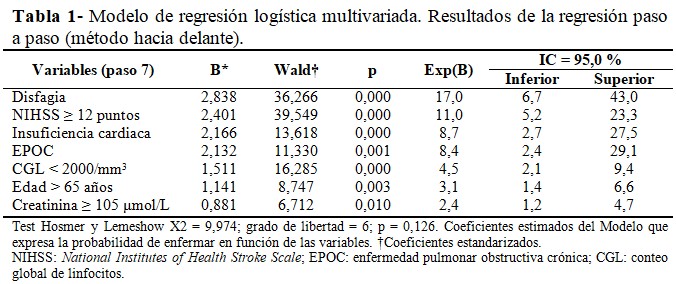
El modelo de regresión logística con todas las variables que constituyeron factor riesgo en el análisis estadístico univariado, mostró mayor relación independiente con el pronóstico de NAI para las variables: disfagia (Exp (B) = 17,0; IC 95 % = 6,7- 43,0; p = 0,000); puntuación en la escala de NIHSS ≥ 12 puntos (Exp(B) = 11,0; IC 95 % = 5,2- 23,3; p = 0,000); y la insuficiencia cardiaca (Exp(B) = 8,7; IC 95 % = 2,7- 27,5; p = 0,000). (Tabla 1).
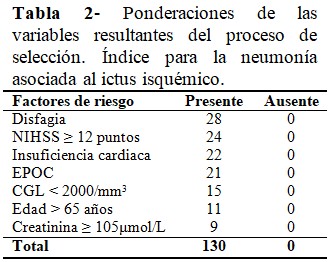
Como resultado de la amplificación de los coeficientes de regresión que se obtuvieron de la regresión logística binaria, las variables que mayor puntuación aportaron al índice fueron la disfagia (28), la escala de NIHSS ≥ 12 puntos (24) y la insuficiencia cardiaca (22). (Tabla 2).
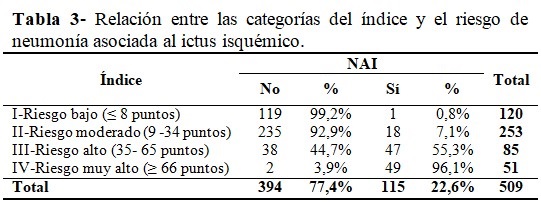
El análisis de la relación entre el nuevo índice dividido en categorías (ordinal) con el riesgo de desarrollar la NAII, aportó un coeficiente Eta de 0,737, lo cual evidenció una buena asociación. En este caso, el 55,3 % de los pacientes con NAII clasificó en la categoría III (riesgo alto) y el 96,1 % en la categoría IV (riesgo muy alto). (Tabla 3).
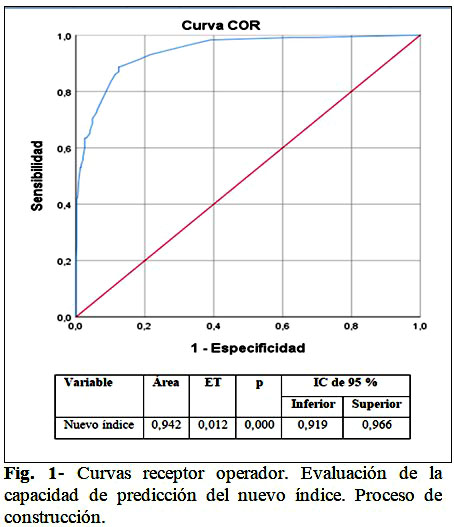
En cuanto a la capacidad de predicción del índice para desarrollar la NAII, el área bajo la curva fue de 0,94 (IC 95 % = 0,91- 0,96; p = 0,000) indicativo de una excelente capacidad discriminativa. (Fig. 1).
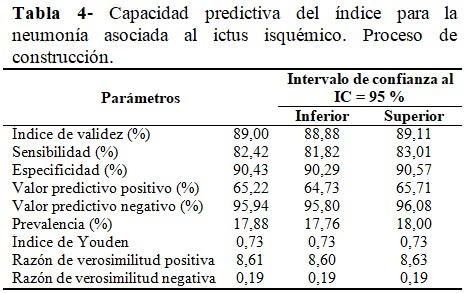
Una evaluación del índice como prueba diagnóstica, aportó que su capacidad para detectar a los pacientes con NAII (sensibilidad) fue de un 82,4 %; además, la probabilidad condicional de que los individuos con la prueba positiva tuvieran realmente la enfermedad (valor predictivo positivo) fue del 65,2 %. (Tabla 4).
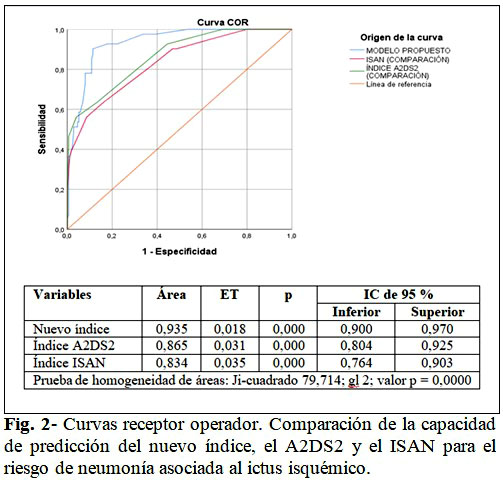
Al comparar la capacidad de predicción del nuevo índice respecto a los índices A2DS2 e ISAN, los tres mostraron una buena área bajo la curva ROC (mayor 0,80), aunque la del índice propuesto fue mayor (0,93) respecto a las áreas de los índices A2DS2 (0,86) e ISAN (0,83). (Fig. 2).
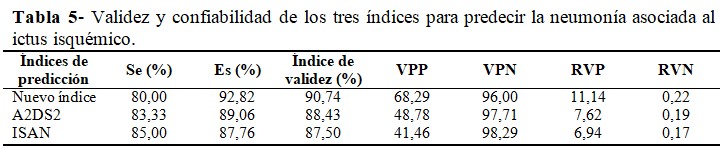
La evaluación de la validez y confiabilidad de los tres índices (nuevo índice, A2DS2 e ISAN) como pruebas diagnósticas, evidenció que el índice propuesto tiene mayor validez y valor predictivo, que le confieren mayor seguridad y utilidad en la práctica clínica (VPP = 68,2; VPN = 96,0). (Tabla 5).
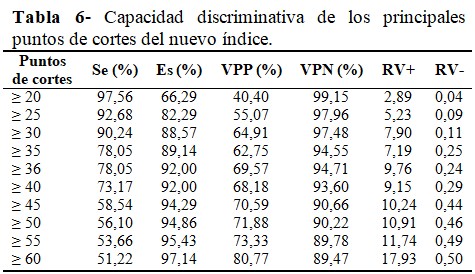
El punto de corte óptimo (umbral diagnóstico) por encima del cual el resultado de la prueba fue considerado como positiva y por debajo de este, negativo fue 36, donde alcanzó una sensibilidad de 78,0 % y una especificidad de 92,0 %. (Tabla 6).
DISCUSIÓN
Los índices de predicción de la NAI tienen como propósito identificar a los pacientes con mayor riesgo de padecerla, para poder establecer medidas preventivas específicas, además de brindar oportunidades con vistas a nuevas intervenciones de seguimiento o terapia; y de ese modo tratar de disminuir su incidencia, reduciendo el pronóstico desfavorable asociado a esta complicación. Por tal motivo, un índice de riesgo ideal debe incorporar variables que estén fácilmente disponibles al momento de presentarse el paciente con ictus; ser de rápida aplicabilidad; estar basado en criterios diagnósticos estandarizados; proporcionar categorías de riesgos significativas con un rendimiento aceptable; así como poseer un claro impacto en la toma de decisiones clínicas y el resultado clínico final en el paciente.(14,15)
En una profunda revisión sistemática, Kishore y colaboradores(14) identificaron nueve índices clínicos para predecir la NAI a punto de partida de ocho cohortes de derivación. Describen que las puntuaciones de estos índices varían considerablemente según la complejidad, las variables que los componen, las características de las cohortes de derivación, el enfoque o criterio empleado para definir la NAI, la facilidad para su aplicación, la coherencia en su validez externa y en la evaluación del desempeño.
Por otra parte, varios de estos índices derivan de cohortes relativamente pequeñas, lo cual limita su generalización. La mayor parte de las puntuaciones de esos índices se obtuvieron mediante análisis de estudios retrospectivos basados en registros de casos, no diseñados inicialmente con el propósito de estudiar la NAI, por ello la construcción de los índices estuvo limitada por las características iniciales registradas en las diferentes cohortes.(14) Por los motivos anteriores, Kishore y colaboradores(13) concluyen que la utilidad de dichos índices para el posible empleo en estudios de intervención preventiva y en la práctica clínica continúa siendo incierta, y sugieren realizar mayores estudios. En esta investigación se coincide con el criterio de estos investigadores, lo cual motivó, de hecho, su realización.
Los índices más validados y utilizados son el A2DS2, el ISAN y el AIS-APS.(16,17,18) Tanto el A2DS2 como el ISAN fueron empleados en la actual investigación para realizar el proceso de validación. El índice A2DS2 fue diseñado por Hoffmann y colaboradores(6) a partir de un estudio retrospectivo; los criterios diagnósticos de neumonía empleados fueron criterios clínicos; la frecuencia de neumonía fue de 7,2 %; está constituido por cinco componentes de los cuales algunos coinciden con los del índice propuesto en esta investigación, como: la edad > 75 años, pero en este caso con un punto de corte superior; la presencia de disfagia; y la gravedad del ictus medido mediante la escala de NIHSS. En la citada escala se incluyen las variables fibrilación atrial y sexo masculino, que en la actual investigación no alcanzaron la fuerza de asociación suficiente para figurar entre los factores con influencia independiente.
Tanto las características basales de la población estudiada, como los criterios diagnósticos de neumonía y la frecuencia de neumonía, difieren de la presente investigación, motivo por el cual alcanzó mejor poder de discriminación.
Smith y colaboradores(5) diseñaron el índice ISAN, estudio de cohorte prospectiva multicéntrico que incluyó a pacientes con ictus isquémico y a pacientes con hemorragia intracerebral; los criterios diagnósticos de neumonía empleados fueron criterios clínicos no estandarizados; la frecuencia de neumonía fue de 6,7 %; la escala está constituida por cuatro componentes. Llama la atención que, a diferencia de la mayoría de los demás índices, no integra la variable disfagia (con importante papel en la fisiopatología); se restringe el número de factores pronósticos a considerar, lo que pudiera subestimar el riesgo de desarrollar la NAI.
Por otra parte, Ni y colaboradores(19) en una revisión sistemática y metaanálisis publicada a finales del año 2021, que incluyó 19 estudios con 35849 pacientes, identificó que las puntuaciones agrupadas de las sensibilidades fueron de 78 % para el A2DS2; y de 79 % para el ISAN. Las puntuaciones agrupadas de las especificidades alcanzaron 73 % para el A2DS2; y 74 % para el ISAN; por lo que concluyó que ambos índices tienen moderada capacidad de predicción de la NAI.(19)
La seguridad de una prueba está determinada por sus valores predictivos positivos (VPP) y negativos (VPN). Estos índices son importantes para valorar la utilidad de una prueba en el terreno clínico y de manera individualizada, es decir, para cada paciente, contrario a la información suministrada por la sensibilidad y la especificidad (estas carecen de utilidad en la práctica clínica, sobre todo cuando se trata de un índice con variables continuas). El índice propuesto tiene mayor VPP, lo cual determina su mayor utilidad en el terreno clínico respecto a los índices A2DS2 y el ISAN. Además, tiene un índice de eficiencia pronóstica (razón de verosimilitud) superior a los índices con los cuales se compara.
Sus elementos de referencia estadísticos, dados por su mayor capacidad de predicción, mayor seguridad y eficiencia pronóstica, además de su consistencia interna (cuantificada por medio del coeficiente Alfa de Cronbach), demuestran su factibilidad y seguridad para su empleo en la práctica asistencial.
Incluye también dos nuevos componentes, el CGL y la cifra de creatinina, no integrados en estos principales nueve índices, lo cual permitió estimar mejor el riesgo en los pacientes investigados; sin embargo, cabe destacar que estos componentes ya forman parte de dos índices desarrollados en los últimos tres años.(20,21)
Recientemente, Zhang colaboradores(20) desarrollaron y validaron un índice novedoso para predecir la NAI en pacientes con ictus isquémico sometidos a tratamiento endovascular. Dicho índice stroke history, dysphagia, lymphocyte count (SDL) contiene entre sus componentes el recuento de linfocitos. En esa investigación se evaluaron varios parámetros sanguíneos correlacionados con la NAI, los cuales incluyeron la RNL, la relación plaquetas/linfocitos (RPL) y la relación monocitos/linfocitos (RML) como marcadores de inflamación. El análisis multivariado del recuento de linfocitos fue el único parámetro sanguíneo evaluado que alcanzó significación luego del ajuste por factores confusores,(20) similar a los resultados alcanzados por esta investigación cuando determinadas variables no fueron incluidas en el análisis estadístico posterior por colinealidad e interacción.
Existe suficiente evidencia científica que demuestra en los momentos actuales la inmunodepresión inducida por el ictus isquémico mediante la activación del sistema nervioso simpático (SNS), el sistema nervioso parasimpático (SNP) y el eje hipotálamo-hipófisis-suprarrenal (EHHS) como la principal causa relacionada con el desarrollo de la NAI.(22,23,24,25,26) Estos cambios inmunológicos se han denominado síndrome de inmunodepresión inducida por el ictus (SIDII), asociado claramente con la gravedad clínica del ictus isquémico (evaluado mediante la escala de NIHSS) y con el tamaño de la lesión, tanto en estudios experimentales como en la práctica clínica.(23,24,25,26) Este síndrome se caracteriza por linfopenia, disminución de los niveles de citocinas inflamatorias, disfunción de monocitos y linfocitos, además de atrofia de órganos linfocitarios secundarios.(22,23,26)
Al igual que la actual investigación, la alteración en la cifra de creatinina como componente del índice forma parte del índice recientemente publicado por Wang y Wu,(21) lo cual está explicado por la respuesta fisiopatológica sistémica al ictus isquémico. La hiperactivación autonómica inducida por al ictus isquémico aumenta la actividad simpática y la inflamación sistémica, alterando la homeostasis renal.(29) Los pacientes con ictus isquémico pueden desarrollar una lesión renal aguda, definida por disminución del ritmo diurético, o aumento de la creatinina sérica dentro de las primeras 48 horas.(30,31)
Se concluye que el nuevo índice está compuesto por parámetros fiables, fácilmente disponibles y con posibilidades de ser aplicado en las primeras 24-48 horas del ictus isquémico, por lo que constituye una herramienta útil y confiable para su empleo en la práctica clínica.
Conflicto de interés:
Los autores declaran que no existen plagios, conflictos de interés ni conflictos éticos.
Contribución de los autores:
Conceptualización: Alexis Suárez Quesada
Curación de datos: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés Quesada Vázquez
Análisis formal: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés Quesada Vázquez
Investigación: Alexis Suárez Quesada, Alexis Álvarez Aliaga, Andrés Quesada Vázquez
Metodología: Alexis Suárez Quesada, Andrés Quesada Vázquez, Alexis Álvarez Aliaga
Validación: Alexis Álvarez Aliaga, Andrés Quesada Vázquez
Redacción – borrador original: Alexis Suárez Quesada
Redacción – revisión y edición: Alexis Álvarez Aliaga, Andrés Quesada Vázquez
Financiación:
La investigación no contó con financiamiento externo.