INTRODUCCIÓN
Según el Centro Internacional de Investigaciones sobre el Cáncer, perteneciente a la Organización Mundial de la Salud (OMS), se ha estimado en el 2020 poco más de 19 millones de nuevos casos de cáncer en el mundo, cifra donde América Latina y el Caribe aportan el 7,6 %.(1)
El dolor oncológico es uno de los síntomas más frecuentes en pacientes en estadios avanzados de la enfermedad, padecido por alrededor del 69 % de ellos. Este puede ser de tipo nociceptivo somático o visceral, neuropático y mixto.(2) Las causas del dolor oncológico pueden ser diversas y sus manifestaciones localizarse indistintamente en el organismo, donde la invasión tumoral por lo general se produce inicialmente en las estructuras cercanas, dentro de las que se pueden mencionar: los elementos vasculares y nerviosos; intestinos; vísceras huecas y macizas; y el componente óseo, entre otros. El inadecuado manejo del dolor incide en la calidad de vida, y trae aparejado visitas permanentes a los servicios sanitarios, con altos costos en general.(3) Es por eso que se precisa de una evaluación individualizada y sistemática de la situación clínica y psicológica del paciente, con el objetivo de mejorar su estado físico y emocional; crear un clima favorable de interrelación y empatía que permita proporcionar suficiente información personalizada y concisa. Si el paciente se involucra asumiendo una actitud positiva, la respuesta al tratamiento será más eficaz.
Históricamente se han empleado numerosos procedimientos terapéuticos de diversa naturaleza para aliviar el dolor oncológico. La OMS estableció la escalera de tres pasos para aliviar el dolor del cáncer en adultos: paso 1) Para dolor persistente leve, analgésicos no opioides (AINES y paracetamol); paso 2) Para dolor moderado, análgésicos opioides suaves (tramadol, codeína); y paso 3) Para dolor moderado a severo, analgésicos opioides fuertes, de los cuales la morfina es el prototipo.(4)
El Comité de Expertos de la OMS en drogodependencia (2015) identificó a la ketamina como un medicamento tanto anestésico como analgésico, el cual sigue siendo importante a escala global, dado su perfil de seguridad y costo conveniente.(5) La ketamina ha demostrado ser una droga multiuso, que en dosis bajas presenta efectos analgésicos y antidepresivos;(6) y la literatura soporta su uso como una buena opción no opiodea para el manejo del dolor de diferente origen,(7,8,9) sin deteriorar funciones respiratorias y hemodinámicas; pero al ser catalogado todavía como un anestésico, las políticas de uso y protocolos deben ser desarrolladas por las instituciones de salud.(10) Por sus propiedades farmacodinámicas, cada vez más es empleada fuera del campo quirúrgico, y se aplica en el manejo del dolor agudo y crónico.(11) La preocupación proviene de sus efectos secundarios potenciales, principalmente hipertensión arterial y los psicomiméticos, como trastornos visuales y auditivos que alteran la percepción del entorno, encontrados principalmente durante la administración intravenosa y por tiempos prolongados.(3)
La creciente demanda de nuevos analgésicos y sustancias neuromoduladoras en general para el tratamiento del dolor hace necesario estandarizar el uso de estos, así como potenciar el desarrollo de nuevas fórmulas de utilización para los fármacos clásicos.(12)
En Ecuador, los estudios clínicos sobre la ketamina resultan escasos, en particular sobre su utilización en el tratamiento del dolor oncológico. Por lo general, las investigaciones sobre este tema giran en torno a su uso en el tratamiento de los dolores agudos en las emergencias médicas. Por su parte, la Dirección Nacional de Normatización del Ministerio de Salud Pública del Ecuador estableció en 2017 el uso de ketamina levógira como analgésico para el dolor oncológico refractario, bajo supervisión de un especialista en el alivio del dolor o en medicina paliativa.(13)
Así, puede constatarse la pertinencia e importancia de profundizar en las investigaciones sobre el tema. Por lo antes expuesto, el presente trabajo puede contribuir a la puesta en práctica de la ketamina como analgésico válido a considerar dentro de las opciones terapéuticas.(14) Por ello, el objetivo es realizar una revisión de la literatura científica actual sobre las potencialidades de la ketamina en el tratamiento del dolor oncológico.
MÉTODOS
Se realizó un estudio descriptivo, con diseño no experimental, longitudinal, el cual mediante la revisión documental en torno al tema de la ketamina en el manejo del dolor oncológico, permitió desarrollar una revisión sistemática de artículos científicos publicados en el período 2010-2019. Para ello fue aplicada la metodología PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses), según la cual fue desarrollado el proceso de extracción, búsqueda y elegibilidad. Los criterios de inclusión se establecieron con base en la guía PICOS (pacientes, intervenciones, comparación y resultados):
Pacientes: de ambos sexos, mayores de 20 años, con dolor oncológico en cualquier órgano o parte del cuerpo.
Intervenciones: basadas en el uso de ketamina en uno o más grupos de pacientes con dolor oncológico.
Comparación: estudios donde se compararon dos grupos; o donde no se estableció comparación.
Resultado: debieron plantear el efecto observado con el uso de ketamina.
Diseño de los estudios: artículos originales, en los cuales se evaluó eficacia del uso de ketamina en el manejo del dolor oncológico.
Criterio temporal para la selección de estudios: publicados entre 2010 y 2019.
Criterio lingüístico: estudios publicados en español o inglés.
Criterio de salida: registro de un mismo artículo en más de una base de datos.
Las fuentes de información utilizadas: Medline, Embase, Cochrane, Pubmed, Scielo, Evidentia y Dialnet. Como términos de búsqueda, se emplearon los descriptores: KETAMINA (KETAMINE), DOLOR ONCOLÓGICO (CANCER PAIN), y MANEJO DEL DOLOR (PAIN MANAGEMENT); además del conector booleano AND.
Para la selección de los estudios, realizada por dos investigadores que evaluaron de forma independiente los resultados de la búsqueda, se siguieron los siguientes criterios: Inicialmente, la búsqueda abarcó ensayos clínicos controlados aleatorizados, revisiones sistémicas y narrativas, y guías clínicas, entre otros publicados a texto completo en el rango de tiempo establecido. Después de ajustar la duplicación, se procedió a la extracción de datos (lista de extracción), o sea, los artículos fueron sometidos a los criterios de elegibilidad ya descritos. En este momento se registraron los siguientes datos: autor, año de publicación, contexto del estudio (país), tipo de estudio, edad de los sujetos, régimen de ketamina, seguimiento, diseño y principales resultados.
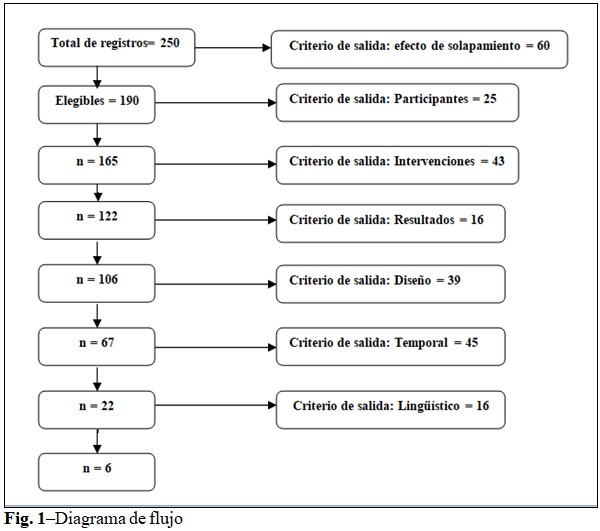
Ya eliminados los registros duplicados, se recuperaron 190 artículos (elegibles), los cuales fueron sometidos al proceso de extracción según los criterios de inclusión antes mencionados. Resultaron seis(15,16,17,18,19,20) los registros que finalmente fueron evaluados para dar cumplimiento al objetivo del trabajo. (Fig. 1).
RESULTADOS
De un total de 250 artículos encontrados en la búsqueda inicial, fueron seleccionados 6, al considerar los criterios de selección muestral. Los criterios que más se relacionaron con la salida de artículos, fueron el efecto de solapamiento y el temporal. (Fig. 1).
Aunque la búsqueda abarcó el periodo 2010-2019, los artículos objeto de análisis se ubicaron entre los años 2011 y 2017, y siempre en contextos de países desarrollados: 2 en Estados Unidos, 2 en España, uno en Francia y uno en Australia. Todos ellos sumaron un total de 742 pacientes estudiados.
De los estudios revisados, 3 usaron KTM combinada con otro fármaco (amitriptilina, fentanilo y morfina respectivamente); y en 3 emplearon placebo. El tiempo de seguimiento varió entre 6 semanas y 3 días. En general, las vías y regímenes de administración fueron variados, así como la eficacia en la analgesia. Se obtuvieron respuestas positivas por cualquier vía de administración, excepto la tópica (Gewandter, 2014), variante aplicada precisamente en el estudio de mayor alcance. (Tabla 1).
DISCUSIÓN
Como en cualquier revisión, este estudio estuvo limitado por el sesgo de publicación y la insuficiencia de estudios concluyentes de sustancial evidencia científica sobre el uso de la ketamina en el dolor oncológico. El análisis de los artículos permitió resumir información relevante sobre el uso de la ketamina, tales como características bioquímicas; farmacocinética y farmacodinámica; mecanismo molecular en el manejo del dolor; y concretamente sus particularidades en la práctica clínica.
Características bioquímicas de la ketamina
La ketamina es un derivado de la fenciclidina (PCP) que muestra una estructura quiral consistente en dos isómeros ópticos (enatiómeros S+ y R-), cuya fórmula química es C13H16ClNO y peso molecular de 274,4. Actúa bloqueando selectivamente el canal del receptor N-metil-D-Aspartato (NMDA) involucrado en la transmisión y modulación del dolor, inhibiendo la afluencia de Ca2+ y la activación intracelular consecuente de segundos mensajeros, prostaglandinas y óxido nítrico.(21,22) El complejo receptor-canal NMDA se encuentra estrechamente ligado al desarrollo de la percepción central de la sensibilidad desde el cuerno dorsal de las neuronas que transmiten señales de dolor. Se ha documentado que el enantiómero S+ tiene mayores propiedades anestésicas y analgésicas, de hasta cuatro veces por sobre el enantiómero R-. En animales existe otro efecto analgésico de la ketamina a través del agonismo de los receptores opioides l, d y j a dosis altas.(23) Además de bloquear el canal receptor de NMDA, la ketamina tiene otras acciones, algunas de las cuales pueden contribuir a su efecto analgésico, efectos opioides y antinflamatorios como la acción en otros canales de calcio, potasio y sodio ( p. ej. HCN, AMPA), transmisión colinérgica, dopaminérgica y noradrenérgica, así como vías inhibitorias descendentes.(24)
Farmacocinética y farmacodinámica de la ketamina
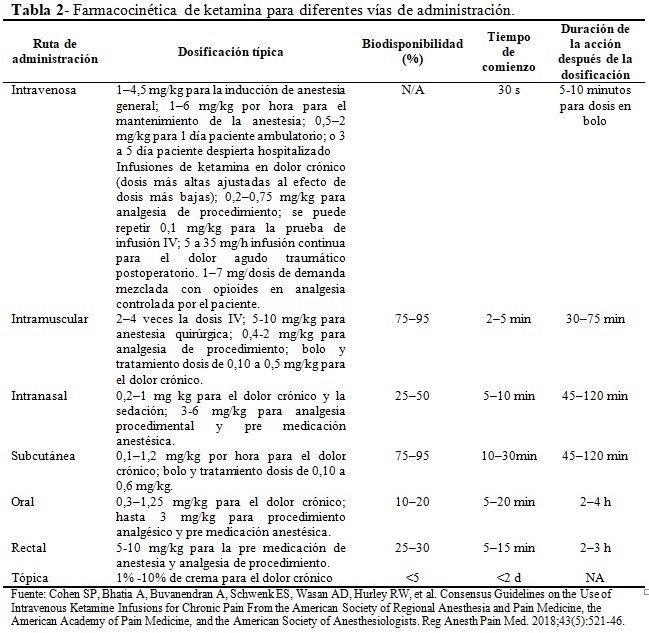
La ketamina es hidro y liposuble, lo que la convierte en un fármaco para administración por diferentes vías que incluyen la intravenosa, intramuscular, insuflación / intranasal, inhalatoria, oral (elixir o pastillas compuestas), tópico(25) y rectal. Según estas vías, la biodisponibilidad y dosificación es muy variable; alcanza su concentración máxima en promedio alrededor de los 15 minutos y con una vida media de 2 a 3 horas.(26) (Tabla 2). En el estudio de Gewandter y colaboradores, de fase III, aleatorizado, controlado con placebo y uso tópico de la ketamina en 462 sobrevivientes de cáncer, no se encontró ningún beneficio en el alivio del dolor secundario a neuropatía por quimioterapia.(16)
Estas propiedades farmacocinéticas de la ketamina permiten una rápida y amplia distribución en todo el cuerpo y cruce de la barrera hematoencefálica. La ruta del metabolismo pasa a través de enzimas microsomales hepáticas, a expensas, principalmente, del citocromo P450, con aproximadamente 12 % restante unido a proteínas plasmáticas. El fármaco se metaboliza rápidamente a norketamina, hydroxynorketamina y dehydronorketamina. Norketamina es un metabolito activo que posee de un quinto a un tercio de la actividad en el receptor NMDA y 2R, 6R hidroxicetamina, siendo un inhibidor activo en la AMPA glutamato y subtipo α7 del receptor colinérgico nicotínico, lo que puede contribuir a los efectos antidepresivos. La excreción de la ketamina inalterada (4 %) y sus metabolitos se realiza a través de la orina.(22)
En cuanto a los efectos adversos y reacciones indeseables de la ketamina, la evidencia consultada concuerda que es dosis dependiente.(3,27) En uso subanestésico a corto plazo se reportan con menor frecuencia los efectos psicomiméticos (disforia, alucinaciones, pesadillas, y sueños vívidos), visión borrosa y diplopía; con mayor frecuencia náusea y vómito.(26) Las secuelas de su uso a largo plazo no están bien definidas, pero los estudios consultados reportaron síntomas de deterioro cognitivo en memoria de trabajo y memoria a corto plazo. Así mismo, síntomas del tracto urinario inferior, como disuria, dolor suprapúbico y hematuria dolorosa;(14,28) y del tracto digestivo, se refieren dolor abdominal de variable intensidad y hepatotoxicidad.(29) No está claro por qué las sustancias disociativas —como la ketamina— son adictivas; ello puede ser atribuible a las sensaciones agradables resultantes de su uso, así como al hecho de que la actividad de la dopamina aumenta con la administración de ketamina, aunque se desconoce aún su mecanismo exacto, pero tal vez se deba a la liberación de dopamina de los sitios de almacenamiento.(14) (Tabla 2).
Mecanismo molecular de la ketamina en el manejo del dolor
En la investigación del dolor crónico se han descrito varios procesos fisiológicos como la pérdida de las vías descendentes inhibitorias de señales dolorosas (umbral del dolor), activación de células inmunes en la espina dorsal, liberación de citoquinas inflamatorias, cambios funcionales en la actividad neuronal (neuroplasticidad) y fosforilación y regulación de receptores nicotínicos. Algunos de estos procesos se han visto modulados por la ketamina como parte de sus propiedades analgésicas. Un proceso crítico en el dolor crónico son los cambios neuronales frente a la sensibilización, tanto central como periférica, donde las neuronas experimentan cambios de acoplamiento al dolor en presencia, intensidad, duración y frecuencia, relacionados con los receptores nicotínicos. El bloqueo de ketamina de la corriente de estos receptores puede, por lo tanto, atenuar la inducción de la plasticidad sináptica y la prevención de los cambios funcionales en las neuronas centrales asociados con el mantenimiento de los estados de dolor crónico.(30)
El complejo receptor-canal NMDA está estrechamente involucrado en el desarrollo de la sensibilización central proveniente de la vía dorsal de las neuronas de la médula espinal que transmiten las señales del dolor. La ketamina inhibe selectivamente este receptor, aunque también se enlaza a un segundo sitio asociado a la membrana que disminuye la frecuencia de apertura del canal. En los potenciales normales de membrana en reposo, el canal está bloqueado por el magnesio. Cuando el potencial de membrana en reposo se modifica como resultado de una excitación prolongada, el canal se desbloquea y el calcio se mueve hacia la célula. Esto conduce a la hiperexcitabilidad neuronal y resulta en hiperalgesia y alodinia; y una reducción en la capacidad de respuesta a los opioides. Estos efectos probablemente estén mediados por la formación intracelular de óxido nítrico y monofosfato de guanosina cíclica.
En un estudio prospectivo, aleatorizado, doble ciego, se reporta que la ketamina tiene propiedades inmunomoduladoras igual que la morfina, que afectan a las células inmunitarias, incluidos macrófagos, células T y natural killer; ello suprime directamente la producción de citoquinas pro inflamatorias en la sangre; y evita la producción inducida por lipopolisacáridos de TNF-a, IL-6 y IL-8. Se concluye que, como la morfina, la ketamina suprimió de forma dependiente a la dosis la IL-2 y IFN-g de los linfocitos T activados en pacientes con dolor refractario por cáncer, in vitro.(31,32)
Ketamina en la práctica clínica del dolor oncológico
El tratamiento del dolor oncológico ha pasado por varios estudios clínicos, y probado diversos agentes analgésicos, desde AINEs hasta antidepresivos y opioides; y son estos últimos los de elección. Independientemente del tratamiento, la eficacia es limitada, con solo 30 a 40 % de los pacientes que muestran una respuesta adecuada en el alivio del dolor. En las últimas décadas la ketamina en dosis subanestésicas se está utilizando fuera de su indicación oficial como anestésico exclusivamente, para coadyuvar el tratamiento del dolor moderado a severo,(33,34) incluyendo el que se presenta en pacientes con cáncer, algunas veces agregando benzodiazepinas y/o agonistas a2-adrenérgicos para minimizar los efectos picotrópicos de agitación, alucinaciones y ataques de pánico causados por la ketamina, aunque estos son dosis dependientes.(35)
Según los últimos estudios realizados por la American Society of Regional Anesthesia and Pain Medicine (ASRA), la American Academy of Pain Medicine (AAPM), y la American Society of Anesthesiologists (ASA), se han determinado pautas de consenso sobre el uso de la ketamina en el manejo del dolor crónico.(26) (Tabla 3).
Conforme a la evidencia analizada en el presente trabajo, en tres de los seis estudios evaluados no se confirma la efectividad de la ketamina. No obstante, en dosis subanestésica aún podría considerarse su uso para el manejo del dolor oncológico, toda vez que los estudios clínicos desarrollados hasta la presente fecha han manejado poblaciones pequeñas y contextos muy variados, tanto en lo referente a las características del paciente, como a los instrumentos y modos de evaluar el dolor percibido, las vías y regímenes de administración; por tanto, los resultados pueden cambiar a medida que surja una mejor evidencia. Las decisiones sobre las indicaciones de la ketamina, el entorno, parámetros a utilizar, cómo controlar sus efectos y minimizar los riesgos en el manejo del dolor oncológico, deben hacerse de manera individualizada y considerando la triada de la intervención basada en la evidencia: soporte de la mejor evidencia científica disponible, experiencia clínica de los profesionales y los valores del paciente.
Conflicto de intereses:
Los autores declaran no tener ningún conflicto de intereses.
Contribución de los autores:
Conceptualización: Secundino González Pardo
Curación de datos: Secundino González Pardo
Análisis formal: Widmark Enrique Báez-Morales
Investigación: Secundino González Pardo
Metodología: Secundino González Pardo, Widmark Enrique Báez-Morales
Administración del proyecto: Secundino González Pardo
Supervisión: Francisco López-Muñoz, Secundino González Pardo
Redacción – borrador original: Secundino González Pardo
Redacción – revisión y edición: Secundino González Pardo, Widmark Enrique Báez-Morales, Francisco López-Muñoz
Financiación:
Ninguna.