INTRODUCCIÓN
El procesamiento de imágenes médicas es un elemento esencial en la radioterapia moderna, ya que garantiza el adecuado diagnóstico de la enfermedad, el delineado más preciso de los blancos y órganos sanos, así como la certera administración del tratamiento. Todo lo anterior avala una mayor probabilidad del éxito del tratamiento.
Cuando se trata de prácticas médicas con radiaciones ionizantes (PMCRI) en las que la automatización ha penetrado con más fuerza, como la radioterapia de intensidad modulada (IMRT, por sus siglas en inglés), la terapia con arcos modulados volumétricamente (VMAT, por sus siglas en inglés) o la radioterapia guiada por imágenes (IGRT, por sus siglas en inglés), el procesamiento de las imágenes adquiere aún mayor relevancia.(1)
En estos casos, la radiación se aplica de manera automatizada empleando las capacidades del equipamiento disponible, sobre los volúmenes de tejido tumoral definidos y ubicados en base a dichos procedimientos. Ello también permite delinear correctamente los órganos de riesgo (OAR), en ocasiones muy cercanos a los volúmenes blancos clínicos y planificados (CTV, PTV). Los OAR, por el contrario, deben ser protegidos durante la aplicación de las dosis de radiación correspondientes. Es por ello que los requerimientos de los equipos contienen niveles de exactitud elevado respecto a las desviaciones permitidas de sus parámetros.(1)
De manera más frecuente, se emplea la tomografía axial computarizada (TC) como modalidad de imágenes médicas para la definición de los blancos y OAR, unido a un proceso de delineado en el que se establecen, sucesivamente, los GTV, CTV y PTV. En el caso de blancos móviles, por ejemplo, cuando la lesión se mueve por la respiración, se definen los volúmenes blancos internos (ITV, por sus siglas en inglés), los cuales engloban los PTV, o se emplean técnicas de gatillado o de seguimiento.(2)
Algunos ejercicios de delineado de blancos entre diferentes radiooncólogos han demostrado la falibilidad asociada a estos procesos, por la gran incertidumbre que se incorpora en la definición del GTV, CTV y/o PTV. Ello está asociado a la experiencia de cada especialista, lo que muestra desviaciones respecto a los blancos, mayores incluso que la exactitud de los campos de irradiación alcanzable por los modernos equipos de radioterapia.(3)
A las incertidumbres globales en el proceso de radioterapia contribuyen diferentes fuentes, tales como los errores de colocación del paciente, el movimiento de órganos inter e intrafracciones, el movimiento del paciente y las mencionadas incertidumbres en la delineación del volumen blanco.(3)
La IGRT aborda las incertidumbres que surgen durante la colocación del paciente en la mesa de tratamiento y el movimiento del paciente y del OAR, por tanto mejora la localización del blanco durante tratamiento. Sin embargo, la reducción de márgenes introducidos con el uso de IGRT está limitada por la capacidad de definir adecuadamente el blanco.(3)
El delineado preciso del volumen blanco es una condición previa para el uso de IMRT, VMAT, IGRT y otras técnicas de radioterapia de alta precisión, donde todos los pasos posteriores en la planificación del tratamiento y la entrega, se basan en los contornos del volumen blanco. La definición inadecuada del blanco introduce un error de localización sistemático que, potencialmente, podría conducir a una reducción de la dosis entregada al tumor, menor control local y/o mayor morbilidad para cada paciente.
Tales incertidumbres pueden socavar, significativamente, la comparación de tratamientos dentro y entre instituciones y la interpretación de la clínica de los estudios. Las incertidumbres en la delimitación del volumen blanco se han demostrado en la mayoría de los sitios de tumores y varios estudios indican que las inconsistencias en la delineación del volumen pueden ser mayores que los errores en los restantes pasos de la planificación y ejecución del tratamiento.
La comparación directa de los datos publicados es difícil, ya que se utilizan varios métodos para cuantificar la variabilidad interobservador. La mayoría de los artículos informan diferentes parámetros para describir la distribución de los volúmenes delineados, incluyendo media, rango, desviación estándar, la relación entre el más grande y el más pequeño volumen delineado (Vmax / Vmin), coeficiente de variación (COV), etc.
La bibliografía reporta una amplia variabilidad interobservador para varios sitios tumorales, y la mayor variación se informa para la delineación del volumen blanco en cáncer de esófago, cabeza y cuello, pulmón, linfoma y sarcoma de Hodgkin. En algunos de estos casos, las relaciones Vmax/Vmin alcanzan valores de 18.(3)
Un análisis detallado de las dificultades de la IMRT, que aún conservan vigencia respecto a las técnicas de imagen, muestra que la tecnología de que se dispone hoy en día para administrar tratamientos IMRT de alta precisión es superior, en muchos lugares, a la capacidad de las técnicas de imagen para precisar los límites del tumor frente a los tejidos sanos.
Para conseguir, en un futuro próximo, una mayor implementación de la IMRT dentro de la oncología radioterápica se debería realizar progresos en diferentes direcciones:(4)
- Posibilidad de una mayor precisión en la delimitación de los volúmenes blanco, tanto de enfermedad macroscópica como subclínica.
- Desarrollo de una nueva generación de sistemas de inmovilización y sistemas de adquisición de imágenes de simulación, en los que se tengan en cuenta los movimientos de órganos durante el tratamiento (imágenes 4-D).
- Nuevas técnicas de optimización en los sistemas de planificación para integración de los márgenes específicos de PTV, según las imágenes adquiridas en la simulación.
- Disponibilidad de nuevas técnicas de imagen para verificación y control de calidad durante los tratamientos, como la radioterapia guiada por RM o por PET, etc.
Todo lo anterior conduce a corroborar la importancia del procesamiento de imágenes en el tratamiento seguro de los pacientes sometidos a radioterapia.
En la rutina de los estudios de riesgo para PMCRI, los modelos de riesgo se preestablecen para las prácticas bajo estudio. Ello quiere decir que, dados los conocimientos de expertos necesarios para elaborar los patrones de riesgo de las prácticas, estos han sido prediseñados en el marco de los diferentes métodos de estudio que se utilizan con este objetivo. De esta forma, ya sea empleando análisis de modos y efectos de fallo (FMEA) o matriz de riesgo, se disponen de modelos para que los analistas de las entidades o los reguladores hagan uso de los mismos con diferentes objetivos, ya sea un informe por requerimiento regulatorio o el desarrollo de ejercicios de optimización de la práctica. Adicionalmente, a través de las bases de datos reactivas se pueden realizar búsquedas selectivas de temas de interés.(5,6,7)
Esta investigación tuvo como objetivo caracterizar los riesgos asociados a los factores tecnológicos y humanos relacionados con el procesamiento de imágenes que pueden afectar a los pacientes sometidos a tratamientos de radioterapia con haces externos.
MÉTODOS
Partiendo de que se cuenta con modelos de riesgo basados en FMEA(7) y matriz de riesgo para la práctica de IMRT, y considerando que esta resulta una de las más aplicadas en el contexto actual de la radioterapia con haces externos, se tomó la misma como base para demostrar el desarrollo del objetivo de esta investigación.
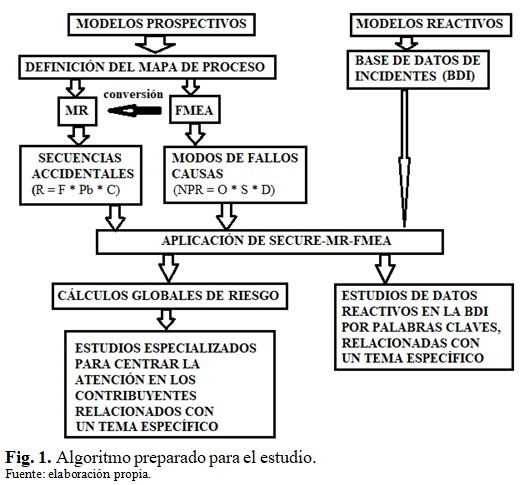
El algoritmo empleado para realizar el estudio se muestra en la figura 1. (Fig. 1).
Los modelos prospectivos para evaluación de riesgo de una PMCRI dada, pueden ser representados a través de matriz de riesgo (MR)(5,6) o de FMEA.(5,7) Cualquiera de ellos comienza con la definición del mapa de proceso, el cual se descompone en todos sus subprocesos. En el caso de la MR, se postulan las secuencias accidentales asociadas a cada subproceso. Cada secuencia accidental está integrada por un suceso iniciador (SI), sus barreras (B) y consecuencias asociadas (C). A partir de magnitudes cualitativas asociadas a los términos SI: F (frecuencia), Pb (probabilidad de fallo de barreras) y C (gravedad), se deducen, desde una matriz tridimensional cualitativa, los niveles de riesgo (R) que alcanza cada secuencia (R = F * Pb * C).(5,6)
Un estudio de riesgo que emplea FMEA necesita identificar los modos de fallo - causas incluidos en cada subproceso. A cada modo de fallo (MF) -causa se asocian parámetros de ocurrencia (O), severidad (S) y no detectabilidad (D), cuyos valores se encuentran en una escala de Lickert entre 1 y 10, y son asignados por un equipo de expertos. En este caso, el número de prioridad de riesgo (NPR) es el resultado de la multiplicación de los valores de O, S y D (NPR = O * S * D).(5,7)
De contarse con una base de datos de incidentes (BDI) con una adecuada taxonomía, es posible realizar estudios de eventos relacionados con un área de interés.
SECURE-MR-FMEA fue el código empleado para esta investigación (ver aplicación en el algoritmo). El mismo contiene facilidades de estudio por métodos prospectivos (MR y FMEA) y por métodos reactivos (BDI). Además, contiene patrones de riesgo para la práctica IMRT en formatos FMEA y MR.(5)
Como resultado de los cálculos globales de riesgo, el sistema puede identificar las secuencias más contribuyentes por su nivel de riesgo, las medidas de defensa más efectivas para el control del riesgo en la práctica (incluye reductores de frecuencia (RF), barreras (B) y reductores de consecuencias (RC) y las consecuencias de mayor magnitud. De manera similar, el código identifica las combinaciones MF-causa más contribuyentes al riesgo de la práctica, así como determina las medidas de defensa que compensan las causas atribuibles a cada combinación, con el empleo de árboles de fallo.
La consistencia del modelo de riesgo por ambas aproximaciones está garantizada con la conversión (ver algoritmo) FMEA-MR, también contenida en el sistema, lo que implica que el modelo de MR a emplear fue el obtenido desde el FMEA de partida.(7)
En esta investigación se emplearon las capacidades del código, que permiten realizar estudios especializados para centrar la atención en los contribuyentes relacionados con un tema específico, lo que incluye caracterización de las secuencias accidentales y modos de fallo relativos a dicho tema. Además, empleando las capacidades de monitoreo de riesgo del código, se cuantificó sobre el modelo de matriz de riesgo de la IMRT, la influencia de la inhabilitación de las defensas relacionadas con el tema de interés.
Se cuenta con una base de datos de incidentes (BDI) que contiene más de 900 registros de accidentes e incidentes relacionados con radioterapia de haces externos.
Sobre la BDI se realizó un estudio reactivo por palabras clave relacionadas con el tema específico, lo que permitió comprender cuál es la representación de dicho tema en la experiencia recopilada.
En este contexto, el tema de referencia es el “procesamiento de imágenes”, sin embargo, el mismo puede ser flexible, y postularse como “garantía de calidad”, “planificación del tratamiento”, “cálculos de dosis” o “dispositivos de inmovilización”, entre otros.
RESULTADOS
El estudio de los modelos de riesgo para IMRT, tanto por FMEA como por MR, muestra que los mismos cuentan con 12 subprocesos, de ellos, 5 relacionados directamente con el procesamiento de imágenes (Simulación de TC, otros estudios previos de imágenes para localización de CTV, transferencia de imágenes y otros datos DICOM, planificación inicial del tratamiento, estudio anatómico para planificación de tratamiento). En dichos modelos pueden identificarse múltiples MF-causa o sucesos iniciadores, en los que el centro de su postulación se relaciona con fallos (humanos o tecnológicos) del procesamiento de imágenes.(7)
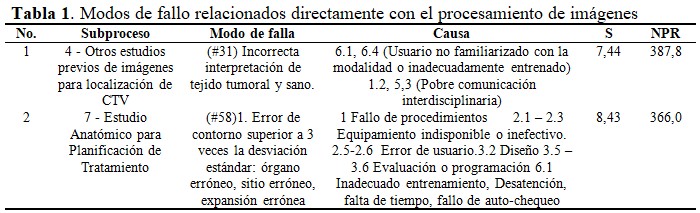
De los primeros 20 contribuyentes resultantes por sus mayores NPR en el FMEA para la IMRT, 9 corresponden a MF – causas, relacionados con el procesamiento de imágenes. Los primeros dos, caracterizados con su orden de aparición, aparecen en la tabla 1.(7) (Tabla 1).
La tabla 2 muestra dos de las secuencias accidentales más importantes relacionadas con el procesamiento de imágenes, obtenidas entre las primeras 20 a nivel de MR. Estas secuencias, relacionadas con el procesamiento de imágenes, corresponden a riesgos altos (A) con consecuencias graves sobre pacientes [PAC(A)]. Como se aprecia, a pesar de desplegarse las medidas de defensa, continúan elevados sus aportes al riesgo. (Tabla 2).
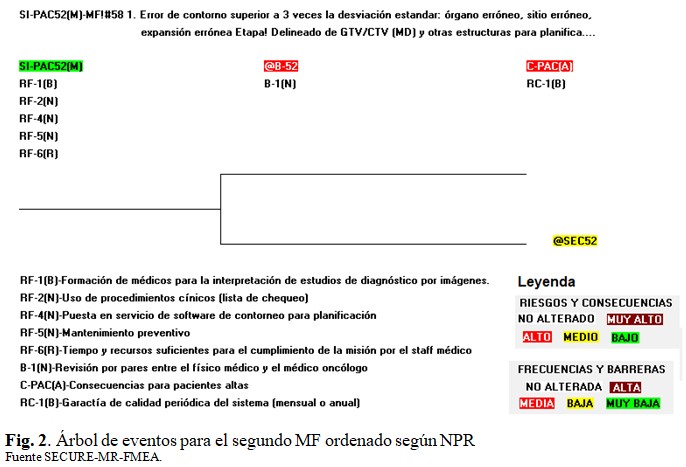
Partiendo de las potencialidades de la conversión FMEA-matriz de riesgo, pueden elaborarse árboles de eventos, como el de la figura 2, la que representa al segundo modo de fallo según TG-100.(7) (Fig. 2).
Algunas de las defensas relacionadas con el procesamiento de imágenes se listan en la tabla 3. Las defensas han sido filtradas empleando las claves “imag” y “contour”, con lo cual se persigue que las relacionadas con imagen y contorneo se identifiquen en los textos. Los códigos de las defensas permiten identificar su tipo (B, RF o RC), además de clasificar las robusteces de cada una (MR- muy robusta, R- robusta, N- normal, B- blanda, I- insignificante). Los resultados de este filtrado de defensas muestran que 6 B, 9 RF y 2 RC están directamente vinculadas al procesamiento de imágenes. (Tabla 3).
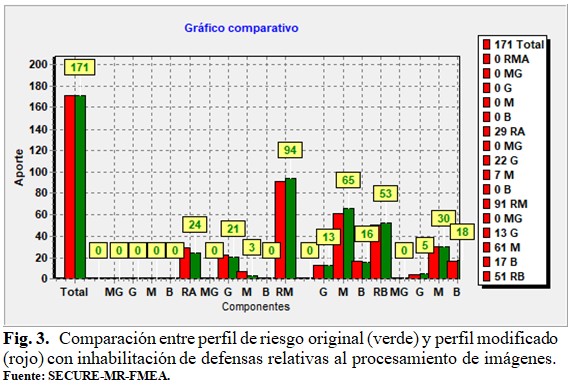
Un estudio de sensibilidad, inhabilitando las defensas relacionadas con el procesamiento de imágenes, se muestra en la figura 3. (Fig. 3).
El procesamiento de imágenes está representado en la base de datos reactiva del código (901 registros) por más de 200 casos, donde 62 contienen el término CT (Computed Tomography) y 11 los términos “PTV, CTV y contour”.(6)
DISCUSIÓN
Las causas mostradas en la tabla 1 permiten inferir aspectos que en las referencias confirman las probables soluciones para estas prioridades de los modos de fallos. La solución a la disminución de las incertidumbres en el delineado del blanco están asociadas a tres grandes áreas: optimización de las imágenes, establecimiento de protocolos y guías de delineación y entrenamientos especializados.(3,4)
Respecto a la optimización de imágenes, el primer modo de fallo muestra el empleo de técnicas de imágenes alternativas como el FDG-PET. Entre las ventajas potenciales de las imágenes funcionales están la reducción de la variabilidad interobservador, la identificación de extensiones tumorales pasadas por alto en TC y/o RM y, posiblemente, la identificación de subvolúmenes GTV que requieren una dosis de radiación más alta. Entre las causas enunciadas en la tabla 1 aparecen fallos de procedimientos.
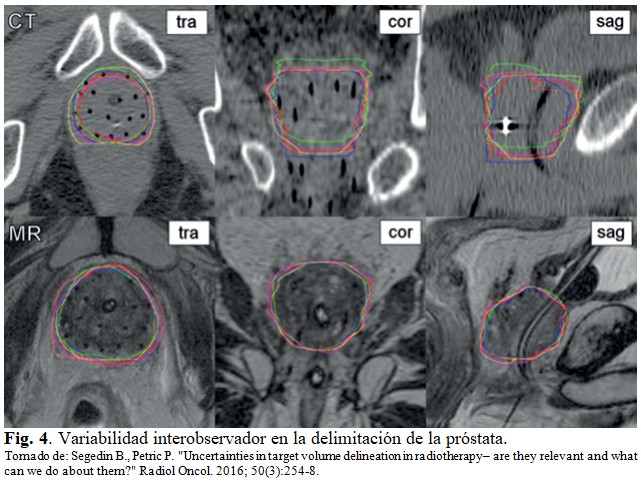
A modo ilustrativo, la figura 4 muestra la variabilidad interobservador para la delimitación de la próstata. En la figura se muestran imágenes de resonancia magnética (RM) y de TC en diferentes planos del mismo paciente. Las aclaraciones TRA, COR y SAG significan, respectivamente, transversal, coronal y sagital. Se aprecia que la variabilidad al definir el vértice, la base y los bordes laterales de la próstata, se reduce con el empleo de las imágenes por RM. (Fig. 4).
Se han publicado pautas de delineación a nivel nacional o internacional para varios sitios tumorales, tanto en radioterapia con haces externos como en braquiterapia. El uso de atlas anatómicos específicos del sitio, pautas de delineación de consenso y protocolos de contorneado estandarizados, disminuyen la variabilidad entre los observadores.(3,4)
También el inadecuado entrenamiento aparece como causa repetida entre estos modos de fallos. Las estadísticas demuestran las necesidades de capacitación entre médicos radiooncólogos, respecto a delineación de blancos y de OAR, así como en la interpretación de imágenes. El primer MF (tabla 1) recalca, como causa, el inadecuado entrenamiento en la interpretación de imágenes no familiares, en este caso, obtenidas desde FDG-PET.(3,4)
Como se muestra en la figura 2, el iniciador desencadena una secuencia accidental que alcanza riesgo medio. No siempre hay concordancia entre las importancias de los modos de fallo-causa en FMEA y de los sucesos iniciadores correspondientes, según MR. Ello se debe a que, en los últimos se incorpora el efecto de las medidas de defensa (RF, B, RC), lo cual no se incluye en la postulación de los MF en las tablas FMEA. En el árbol de eventos pueden apreciarse algunas defensas relacionadas con el procesamiento de imágenes como “Formación de médicos para la interpretación de estudios de diagnóstico por imágenes” y “Puesta en servicio del software de contorneo para planificación”.
Una barrera importante en el control de estos riesgos es la tradicional autoridad del médico en el delineado del blanco. Un ejemplo de esta afirmación se ilustra empleando la figura 2. Si se adiciona a los fallos de las defensas debidos al procesamiento de imágenes (RF-1, RF-4), el fallo de la revisión por pares (B-1), la secuencia alcanza riesgo alto. La situación revela que no es trivial la solución de estas cuestiones, más aún ante escenarios de alta carga de trabajo. El trabajo en equipo debe ser puntal para la seguridad del paciente.
La comparación (figura 3) entre el patrón original de riesgo y el patrón con inhabilitación de defensas, relacionadas con el procesamiento de imágenes, muestra que aparecen 5 nuevos riesgos altos (barras RA) cuando se inhabilitan las defensas relativas al procesamiento de imágenes. Algunas de estas limitaciones pueden ser superadas con el empleo de sistemas híbridos de adquisición de imágenes.(8) Las investigaciones basadas en inteligencia artificial están aportando algoritmos que pueden dar solución a las incertidumbres interobservador respecto a la delineación del volumen blanco, lo que podrá disminuir en un futuro próximo el protagonismo del médico radiooncólogo en esta tarea.(9)
Entre los registros localizados en la base de datos reactiva, destacan los que reflejan delineamiento incompleto de blancos, movimiento de blanco entre fracciones del tratamiento y falta de calidad en la imagen para los sistemas de planificación del tratamiento.
Otra situación que resalta la actualidad del tema abordado, son los hallazgos respecto a imágenes obtenidas con sistemas híbridos en pacientes con COVID-19. Algunos autores reportan imágenes de daño tisular similares a tumores, las que se deben a lesiones producidas por el virus SARS-COV-2. Ello suma dificultades a la definición de los volúmenes blanco para la aplicación de radioterapia con haces externos.(10,11)
Como limitaciones de este tipo de estudio, debe aclararse que no siempre se cuenta con modelos de riesgo en el estado del arte requerido. Además, los modelos de riesgo deben reflejar, lo más fehacientemente posible, a la práctica a modelar.
Desafortunadamente, no existen referencias que permitan realizar comparaciones de esta investigación con estudios similares. Ello está relacionado con limitaciones de los códigos disponibles. La revisión de las bibliografías más representativas sobre evaluación prospectiva de riesgo en PMCRI,(5,7) así como las de evaluación reactiva,(12) muestran restricciones para estudios de este tipo. El SEVRRA, software de referencia para MR, no prevé estudios de inhabilitación dinámica de defensas de diferente naturaleza (RF, B y RC).(5) Para el FMEA, no existe un software disponible a nivel mundial, que abarque las necesidades relacionadas con estos estudios en PMCRI.(7) Respecto a los códigos de estudios reactivos, las limitadas configuraciones prediseñadas para interfaz con el usuario, no permiten análisis por palabras claves, lo cual es una capacidad esencial para este tipo de estudio.(12)
Entre las justificaciones, para el diseño y programación del software SECURE-MR-FMEA, se encuentra la superación de las limitaciones anteriormente citadas. El sistema se encuentra actualmente en fase de acople con un software de evaluación integral de riesgo, promovido por un proyecto del OIEA.(6,13)
Se puede concluir que el análisis de riesgo aplicado a las modalidades de la radioterapia basada en imágenes constituye una herramienta fiable para estudiar la importancia del procesamiento de imágenes en la seguridad de los pacientes durante estos tratamientos.
Los estudios y discusión del procesamiento de imágenes, realizados sobre la base del patrón de riesgo de la IMRT, muestran la correspondencia de la importancia de los contribuyentes y defensas ligados a este procesamiento con las necesidades de su desarrollo, pronosticadas por muchos expertos.
El método propuesto en la investigación puede ser generalizado a otras PMCRI en las que se cuente con modelos de riesgo de partida, ya sean FMEA o matriz de riesgo, aunque el nivel de actualización de los modelos y su representatividad respecto a las prácticas, es un factor importante a tener en cuenta.
La investigación contenida en el artículo, dadas las limitaciones de los códigos disponibles para estudios de este tipo, resulta una novedad científica en el campo de las aplicaciones de los estudios de riesgo a las prácticas médicas con radiaciones ionizantes.
Conflicto de intereses
Los autores declaran que no poseen conflictos de intereses.
Contribuciones de los autores
Conceptualización: Antonio Torres Valle.
Diseño: Antonio Torres Valle, Rodolfo Alfonso Laguardia.
Revisión bibliográfica: Antonio Torres Valle, Rodolfo Alfonso Laguardia, José de Jesús Rivero Oliva.
Recolección de datos: Antonio Torres Valle.
Curación de datos: Antonio Torres Valle, Rodolfo Alfonso Laguardia, José de Jesús Rivero Oliva.
Validación y verificación: Antonio Torres Valle, José de Jesús Rivero Oliva.
Software: Antonio Torres Valle.
Supervisión: Antonio Torres Valle.
Preparación de figuras y tablas: Antonio Torres Valle, Rodolfo Alfonso Laguardia, José de Jesús Rivero Oliva.
Redacción, edición y revisión: Antonio Torres Valle, Rodolfo Alfonso Laguardia, José de Jesús Rivero Oliva.
Financiamiento
Universidad de La Habana. Instituto Superior de Tecnologías y Ciencias Aplicadas. La Habana. Cuba.