INTRODUCCIÓN
La diabetes mellitus (diabetes) constituye un desafío global para la salud y el bienestar de las personas.(1) En el año 2021 la padecían en el mundo 537 millones de personas de 20 - 79 años de edad, y se pronostica que la cifra ascenderá a cerca de 783 millones para el año 2045, lo que representa un incremento de los casos en un 46 %.(2) Como ocurre a nivel global, las estadísticas de Cuba sitúan a la diabetes entre las 10 primeras causas de muerte.(3)
El tipo de diabetes, tiempo de evolución y grado de control metabólico determinan la prevalencia de las distintas complicaciones que se pueden presentar. Entre ellas, la enfermedad cardiovascular tiene un gran impacto en los pacientes diabéticos y constituye la primera causa de mortalidad y morbilidades asociadas.(1) Su base fisiopatológica es la lesión de la pared vascular, pero son escasos los estudios que describen las características histológicas de la lesión inicial en la pared de la aorta, momento en el cual podrían ser factibles terapias preventivas.(4)
En la actualidad, se investigan sustancias con funciones en la protección y reparación de tejidos, como es el caso de la eritropoyetina (EPO). La función primaria de la EPO es estimular la eritropoyesis, pero existen evidencias de sus acciones angiogénicas, antiapoptóticas, antinflamatorias y antioxidantes, así como de la presencia de receptores en el endotelio vascular.(5)
La NeuroEPO constituye una variante hiposiálica de la EPO recombinante humana, sin actividad hematopoyética y con probados efectos neuroprotectores en varios estudios preclínicos y ensayos clínicos.(6) Además, existen evidencias de que la NeuroEPO disminuye la hiperglucemia en ratas con diabetes inducida por la estreptozotocina (STZ). (7) Por lo anterior, el objetivo del presente trabajo fue evaluar el efecto de la NeuroEPO en la aorta de ratas diabéticas.
MÉTODOS
Se realizó un estudio experimental en el Instituto de Ciencias Básicas y Preclínicas Victoria de Girón y la Facultad de Ciencias Médicas, de enero de 2023 a febrero 2024, Se desarrolló en ratas Wistar hembras adultas, con peso inicial de 200 g - 250 g, procedentes del Centro de producción de animales de laboratorio (CENPALAB). El estudio contó con la aprobación del Consejo científico y el Comité institucional para el cuidado y uso del animal de laboratorio.
Los animales se mantuvieron con ciclos de 12 horas luz/12 horas oscuridad, temperatura ambiente de 21 ºC - 23 ºC y libre acceso a agua filtrada y alimento estándar. A un grupo se le administró STZ (SIGMA), 65 mg/kg disueltos en 200 µL de buffer citrato de sodio 0,1 M pH 4,5 por vía intraperitoneal, y una semana después se diagnosticó la diabetes por valores de glucemia superiores a 11 mmol/L.(8) Las determinaciones de la glucemia se realizaron con un glucómetro (SUMASENSOR SXT, Cuba), en sangre venosa obtenida mediante un corte en la punta de la cola de las ratas.
Una vez que las ratas inyectadas con STZ resultaron diabéticas, se formaron los grupos de manera aleatoria, hasta quedar constituidos por cinco animales cada uno; se utilizó un grupo de ratas sanas como control. (Tabla 1). La NeuroEPO y el vehículo (placebo que se utiliza en los ensayos clínicos) fueron proporcionados por Centro de Inmunología Molecular, Cuba, y se administraron por vía subcutánea, en la región dorsal, una vez al día, tres veces por semana durante cinco semanas, para un total de 15 dosis.
Seis días después de administrar la última dosis de NeuroEPO y vehículo, se determinó la glucemia y se practicó la eutanasia, mediante desangrado (punción intracardiaca) bajo anestesia (tiopental sódico 50 mg/kg intraperitoneal). De cada animal se extrajo un fragmento de la aorta abdominal y se colocó en formalina para su fijación y posterior inclusión en parafina.(9)
Estudio histológico de la aorta
De los bloques de parafina se realizaron cortes histológicos de 5 µm de espesor (con micrótomo Histo-Line Laboratories MR300, Italia). Por cada animal se colorearon dos láminas con hematoxilina y eosina (H/E) y dos láminas con la coloración de orceina (para fibras elásticas). En cada corte se analizó todo el anillo aórtico, a 40x, 100x y 400x de magnificación, con un microscopio óptico (Motic BA210, China). Se tomaron imágenes digitales con una cámara (Moticam 3, China) acoplada al microscopio, y se guardaron en formato .jpg en una computadora (Acer) para su análisis.
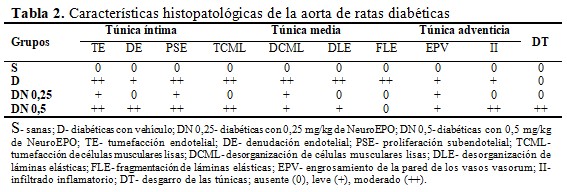
El estudio histológico cualitativo de la aorta incluyó la forma, el aspecto y la organización general de las túnicas íntima, media y adventicia. Cada signo histopatológico se clasificó en ausente (0), leve (+), moderado (++) o severo (+++), según su presencia, número de animales en que se identificó y extensión de tejido afectado.
Se consideraron signos de alteraciones estructurales de la túnica íntima la presencia de:
- Tumefacción endotelial: células endoteliales aumentadas de tamaño, con citoplasma claro u opaco (turbio), con presencia o no de vacuolas, y núcleos que protruyen a la luz de la arteria o aumentados de tamaño (coloración H/E).
- Denudación endotelial: pérdida de células endoteliales (coloración H/E).
- Proliferación subendotelial: aumento del grosor de la capa subendotelial, por acumulación de células (macrófagos, leucocitos, musculares), fibras o ambas (coloración H/E).
Se consideraron signos de alteraciones estructurales de la túnica media la presencia de:
- Tumefacción de células musculares: células aumentadas de volumen, con citoplasma claro u opaco (turbio), con presencia o no de vacuolas, y núcleos aumentados de tamaño (coloración H/E).
- Desorganización de células musculares: disposición irregular de los núcleos de las células musculares (coloración H/E).
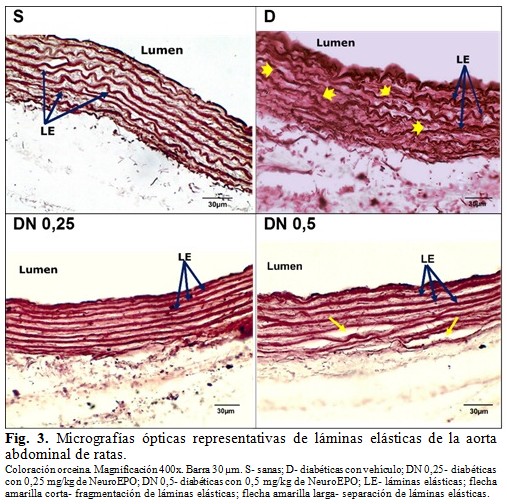
- Desorganización de las láminas elásticas: láminas elásticas con apariencia disgregada (coloración orceina).
- Fragmentación de las láminas elásticas: láminas elásticas discontinuas (coloración orceina).
Se consideraron signos de alteraciones estructurales de la túnica adventicia la presencia de:
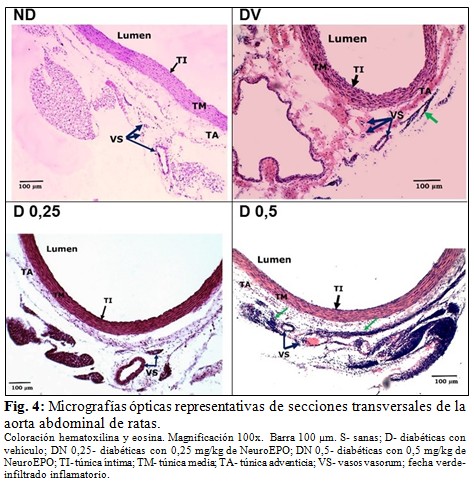
- Infiltrado inflamatorio: presencia de leucocitos, macrófagos o ambos (coloración H/E).
- Vasos sanguíneos con dilatación, engrosamiento de la pared o congestión (coloración H/E).
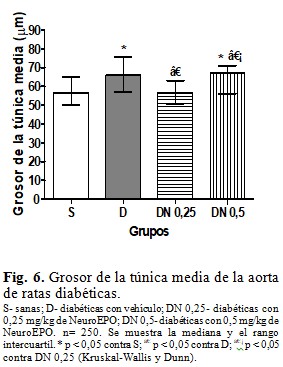
Se determinó el grosor de la túnica media (µm), como la distancia desde la lámina elástica externa hasta la lámina elástica interna; de cada animal se realizaron 50 mediciones, que abarcaron diferentes zonas de diferentes anillos aórticos. Se utilizaron las láminas coloreadas con orceina, una magnificación de 400x y el programa ImageJ.(10)
Procesamiento estadístico
Para el análisis estadístico de la glucemia en ayuno y el grosor de la túnica media se utilizó el programa GraphPad Prism, versión 5.01. La distribución de las variables se analizó con la prueba Kolmogorov Smirnov. Las comparaciones de la glucemia se realizaron con las pruebas análisis de la varianza (ANOVA) de dos factores seguida de Bonferroni, y para comparar el grosor de la túnica media se emplearon las pruebas Kruskal-Wallis y Dunn. Los resultados se expresaron con estadígrafos descriptivos de tendencia central y dispersión. Las diferencias se consideraron significativas con valores de p < 0,05.
RESULTADOS
Glucemia en ayuno
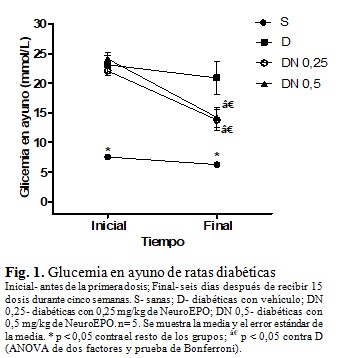
Antes de administrar la primera dosis de NeuroEPO y vehículo, la glucemia en ayuno fue superior a 11 mmol/L en los tres grupos de ratas diabéticas, sin diferencias entre ellos. Después de aplicar las 15 dosis, los grupos que recibieron la NeuroEPO presentaron cifras de glucemia mayores que el S (sanas), pero menores que el D (diabéticas con vehículo). (Figura 1).
Valoración histológica cualitativa de la aorta
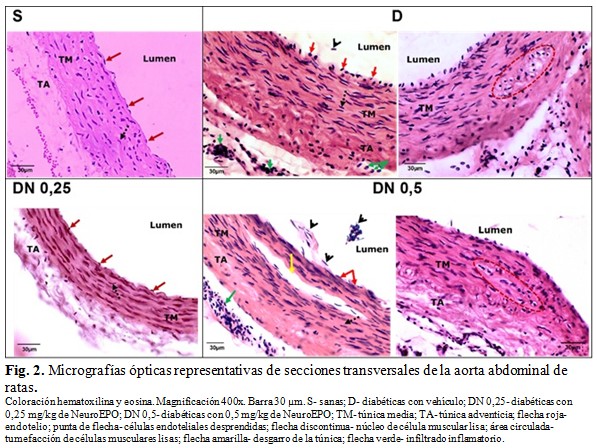
En el grupo S, las secciones histológicas de la pared aórtica abdominal mostraron todas sus túnicas conservadas. En la íntima se evidenció la monocapa de células endoteliales continua, bien aplanada, y una capa subendotelial fina. En la túnica media se observaron las células musculares lisas sin signos de tumefacción u otras alteraciones estructurales, y las láminas elásticas continuas, en número de 8 - 12. La adventicia se apreció delgada, con escasos vasos sanguíneos, sin alteraciones estructurales, y no se encontró infiltrado inflamatorio. (Tabla 2, Fig. 2, Fig. 3 y Fig. 4).
En el grupo D, la túnica íntima presentó un endotelio menos aplanado que en el grupo S, con signos de tumefacción y algunas células desprendidas; en cuatro animales se apreció proliferación subendotelial moderada. La túnica media se observó engrosada, con incremento aparente del número y tamaño de núcleos de células musculares lisas, las cuales presentaron desorganización y tumefacción; el número de láminas elásticas fue de 8 - 12 y en tres animales se encontró desorganización y fragmentación de varias de estas estructuras. La adventicia también se apreció engrosada, con áreas de hemorragia e infiltrado inflamatorio focal de leucocitos y macrófagos, y algunos vasos vasorum con engrosamiento de la pared. (Tabla 2, Fig. 2, Fig. 3 y Fig. 4).
En el grupo DN 0,25 se observó el endotelio más delgado y aplanado que en el grupo D, sin denudación. Se evidenció tumefacción de células endoteliales aisladas y engrosamiento leve del subendotelio. La túnica media impresionó más delgada que en el grupo D, con células musculares sin signos de tumefacción y mejor organizadas; en dos animales se apreció un mayor número de núcleos de células musculares lisas, similar al grupo D. Las láminas elásticas se observaron continuas, en número de 8 - 12 y de aspecto uniforme. La adventicia presentó algunos vasos vasorum con engrosamiento de la pared, pero se mostró más delgada que en el grupo D y sin infiltrado inflamatorio. (Tabla 2, Fig. 2, Fig. 3 y Fig. 4).
En tres animales del grupo DN 0,5 se observó moderada tumefacción y denudación en varias zonas del endotelio, así como proliferación subendotelial moderada. En la túnica media de este grupo se apreció menor desorganización de las células musculares lisas que en el grupo D, pero con signos de tumefacción; las láminas elásticas, en número de 8 - 12, se observaron continuas y más organizadas que en el grupo D. La adventicia se mostró más delgada que en el grupo D, pero con áreas de hemorragia, algunos vasos vasorum de paredes engrosadas y abundante infiltrado inflamatorio. Cuatro animales presentaron desgarro de las túnicas en algunas zonas del anillo aórtico (Tabla 2, Fig. 2, Fig. 3 y Fig. 4).
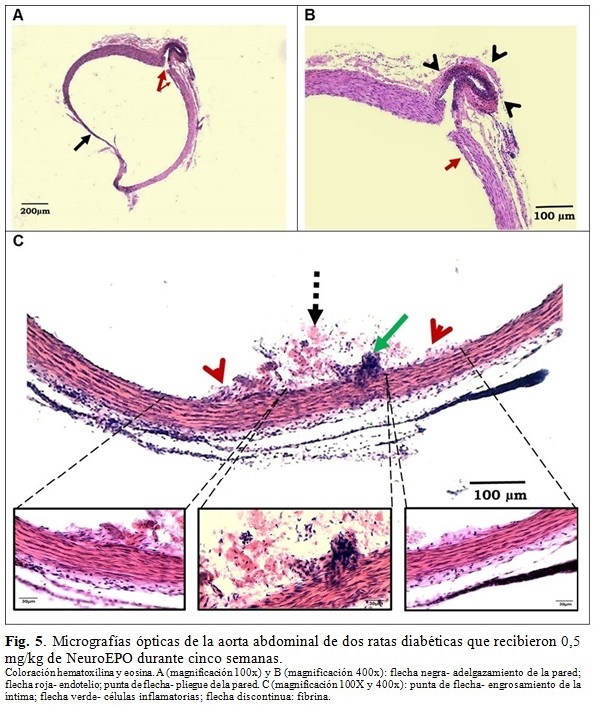
En un animal del grupo DN 0,5 se evidenciaron varias zonas del endotelio con marcado engrosamiento y denudación, con abundantes células sanguíneas y fibrina asociadas. En otro animal se observó adelgazamiento de la pared y la formación de un pliegue. (Tabla 2 y Fig. 5).
Estudio morfométrico de la túnica media de la aorta abdominal
Al comparar el grosor de la túnica media de la aorta abdominal, resultó mayor en el grupo D que en el S. El grupo DN 0,25 mostró un grosor menor que el D y similar al S, mientras que el grupo DN 0,5 presentó resultados similares al D, con mayor grosor que en los grupos S y DN 0,25. (Fig. 6).
DISCUSIÓN
En la presente investigación se evidencia que a las seis semanas de inducida la diabetes con STZ, las ratas presentaron modificaciones estructurales en las tres túnicas de la pared de la aorta abdominal. Con las dos dosis de NeuroEPO evaluadas disminuyó la hiperglucemia, pero solo con la dosis menor se evitaron varias de las afectaciones en la aorta, y otras fueron menos frecuentes y severas. Con la dosis mayor de NeuroEPO, se apreciaron algunos beneficios, pero se encontraron alteraciones que no se observaron en el resto de los grupos.
En el estudio se demuestra que la diabetes tuvo un efecto perjudicial sobre el endotelio aórtico de las ratas que recibieron el vehículo, lo que corresponde con otros resultados obtenidos en ratas con diabetes inducida por STZ.(11) Se sabe que durante la exposición prolongada a un ambiente hiperglucémico, se ven potenciados una variedad de mediadores inflamatorios y vasocontrictores, que se encuentran implicados en los mecanismos de las complicaciones de la diabetes. Factores como las interleucinas (IL) IL-1β y la IL-6, el factor de necrosis tumoral alfa (TNF-α), el factor nuclear κb (NF-κb), la angiotensina II y la endotelina 1, se incrementan, y otros disminuyen, como el óxido nítrico; la situación propicia el desarrollo de estrés oxidativo, que propicia el daño y la disfunción endotelial.(12)
Por otra parte, el incremento aparente del número de núcleos en la túnica media de las aortas de las ratas diabéticas que recibieron el vehículo, sugiere un mayor número de células musculares lisas, lo que, junto a la tumefacción celular, pudiera contribuir al mayor grosor de esta túnica. Existen evidencias de que en la diabetes se incrementa la formación de productos de glicosilación avanzada, así como su unión a la elastina y el colágeno, lo que favorece la proliferación de las células musculares lisas de la pared arterial.(13)
En las ratas diabéticas que recibieron el vehículo también se observó desorganización y fragmentación de láminas elásticas. Similar resultado fue descrito en un estudio en ratas diabéticas sometidas a una dieta hiperglucídica.(4) La unión de productos de glicosilación avanzada a la elastina, puede endurecer las fibras elásticas, lo que las hace más susceptibles a la degradación y fragmentación.(14)
Otros resultados de la investigación muestran que la intervención con la dosis más baja de NeuroEPO atenuó los daños estructurales en la aorta de las ratas diabéticas. La presencia de un endotelio sin denudación y con menor tumefacción, la menor proliferación subendotelial, la mejor organización de las células musculares lisas y láminas elásticas, son evidencias de este efecto. Además, el grosor de las túnicas media y adventicia se mostró similar al de las ratas sanas, a lo que puede haber contribuido la ausencia de tumefacción celular e infiltrado inflamatorio, y son otras evidencias de la mejor conservación de la pared de la aorta en este grupo.
Diferente a lo observado con la dosis menor de NeuroEPO, en las aortas del grupo que recibió la dosis 0,5 mg/kg, solo se apreció una mejor estructura de la túnica media, pero esta se encontró engrosada como en el grupo que recibió el vehículo. Además de mayor denudación endotelial e infiltrado inflamatorio, se observaron áreas con desgarro de las túnicas y en un animal se encontraron zonas con estrechamiento y deformidad de la pared, que no se observaron en el resto de los grupos.
En un estudio previo en ratones, se comprobó que dosis altas de EPO inducen la formación de aneurismas aórticos, con aumento de microvasos y su densidad, de metaloproteasas e infiltrado de fagocitos, así como disminución de colágeno y células musculares lisas.(15) Lo anterior sugiere que las alteraciones encontradas en la pared de la aorta del grupo que recibió la dosis 0,5 mg/kg de NeuroEPO, que no se presentaron en otros grupos del estudio, pueden considerarse efectos adversos.
Uno de los mecanismos mediante los cuales la dosis más baja de NeuroEPO evaluada pudiera tener efectos protectores en la aorta de las ratas diabéticas, es la disminución de la hiperglucemia, lo que coincide con resultados previos.(7) Por otra parte, las acciones antioxidantes, antiinflamatorias y antiapoptóticas de la NeuroEPO, comprobadas en diferentes estudios de neuroprotección,(6) pueden tener un efecto directo en la protección - reparación de la pared vascular. Los mecanismos anteriores pudieran mediar en los beneficiosos observados con la dosis más baja de NeuroEPO evaluada en las ratas diabéticas y sugieren nuevas investigaciones.
Es importante resaltar que el modelo de diabetes inducida con STZ en ratas adultas conduce a una hiperglucemia severa sostenida, por lo que las alteraciones metabólicas y las complicaciones son difíciles de prevenir. Por esta razón, cualquier beneficio que se logre con alguna intervención, como el observado con la dosis 0,25 mg/kg de NeuroEPO en la aorta, tiene un significado relevante en la valoración de sus efectos.
Los resultados permiten concluir que dosis subcutáneas repetidas de 0,25 mg/kg de NeuroEPO, disminuyen las alteraciones estructurales en la aorta de ratas diabéticas, mientras que dosis mayores pueden provocar efectos perjudiciales.
Agradecimientos
A la Dr. C. Teresita Rodríguez, por facilitar la NeuroEPO y el vehículo, al personal técnico que participó en la atención a los animales, al Dr. Víctor M. Rodríguez, por su colaboración en los procedimientos de cirugía experimental, y a la Dra. Melvis T. Zumeta, por su valiosa asesoría en el análisis histológico.
Conflicto de intereses
Los autores no presentan conflicto de intereses en relación con la investigación presentada.
Contribuciones de los autores
Conceptualización de ideas: Alicia Borroto Leiseca, Mónica Elena Fernández Jiménez, Tammy Fernández Romero.
Curación de datos: Alicia Borroto Leiseca, Mónica Elena Fernández Jiménez, Ketty Suárez Borrás, Tammy Fernández Romero.
Análisis formal: Alicia Borroto Leise.ca, Mónica Elena Fernández Jiménez, Ketty Suárez Borrás, Tammy Fernández Romero.
Investigación: Alicia Borroto Leiseca, Mónica Elena Fernández Jiménez, Ketty Suárez Borrás, Carlos L. Pérez, Tammy Fernández Romero
Metodología: Alicia Borroto Leiseca, Mónica Elena Fernández Jiménez, Ketty Suárez Borrás, Tammy Fernández Romero.
Visualización: Alicia Borroto Leiseca, Mónica Elena Fernández Jiménez, Ketty Suárez Borrás, Carlos L. Pérez, Tammy Fernández Romero
Redacción del borrador original: Alicia Borroto Leiseca, Mónica Elena Fernández Jiménez
Redacción, revisión y edición: Alicia Borroto Leiseca, Mónica Elena Fernández Jiménez, Carlos L. Pérez, Tammy Fernández Romero.
Financiación
Universidad de Ciencias Médicas de La Habana. Instituto de Ciencias Básicas y Preclínicas Victoria de Girón. La Habana. Cuba.
REFERENCIAS BIBLIOGRÁFICAS
1.Licea Puig M. Diabetes mellitus. Una mirada integral. La Habana: ECIMED; 2021.
2.Dianna J, Magliano E, Boyko J. IDF Diabetes Atlas. Scientific committee. IDF Diabetes Atlas[Internet]. Brussels: International Diabetes Federation; 2021[citado 23/11/2024]. Disponible en: https://pubmed.ncbi.nlm.nih.gov/35914061/
3. Ministerio de Salud Pública. Anuario Estadístico de Salud, 2022. La Habana: Ministerio de Salud Pública. Dirección de Registros Médicos y Estadísticos de Salud; 2023[citado 23/11/2024]. Disponible en: http://bvscuba.sld.cu/anuario-estadistico-de-cuba/
4.Machado-Martínez A, Herrera-Moya VA, González Madariaga Y, García-Gómez ML. Daño en la pared arterial de las ratas Wistar sometidas a dieta hiperglucídica. Medicentro Electrónica[Internet]. 2022[citado 4/4/2024];26(4):[aprox. 9 p.]. Disponible en: http://scielo.sld.cu/scielo.php?pid=S1029-30432022000400818&script=sci_arttext&tlng=pt
5.Suresh S, Rajvanshi PK, Noguchi CT. The many facets of erythropoietin physiologic and metabolic response. Front Physiol. 2020;10:1534.
6.Fernández G, Pérez CL, Román OI, Fernández T. Evidencias del potencial neuroprotector de la NeuroEPO en estudios preclínicos y ensayos clínicos; revisión sistemática. Rev Hab Cienc Méd[Internet]. 2023[citado 3/02/2024];22(4)[aprox. 8 p.]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1729-519X2023000400003 7.Fernández T, Clapés S, Pérez CL, Barreto JJ, Fernández G. Efecto hipoglucemia nte de la NeuroEPO en ratas con y sin diabetes mellitus. Rev Hab Cienc Méd[Internet]. 2022[citado 3/02/2024];21(1):[aprox. 7 p.]. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=114946
8.Ghasemi A, Jeddi S. Streptozotocin as a tool for induction of rat models of diabetes: A practical guide. EXCLI J. 2023;22:274-94.
9.Flamini MA, Barbeito CG, Diessler ME. Introducción a las técnicas histológicas básicas. Libros de Cátedra [Internet]. La Plata: Editortial Universidad de La Plata; 2022[citado 23/12/2024]. Disponible en: http://sedici.unlp.edu.ar/handle/10915/149546
10.Ferreira T, Rasband W. ImageJ User Guide IJ 1.46r[Internet]. Praga: Založení; 2019[citado 23/09/2024]. Disponible en: https://cw.fel.cvut.cz/b172/_media/courses/a6m33zsl/imagej-user-guide.pdf
11.Chang X-M, Xiao F, Pan Q, Wang X-X, Guo L-X. Sitagliptin attenuates endothelial dysfunction independent of its blood glucose controlling effect. Korean J Physiol Pharmacol. 2021;25(5):425-37
12.Brennan E, Wang B, McClelland A, Mohan M, Marai M, Beuscart O, et al. Protective effect of let-7 miRNA family in regulating inflammation in diabetes-associated atherosclerosis. Diabetes. 2017;66(8):2266-77.
13.Singh S, Siva BV, Ravichandiran V. Advanced Glycation End Products: key player of the pathogenesis of atherosclerosis. Glycoconjugate J. 2022;39(4):547-63.
14.Cocciolone AJ, Hawes JZ, Staiculescu MC, Johnson EO, Murshed M, Wagenseil JE. Elastin, arterial mechanics, and cardiovascular disease. Am J Physiol Heart Circ Physiol. 2018;315(2):H189-H205.
15.Zhang M, Sui W, Cheng C, Xue F, Tian Z, Cheng J, et al. Erythropoietin promotes abdominal aortic aneurysms in mice through angiogenesis and inflammatory infiltration. Sci Transl Med. 2021;13(603):eaaz4959.