INTRODUCCIÓN
Las estadísticas sobre el cáncer describen la situación de un gran número de personas en todo el mundo y muestran la gravedad de la enfermedad y su carga general para la sociedad y la salud pública. Dos de los aspectos que afectan directamente a la calidad de vida de quienes padecen cáncer son el dolor y los costos del tratamiento.(1,2) Por un lado, el malestar que sufre una persona por el dolor oncológico es fuerte e insoportable, no solo lo incapacita físicamente, sino también psicológicamente, pues produce irritabilidad, debilidad, cambios emocionales, pérdida del autocontrol, tristeza, ansiedad y otros problemas psicológicos que en los peores de los casos conlleva al suicidio del paciente.(3,4,5)
Por otro lado, el costo asociado a la atención médica es inaccesible en la mayoría de los casos -como ejemplo se puede plantear que un enfermo de cáncer en Ecuador gasta alrededor de 17 500 dólares en su tratamiento-(6) lo que representa un factor de riesgo para los pacientes pues es un gasto que no se puede enfrentar.
En virtud de lo expuesto, en los últimos años se han prescrito medicamentos para contrarrestar el dolor oncológico.(7) Sin embargo, influyen muchos factores, incluida la resistencia a los opioides, los efectos secundarios que limitan su uso y la aparición de nuevos mecanismos aplicados por la enfermedad, como resultado de la etapa clínica, que pueden provocar una falta de respuesta favorable a la analgesia y, por ende, a un inadecuado control del dolor. En la búsqueda de mejores tratamientos para el dolor crónico por cáncer, se han estudiado medicamentos con nuevos mecanismos de acción.(8) Uno de ellos es la ketamina, por tener propiedades amnésicas, analgésicas, disociativas y sedantes. Es único entre los agentes anestésicos, ya que no suprime los sistemas cardiovascular y respiratorio, sino que actúa como un supresor del dolor cuando el opioide no tiene un efecto significativo en aliviar el dolor neoplásico que domina el cuadro clínico.(9)
Se ha demostrado que el efecto analgésico de la ketamina en el dolor neuropático se produce principalmente a través del antagonismo de los receptores de N-metil-daspartato (NMDA) que bloquean el canal NMDA en estado abierto al unirse al sitio de fenciclidina ubicado dentro del lumen del canal y la activación del receptor de opioides,(10,11) los cuales no se relacionan únicamente con los métodos epistemológicos de aprendizaje y memoria, sino también, con los procesos de dolor crónicos y/o agudos.(12)
La eficacia y los beneficios en lo que se puede aplicar un tratamiento con ketamina dependen de la forma de aplicación y la dosis; abarca desde molestias estimuladas por quimioterapia, dolores incitados por contusión nerviosa, padecimiento diabético, entre otros dolores neuropáticos.(13)
Generalmente se administra por vía intravenosa y su acción tiene efecto a las 24 hrs.(7) Aunque también es administrada por vía oral, su biodisponibilidad es baja debido al primer paso hepático, lo que limita su aplicación al tratamiento crónico. Pese a ello, se ha comprobado que la vía intranasal tiene varias ventajas, incluida una mayor biodisponibilidad debido a que evita el metabolismo hepático, la ausencia de acceso intravenoso, la capacidad de repetir la dosis con más frecuencia y la absorción rápida,(12,14) lo que resulta de gran beneficio para mejorar el estado del paciente.
En Ecuador, como en otros países latinoamericanos, los estudios clínicos sobre la ketamina resultan escasos, en particular sobre su utilización en el tratamiento del dolor oncológico y, aunque el MSP ha sugerido su uso, poca es la información que se puede obtener sobre sus beneficios en pacientes ecuatorianos. En este sentido, dada la importancia de este medicamento para reducir y aliviar el dolor en pacientes con cáncer, este estudio tiene como objetivo evaluar la eficacia de la respuesta analgésica del dolor oncológico a la administración intranasal de ketamina como adyuvante en el tratamiento farmacológico, en una clínica del dolor en Ecuador.
MÉTODOS
Se realizó un estudio de cohorte con placebo, aleatorizado, doble ciego. El protocolo fue aprobado por parte del Comité de Ética de Investigación en Seres Humanos (CEISH), oficialmente reconocido por el MSP ecuatoriano.
Fueron seleccionados 154 participantes de acuerdo con los criterios de inclusión:
1) que sean hombres o mujeres mayores de 20 años de edad,
2) pacientes con diagnóstico de cáncer en estado terminal y
3) que presentaran dolor incontrolado o crónico relacionado con la enfermedad.
Se excluyeron los pacientes que presentaban: a) antecedentes de hipertensión arterial y epilepsia, b) hipersensibilidad al principio activo, c) enfermedad cardiovascular mal controlada, embarazo y/o psicosis activa, d) incapacidad física o psíquica y e) presión intracraneal e intraocular elevada.
El diseño del estudio incluyó asignar un número a cada sujeto que participaba en la intervención y aplicar una tabla de números aleatorios para formar dos grupos (A y B). En el caso del grupo A, la dosis de ketamina se combinó con morfina, y en el caso del grupo B, se suministró 1ml de solución salina al 0,9 % (NaCl) o placebo conjuntamente con la morfina. Conforme a las pautas de Cohen et al.(15) se dosificó la ketamina a 0,5 mg/kg peso por administración, cada seis horas, durante los tres días que duró el estudio (al igual que el placebo).
El administrador del estudio (no involucrado en su ejecución) generó una lista aleatorizada, asignó el tratamiento a los sujetos y preparó los medicamentos de acuerdo con las especificaciones de la investigación. Los medicamentos se prepararon el día de la aplicación y se entregó al equipo de investigación antes de su administración. El estudio fue doble ciego para el tratamiento con ketamina y placebo (NaCl).
Hasta que se recopilaron todos los datos, el equipo de investigación desconocía el fármaco aplicado en el estudio. La investigación se controló de forma independiente y el análisis de los datos se realizó después de que el administrador presentó el informe final para garantizar que se cumplieran todos los requisitos de buenas prácticas clínicas.
Se valoró a los participantes en intervalos regulares de 15, 30, 60 y 120 minutos; durante tres días seguidos. Se evaluó sobre la aparición de efectos secundarios antes, durante y después de la administración del fármaco.
Se utilizó la escala visual analógica del dolor (EVA) considerando una respuesta eficaz si hay disminución en al menos 3 de la valoración inicial. La escala consistía en una valoración visual de 10 puntos, donde 0 representaba “ningún dolor” y 10 representaba “un dolor incontrolable”. A los pacientes se les enseñó a llevar un diario del dolor, en el que se les pidió que llevaran un registro de su puntuación de dolor, sedación y efectos secundarios o reacción adversa a los medicamentos (RAM, específicamente mareos, sensación de vómito, alucinaciones, insomnio, otros) todas las noches.
Los datos se evaluaron mediante análisis estadístico no paramétrico. Las variables categóricas se compararon mediante tablas de frecuencia y análisis bivariado . Se utilizó la prueba de rango con signo de Wilcoxon para calcular las diferencias significativas entre las dos puntuaciones (A y B) de la EVA. La significancia se aceptó a p < 0.05. Los datos se expresan como media ± DE y recuentos de frecuencias y porcentajes para las variables categóricas. Se empleó el software estadístico R en la versión 4.1.0.
La investigación se llevó a cabo en el marco de los principios éticos de la investigación médica humana en la última Declaración de Helsinki de la Asociación Médica Mundial (AMM) de octubre de 2013. Todos los sujetos dieron su consentimiento informado oral y escrito antes de participar en el estudio. Cada participante recibió suficiente información sobre el estudio (objetivo, métodos, riesgos, beneficios, entre otros); y su derecho a participar o no participar y retirar su consentimiento en cualquier momento sin someterlo a represalias.
RESULTADOS
Características de los pacientes
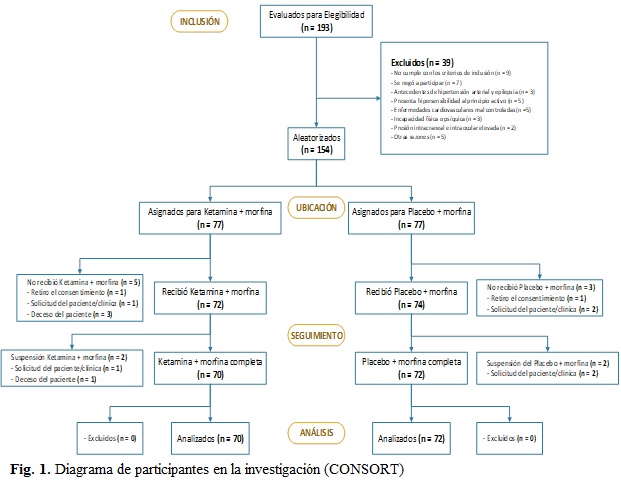
Firmaron un formulario de consentimiento para realizar la investigación 193 personas. Sin embargo, solo 154 participantes cumplieron con todos los requisitos de elegibilidad y fueron asignados al azar a una de las dos secuencias de tratamiento (Grupo A y B). Doce individuos retiraron su consentimiento después de la aleatorización, en el caso del Grupo A, tres se retiraron por solicitud del paciente y/o clínica y cuatro fallecieron. En el caso del Grupo B, 5 participantes se retiraron a solicitud del paciente y/o clínica, en ambos casos no completaron el período de tratamiento. Por tanto, 142 pacientes completaron el tratamiento y constituyeron la muestra de estudio. (Fig. 1).
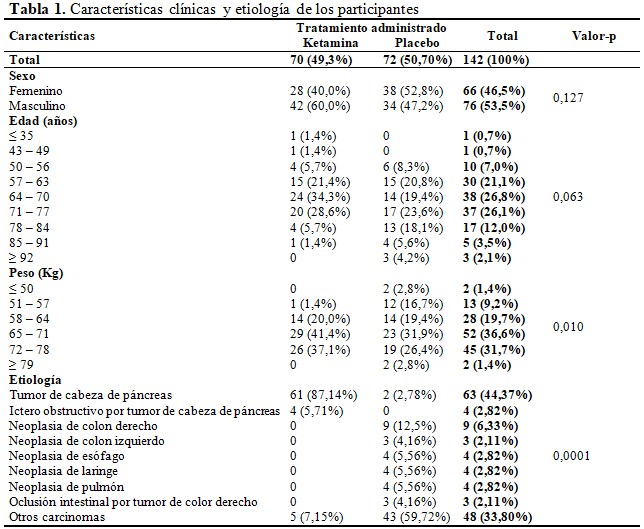
Se observó predominio del sexo masculino (53,5 %), frente al 46, 5 % femenino. La edad media de los participantes fue de 69,11 ± 9,77 años. En promedio el peso de los pacientes fue de 67,50 ± 7,02 Kg. Los carcinomas que se presentaron con mayor frecuencia fueron el tumor de cabeza de páncreas (44,37 %), la neoplasia de colon derecho (6,33 %) y otros tumores (33,80 %). Se encontraron diferencias significativas entre el tratamiento administrado, el peso del paciente y la neoplasia primaria (p <0.05). (Tabla 1).
Efectos analgésicos
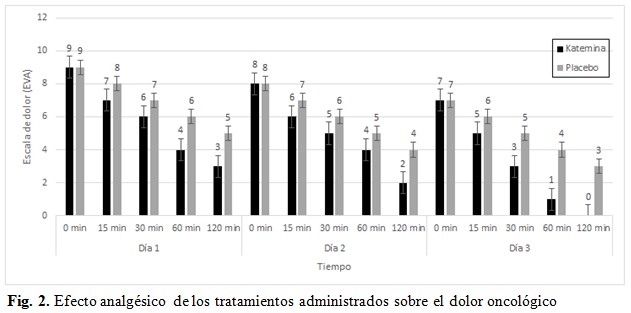
Se encontraron diferencias significativas en la disminución del dolor oncológico en comparación con el tratamiento administrado (p <0.05). El efecto fue evidente al final de la infusión administrada en 30 min. y persistió significativamente hasta los 120 min. (Fig. 2).
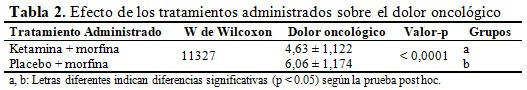
Los pacientes que fueron tratados con ketamina + morfina tuvieron un efecto analgésico más relevante que los pacientes que recibieron el placebo + morfina. El análisis Post Hoc determinó dos niveles a y b, en comparación con el tratamiento con placebo (grupo b), la ketamina pudo reducir la intensidad del dolor en casi todos los pacientes. (Tabla 2).
Reacciones adversas
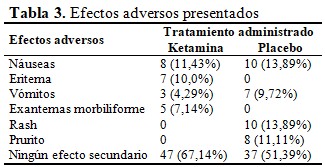
Los efectos secundarios más comunes en el Grupo A ocurrieron dentro de los 56 minutos posteriores a la primera administración, siendo los síntomas más comunes las náuseas (11,3 %) y el eritema (10,0 %), náuseas y erupción cutánea (13,89 %). Estas reacciones se presentaron en mayor frecuencia en el Grupo B. La mayoría de estos síntomas desaparecieron a las 2 hrs. de haber sido administrado el medicamento. En general, no hubo efectos adversos graves durante el estudio. (Tabla 3).
DISCUSIÓN
Se sabe que la ketamina inhibe los receptores NMDA de forma no competitiva, cada uno con un cierto grado de analgesia.(14) Incluso se ha reportado su efecto sobre las células tumorales (T) pues suprime de forma dependiente sobre la expresión de interleucina-2 (IL-2) / interferón-g (IFN-g) de las células T in vitro, los linfocitos T activados.(16) Esto la convierte en un mecanismo de acción beneficioso cuando se usa para tratar el dolor oncológico. Se ha demostrado que el efecto analgésico depende de la vía de administración y la dosis.(13,17) Sin embargo, la información sobre su efecto, beneficio, dosis y otros es limitada.
Los resultados obtenidos confirman la eficacia de la ketamina en el manejo del dolor oncológico crónico y la persistencia en diversas etapas. Como alternativa a los opioides, la ketamina es un analgésico que se puede utilizar para aliviar el dolor provocado por el cáncer mediante diferentes métodos de administración como la intranasal. La biodisponibilidad de la ketamina intranasal fue del 55 %, más alta que la informada por Khavanin et al.(17) y Mathew et al.(18) con un registro de 50 % y 25 %, respectivamente. Aun así, el efecto analgésico se mantuvo igual en 30 min. y persistió hasta la siguiente dosis (6 hrs).
Aunque se ha confirmado que la ketamina intranasal es eficaz en el tratamiento del dolor crónico, existen pocos datos sobre su uso como analgésico adyuvante de los opioides para el tratamiento del dolor por cáncer. Pese a ello, se ha demostrado que la ketamina intranasal puede ser utilizada para controlar el dolor en pacientes con cáncer, proporciona una analgesia superior y una mejor calidad de vida sin el riesgo de depresión respiratoria significativa asociada con los opioides.(14)
Los efectos secundarios pueden limitar el uso de ketamina en algunos pacientes con dolor crónico por cáncer. Las reacciones adversas fueron similares al estudio de Mercadante et al.(19) en que los pacientes experimentaron náuseas y vómitos con mayor frecuencia. Se han informado diferentes tasas de efectos adversos en la literatura. Benítez-Rosario et al.(20) explicaron otros eventos adversos como la salivación y el insomnio, de manera diferente a este estudio.
Se puede concluir que los pacientes tratados con ketamina intranasal experimentaron una analgesia rápida al dolor crónico oncológico en comparación al grupo control tratados con placebo. Sin embargo, se debe tener en cuenta la aparición de efectos adversos centrales, especialmente cuando se utilizan dosis más altas. La ketamina representa una opción para el dolor que ya no responde al tratamiento convencional con opioides.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Contribuciones de los autores
Conceptualización: Secundino González Pardo.
Curación de datos: Secundino González Pardo.
Análisis formal: Lourdes González-Longoria Boada, Francisco López-Muñoz
Investigación: Secundino González Pardo.
Metodología: Secundino González Pardo.
Administración del proyecto: Secundino González Pardo.
Supervisión: Francisco López-Muñoz, Secundino González Pardo.
Redacción del borrador original: Secundino González Pardo.
Redacción- revisión y edición: Secundino González Pardo, Lourdes González-Longoria Boada, Francisco López-Muñoz.
Financiación
El trabajo no tuvo financiamiento.