INTRODUCCIÓN
La ectopia cordis (EC), es una anomalía congénita rara y grave caracterizada por un desplazamiento total o parcial del corazón fuera de la cavidad toráxica.(1) Esta afección es conocida también como síndrome de Tin Man, o del hombre de lata u hojalata en alusión al conocido personaje de El Mago de Oz, y se corresponde con una anomalía infrecuente y a la vez sorprendente. Se clasifica en 4 tipos en función de la posición del corazón: cervical(en la que el corazón se desplaza superiormente a la zona del cuello [3% de los casos]), toráxico, (el corazón sobresale antes a través de un defecto esternal [60% de los casos]), toracoabdominal, (el corazón se desplaza fuera del tórax a través de un defecto en el esternón inferior en asociación con defectos diafragmáticos y ventrales de la pared abdominal [7% de los casos]), y abdominal, en el que el corazón se desplaza inferiormente en el abdomen a través de un defecto en el diafragma (30% de los casos).(2,3) En 1958, Cantrell publicó un síndrome con 5 defectos: anomalías de pared toráxica, abdominal, diafragma, pericardio y corazón denominado como Pentalogía de Cantrell (PC).(4)
El diagnóstico prenatal de ectopia cordis ha sido reportado por varios autores que han descrito un corazón palpitante que está parcial o completamente fuera de la cavidad torácica.(1,2) Aunque por lo general el diagnóstico es sencillo y se puede hacer con confianza a partir de las 10 semanas de gestación en adelante,(5,6) casos de ectopia cordis toracoabdominal pueden ser difíciles de diagnosticar si solo el ápice del corazón es extratorácico y la visualización se ve obstaculizada por el contenido abdominal extruido. Con la implementación generalizada del examen sonográfico del primer trimestre como herramienta de diagnóstico de la aneuploidía en la práctica clínica actual,(7,8,9) es razonable esperar que la mayoría de los casos de ectopia cordis se detecten a una edad gestacional temprana. De hecho, varios casos que describen el diagnóstico antes de las 14 semanas de gestación ya han sido reportados en la literatura médica, la mayoría de ellos como informes de casos aislados.(10,11,12,13,14,15) Existe discreto predominio en el sexo femenino y se asocia a teratógenos no potentes como son: quinidina, warfarina, talidomida y tretinoína, relacionado también a factores genéticos, pero a ciencia cierta la causa no se conoce aún en su totalidad.(1,2,3,4) Su prevalencia es del 5,5–7,9 por 1 millón de nacidos vivos, otros hablan de 1 por 126 000 nacidos y 0,079 casos por 10 000 recién nacidos vivos.(1,2,5,6)
La EC indica una localización cardíaca extra torácica a través de un defecto de la pared de extensión variable. Fue mencionada desde el imperio babilónico. Es curioso que Leonardo Da Vinci en 1502 describiera y dibujara la EC en un cadáver, más muchos consideraron que era parte de sus fantasías. Descrita por primera vez en 1671, otros dicen que fue Haller en 1706 ambas sin evidencias claras; pero Nohear Lubdub fue el primero que describe en un caso incomum de cárdia ectopia epigasticum em um menino de Haryana en Royal Socitery Proceedings en abril 1874 según Skalski M,(7) y se correspondía con una EC epigástrica en un niño. Entre los años 1888 y 1977 Ravitch logra recolectar 44 casos de EC.(3,4,5,6) La EC como la PC puede aparecer de forma aislada o asociada a otras malformaciones. En su estudio Van Hoorn, según Redaliyc Flores R y Rittler M, (1) señalan que el 50 % de pacientes con EC presentan otras malformaciones extracardíacas como son defectos de la pared abdominal, malrotación intestinal, exencefalia y fisuras orales. Otros estudios afirman que se asocia al síndrome de Turner y a la trisomía de los pares 13 y 18.(2,4,5) lo que hace que su pronóstico sea desfavorable en casi la totalidad de los casos. En este trabajo los autores se vieron motivados a presentar un caso interesante manejado en el Letsholathebe Memorial Hospital II de Maun República de Botswana, con el objetivo de enfatizar y describir su experiencia con el diagnóstico y manejo de ectopia cordis y sus anomalías asociadas.
PRESENTACIÓN DEL CASO
Información del paciente
Se presenta un caso de un neonato de 7 meses de edad, sexo femenino, ingresada en el servicio de Neonatología (NNU) y en la sala de Pediatría en dos ocasiones en el Letsholathebe II Memorial Hospital en Maun, noreste de Botswana .La madre de 30 años de edad, VIH positiva, con tratamiento antirretroviral, de padre también de VIH positivo con tratamiento de antirretrovirales. Matrimonio monógamo consanguíneo, condiciones socioeconómicas regulares. Nivel cultural bajo. No existían antecedentes maternos de ingestión de medicamentos no prescritos, uso de drogas ilícitas, tabaquismo o abuso de alcohol. No hubo antecedentes familiares de defectos o malformaciones congénitas. Atención prenatal deficiente, solo tuvo 1 control prenatal en el último trimestre. Nunca se realizó ultrasonido durante el embarazo.
Hallazgos clínicos
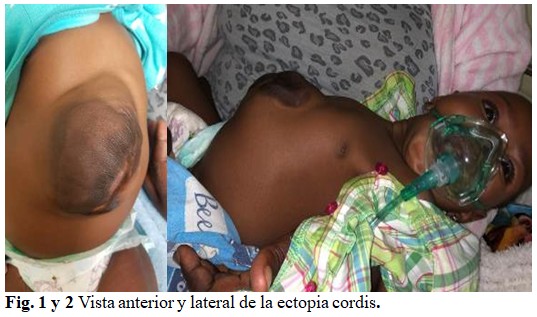
Edad gestacional: 39 semanas. Fecha del nacimiento: 4/2/2020. Peso al nacer de 4,7 kilogramos (Macrosómico), Apgar al nacer: 8-9-10.Talla: 52 cm. Circunferencia cefálica: 36 cm. Líquido amniótico claro. Placenta normal. Inmediatamente al nacer se observó aumento de volumen en la región abdominal (Figuras 1 y 2), pulsátil así como falta de aire (distrés respiratorio leve). Al examen físico: SPO2: 92% . Temperatura de 37.6 oc . Glicemia: 3,7 mmol/l . Buen estado de hidratación, hemodinámicamente estable, respiración espontánea, cianosis distal evidente, no íctero, no quejidos. Poseía buen tono muscular. Aparato Respiratorio: Frecuencia respiratoria: 56’ Polipnea, Tiraje intercostal y subcostal. Murmullo vesicular rudo. Se auscultan ruidos transmitidos. Frecuencia cardíaca: 158’ Ruidos cardíacos taquicárdicos que se auscultan en el abdomen. En este órgano se observa defecto de la pared abdominal en epigastrio que late (ectopia cordis). Se ingresa en el Servicio de Neonatología con oxigenoterapia, tratamiento antibiótico endovenoso con ampicilina y gentamicina. Se mantiene la monitorización de los signos vitales, fundamentalmente la glicemia. A los 7 días de nacida se coordina con el Hospital Princess Marina Hospital en Gaborone, la capital del país, para su remisión y evaluación por el Especialista de Cardiología Pediátrica para su estudio y posible tratamiento.
Evaluación diagnóstica
En el Princess Marina Hospital se evalúo por el especialista en Cardiología. El diagnóstico fue la ectopia cordis, comunicación interventricular perimembranosa grande con hipertensión pulmonar severa. Se confirma que presenta onfalocele y hernia diafragmática. Se determina que solo debía llevar un tratamiento paliativo, dada la magnitud de la malformación y se contraindica el tratamiento quirúrgico y se remite a su atención primaria para su seguimiento.
A los 7 meses regresa de nuevo a nuestro centro con fiebre y distrés respiratorio y se ingresa en la sala de pediatría. Peso: 6,5 Kg en el momento de su ingreso, es referida a nuestro centro hospitalario por presentar fiebre de 3 días de evolución, tos, expectoración y dificultad respiratoria. Además de poco progreso en la curva de peso. La niña tenía alimentación artificial con leche de vaca.
Temperatura: 38 grados. Spo2: 96%. Frecuencia Respiratoria: 56’ Frecuencia Cardíaca: 122’. Se veía bien delgada, bien hidratada y perfundida. Cianosis distal.
Murmullo vesicular rudo. Estertores crepitantes bilaterales.
Diagnóstico: Bronconeumonía Bacteriana, Ectopia Cordis, Desnutrición Proteico Calórica Moderada.
Intervención terapéutica
Se administró oxigenoterapia, ampicillín y gentamicina, vía intravenosa (IV) durante 3 días y posteriormente se cambia a cefotaxima y vancomicina (IV) durante 10 días más. También recibió furosemida 10 mg dos veces al día por vía oral (VO) y espironolactona 5mg tres veces al día (VO).
Análisis complementarios de sangre:
PCR PARA VIH: (24-9-2020) Negativo
Hemograma: Hemoglobina: 16,9 g/l
Leucocitos: 6,68 x10 9 Neutrófilos: 70% Linfocitos: 21% Monocitos: 9%
Plaquetas: 280x10 9
Na:136mmol/l K: 5,0 mmol/l Cl: 98,3 mmol/l Urea: 4,5 mmol/l Creatinina: 20 mmol/l Bilirrubina total: 9,3 mmol/l Bilirrubina Directa: 1,9 mmol/l Transaminasa Pirúvica: 19,8 u/l Transaminasa Oxaloacetica: 42 u/l GGT: 12,7 u/l Fosfatasa Alcalina: 251 u/l Proteínas Totales: 65,1 g/l Albúmina: 42,0 g/l.
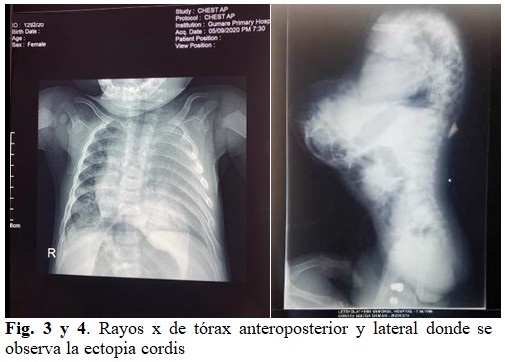
Rayos x de tórax. Ausencia del corazón en su posición en el tórax. Silueta cardíaca aumentada, borramiento de hemidiafragma derecho, infiltrado difuso de aspecto inflamatorio en ambos campos pulmonares e imagen radiopaca abdominal correspondiente el corazón del paciente (Figuras 3 y 4). La madre se negó a realizar la Tomografía Axial Computarizada (TAC). El ultrasonido determinó una hernia diafragmática, las vísceras abdominales de tamaño normal y presencia del corazón con los grandes vasos en plena actividad.
Seguimiento y resultados
Una vez estabilizada se determina su alta hospitalaria y seguimiento en consulta externa donde ya con 10 meses la paciente continúa con vida de manera inexplicable.
DISCUSIÓN
El diagnóstico de la ectopia cordis en la mayoría de los casos es sencillo, y es raro produzcan diagnósticos falsos o falsos positivos. Cabe destacar que casi todos los casos presentan malformaciones graves asociadas, incluyendo un onfalocele que contiene hígado, esquistsis toracoabdominal, y otras. El diagnóstico prenatal de ectopia cordis se lleva a cabo mediante ultrasonido, que permite la visualización del corazón fuera de la cavidad torácica. El diagnóstico se recomienda entre 9 y 11 semanas de gestación, respectivamente.(2,3,4,8) El uso de ultrasonido tridimensional y su combinación con Doppler permite un diagnóstico temprano más preciso. La resonancia magnética también se está volviendo común en la evaluación prenatal para documentar y planificar el manejo de anomalías congénitas complicadas. En el caso estudiado, la madre proviene de una comunidad agrícola rural donde no existe un centro de salud sólido para la atención prenatal para permitir una investigación prenatal de este tipo para la detección temprana de este diagnóstico.(2,3,4) En ausencia de una atención prenatal de este tipo, lo que contribuyó al diagnóstico tardío de la afección similar a los reportes realizados por Simon(12) Chelo(13) y Munkana,(14) todos en diferentes países africanos con dificultades para el diagnóstico prenatal así como Saeidi(15) en el Medio Oriente. La paciente se presentó a nuestras instalaciones en el tercer día de vida con el supuesto corazón como un aumento de volumen abdominal que latía; además, el recién nacido posteriormente desarrolló fiebre y dificultad respiratoria que podrían haber contribuido a un mal resultado y después de diagnosticada por el especialista de cardiología, regresa a los 7 meses con un cuadro similar, respondiendo satisfactoriamente.
La ectopia cordis se entiende como el resultado de un defecto durante el proceso de desarrollo del corazón que normalmente tiene lugar después de la cuarta semana de desarrollo.(1,2,3,5) En etapas muy tempranas de desarrollo, el corazón se coloca fuera del cuerpo. Con el plegado del embrión, el corazón se reubica pasivamente en su ubicación intratorácica final e se incluye en el saco pericárdico. Aunque los eventos fisiofisológicos que conducen a la ectopia cordis no se entienden completamente, la distorsión mecánica del corazón en desarrollo secundaria a la ruptura temprana de la coro y/o el saco de yema podría desempeñar un papel etiológico.(4,5) Sin embargo, esta hipótesis no explica la etiología en casos asociados con una anomalía de tallo corporal, en la que la ruptura amniótica temprana con posterior alteración de la pared torácica fetal es la causa más probable(3,6)y en aquellos con ectopia cordis abdominal, en los que un defecto en el diafragma situación existente en nuestra paciente, conduce al desplazamiento del corazón en la cavidad abdominal sin su exteriorización del cuerpo fetal. De hecho, en estos últimos casos, la sola presencia de un defecto diafragmático no explica este tipo de ectopia cordis, ya que el corazón permanece dentro de la cavidad toráxica, a pesar de la presencia de un gran defecto en la mayoría de los fetos con una hernia diafragmática congénita izquierda. Por lo tanto, es posible que una anomalía concomitante que se produzca durante la fijación de los vasos grandes al mediastino también pueda desempeñar un papel prominente en los acontecimientos fisiofisológicos que conducen a la ectopia cordis.
El diagnóstico sonográfico prenatal de ectopia cordis suele ser simple.(1,2) El primer caso diagnosticado se notificó en 1981 en un feto de 34 semanas(3) y el diagnóstico del primer trimestre con el uso de la ecografía transvaginal se realizó 1 década después. Los estudios prenatales han confirmado una alta tasa de malformaciones intracardíacas y extracardíacas, por lo que resulta muy importante el diagnóstico prenatal y de esta manera prevenir las malformaciones congénitas y su complicado manejo postnatal que en muchas ocasiones comprometen la vida del paciente.(2,4,8) Aunque la ectopia cordis ha sido considerada por muchos como una condición esporádica, varios casos se han asociado con aneuploidia; por lo tanto, se debe considerar el análisis cromosómico cuando esta afección se detecta prenatalmente.(4) También observamos una alta prevalencia de defectos de la pared abdominal anterior en nuestra población. Los fetos con onfalocele se pueden detectar fácilmente en una exploración del primer trimestre, y se ha establecido claramente su alta asociación con anomalías cromosómicas, en particular la trisomía(2,4) Fetos euploides con onfalocele aislado se consideran con un buen pronóstico. Sin embargo, algunos casos de pentalogía de Cantrell que se presentan con onfalocele en el primer trimestre se pueden asociar con ectopia cordis, y la posición anormal del corazón puede pasarse fácilmente por alto, particularmente cuando el defecto toráxico es pequeño y sólo el ápice del corazón se coloca fuera de la cavidad toráxica. Dado que la determinación del resultado del embarazo en estos casos depende del tamaño de los defectos esternales y pericárdicos, el porcentaje del corazón situado por vía ectópica y la presencia de malformaciones intracardíacas, un examen detallado de la posición exacta del corazón debe ser obligatorio en fetos con cáncer de cáncer detectado en el primer trimestre. Además, algunos casos de ectopia cordis diagnosticadas en el primer trimestre podrían resolverse a medida que avanza el embarazo, como se ha demostrado en un informe anterior,(1,3,6) lo que demuestra que el pronóstico y la prevalencia de ectopia cordis dependen de la edad gestacional en el diagnóstico pero en nuestro caso nunca se realizó estudio ultrasonográfico durante la gestación.
La cirugía es la única opción terapéutica que, con la mejora de la protección del miocardio y el apoyo pre y postoperatorio, ha proporcionado una mejor tasa de supervivencia.(5) Se han descrito varias técnicas quirúrgicas, y la enfermedad se puede abordar en una o dos etapas quirúrgicas. La primera etapa se realiza con carácter de urgencia y tiene como objetivo obtener la piel y el tejido blando para cubrir el corazón. Sin embargo, no siempre es posible y, debido a la baja producción cardíaca, hay una necesidad de uso de prótesis. El propósito de la segunda etapa es la corrección de las enfermedades cardíacas congénitas asociadas y la reconstrucción del esternón.(1,5)
Se debe realizar una buena planificación quirúrgica y un diagnóstico preciso de las enfermedades cardíacas asociadas, ya que el diagnóstico del defecto se ha hecho intrauterino, que ha ido aumentando la frecuencia de la enfermedad. El parto debe realizarse a través de una operación por cesárea. Como sea posible, el parto debe realizarse en el mismo quirófano y en salas contiguas, para evitar la contaminación del corazón expuesto. En el equipo de atención quirúrgica, la presencia del cirujano plástico es necesaria para las rotaciones musculares y la reparación de la piel, cubriendo la hendidura quirúrgica. (5)El pronóstico de la ectopia cordis completa depende del grado de malformaciones intracardíacas y asociadas. Sin tratamiento, es fatal(3,5) similar a nuestro caso que a pesar de estar vivo a los 7 meses su pronóstico no es nada favorable.
A pesar de los avances en la cirugía cardíaca neonatal, la CS torácica/toracoabdominal completa sigue siendo un desafío quirúrgico con solo unos pocos supervivientes a largo plazo.(5,7) En cuanto al pronóstico, se describe que la EC cervical es un pronóstico muy pobre, con una mortalidad del 96% en el período perinatal. Los otros tipos deben su mortalidad a anomalías asociadas (cardíacas, gastrointestinales), que son susceptibles en algunos casos de reparación quirúrgica.(2,4,8) En Cuba, el Programa de Diagnóstico Prenatal se encuentra al alcance de toda la población y tiene alrededor de 25 años de experiencia, en este programa se incluyen una serie de exámenes de tecnología avanzada como la cuantificación de alfa feto proteína en el suero materno, los ultrasonidos diagnósticos, la amniocentesis, biopsia coriónica, la electroforesis de hemoglobina, entre otros medios que permiten conocer anomalías estructurales, así como enfermedades hereditarias y cromosómicas del período fetal(8) El equipo encargado del diagnóstico prenatal y de la asesoría genética, estaba integrado por médicos genetistas, imagenológos, cardiólogos, obstetras y otros colaboradores, que conjuntamente laboran con el fin de evitar el nacimiento de niños con una calidad de vida comprometida.(8) Queda en duda saber si tiene alguna relación en la paciente, la no aclarada etiología de esta afección con que la madre es portadora de VIH, los rasgos de consanguinidad de los padres o la alta incidencia de malformaciones congénitas que manejamos a diario en el distrito de Numelnag en la república de Botswana, tenemos una experiencia extraordinaria al manejar y tratar este caso raro en la literatura médica.
CONCLUSIONES
La ectopia cordis es una malformación congénita rara que tiene un mal pronóstico incluso después del enfoque quirúrgico y su gravedad está relacionada con la presencia de otras anomalías. Actualmente es posible hacer un diagnóstico más preciso con el uso de dispositivos de ultrasonido modernos durante el primer trimestre del embarazo. El enfoque quirúrgico debe realizarse lo antes posible para reducir las tasas de mortalidad.
Conflicto de intereses
Los autores delcaran que no existen conflicto de intereses
Contribuciones de los autores
Conceptualización: Evis Johnson Montero
Investigación: Juan Carlos Quintana Díaz ,Raquel Rojas Bruzón
Metodología∶ Raquel Rojas Bruzón
Administración del proyecto: Evis Johnson Montero
Supervisión: Evis Johnson Montero, Juan Carlos Quintana Díaz
Redacción – borrador original: Raquel Rojas Bruzón,Evis Johnson Montero
Redacción – revisión y edición∶ Evis Johnson Montero, Juan Carlos Quintana Díaz
Financiación
No fue necesaria