INTRODUCCIÓN
La enfermedad de Wilson (EW, MIM 277 900) presenta un patrón de herencia autosómico recesivo. Se caracteriza por la acumulación de cobre en diferentes órganos, tales como, hígado, cerebro, córnea, riñones, entre otros. En Cuba, existe experiencia en el diagnóstico clínico de la EW, el cual se realiza por un equipo multidisciplinario conformado por gastroenterólogos, genetistas, neurólogos, oftalmólogos, nefrólogos, psiquiatras, bioquímicos, hepatólogos, entre otros. La expresión clínica es muy variable, y en ocasiones dificulta el diagnóstico de esta enfermedad.(1)
La causa molecular que provoca la EW son las mutaciones en el gen ATP7B, el cual codifica para la proteína ATP7B, transportadora de cobre en el hepatocito. Se han identificado más de 800 polimorfismos de un solo nucleótido (SNP) en el gen ATP7B.(2) El estudio molecular permite el diagnóstico de la EW.(3,4)
En el exón 12 del gen ATP7B se identificó el polimorfismo p.K952L en diversos países, tales como, China,(5) Rusia,(6) Taiwán,(7) entre otros. Este polimorfismo es consecuencia de un cambio del aminoácido Arginina por Lisina en la posición 932 de la proteína ATP7B. Además, se utiliza para realizar haplotipos en familias donde haya, al menos, un paciente con diagnóstico clínico certero de la EW, lo que permite la realización del diagnóstico molecular en estos.(2,8)
Es objetivo de este estudio detectar el polimorfismo p.K952L en pacientes cubanos con diagnóstico clínico presuntivo de la EW.
MÉTODOS
Se realizó un estudio descriptivo, en el Centro Nacional de Genética Médica (Centro Colaborador de la OMS para el desarrollo de enfoques genéticos en la promoción de salud), resultado del trabajo conjunto de este, el Instituto de Gastroenterología y la Universidad de Guantánamo, durante el período 2013-2016. Fueron incluidos 35 pacientes (14 mujeres y 21 hombres) con diagnóstico clínico presuntivo de la EW, los cuales asistieron a las consultas en el Instituto Nacional de Gastroenterología. Los pacientes dieron su consentimiento para participar en la investigación, de acuerdo con los principios éticos de la declaración de Helsinki. Se contó con la aprobación por el Consejo Científico y el Comité de Ética del Centro Nacional de Genética Médica y el Instituto de Gastroenterología.
Las variables analizadas fueron: frecuencia alélica del polimorfismo p.K952L, cambio conformacional a para la variante normal, cambio conformacional b para la presencia del polimorfismo p.K952L en estado heterocigótico y el cambio conformacional c en estado homocigótico. Las manifestaciones clínicas fueron clasificadas en: hepáticas, neurológicas, psiquiátricas y sus respectivas combinaciones.
La evaluación de las manifestaciones clínicas fue realizada por un equipo multidisciplinario (gastroenterólogos, genetistas, neurólogos, oftalmólogos, hepatólogos, psiquiatras, nefrólogos y bioquímicos). Se siguieron los criterios establecidos para el diagnóstico de la enfermedad.
Para la detección de cambios conformacionales y la identificación del polimorfismo p.K952L, se seleccionó el exón 12 del gen ATP7B. Se tomó a los pacientes una muestra de sangre y se extrajo el ADN mediante el método de precipitación salina(9) a partir de 10 mL de sangre periférica con ácido etildiaminotetraacético, EDTA, (56 mg/mL).
Las condiciones para la amplificación del exón 12 mediante la técnica de Reacción en Cadena de la Polimerasa (PCR), fueron: 100 ng de ADN, 12 (F) 5'-TCATAGGTTGTAATTTCCCATG-3' y 12 (R) 5'- CAGGATCAATGTCAGTAGATTAT-3', 1mM de dNTPs (Boehringer), 10X tampón PCR, 15mM de MgCl2, 0,25U de Taq polimerasa (Invitrogen), en un volumen de 25 μL.
Posteriormente, se realizó la electroforesis por la técnica Polimorfismo Conformacional de Simple Cadena (SSCP). Se mezcló 3,5 μL con una solución de parada de Bromofenol azul (0,05 % BFA, 10mM NaOH, 95 % formamida, 20 mM EDTA) y 1 μL del producto amplificado, en un volumen final de 7μL. Se aplicó en el gel de acrilamida comercial (GeneGel Excel 12,5/24 Kit).
La visualización del ADN de interés se realizó siguiendo las instrucciones del juego comercial kit PlusOne DNA Silver Staining (Amersham Biosciences, EUA).
El polimorfismo p.K952L se determinó por comparación de las corridas electroforéticas mediante la técnica de SSCP. Se analizaron los controles positivos heterocigóticos y homocigóticos del polimorfismo p.K952L con el producto amplificado obtenido por PCR del exón 12 del gen ATP7B. Las condiciones de las corridas electroforéticas fueron: 450 V de voltaje, 15 W de potencia, 10°C de temperatura y 3 horas de tiempo de corrida.
Los controles de las muestras de ADN de pacientes heterocigóticos y homocigóticos utilizados fueron enviados de los laboratorios Ospedale Regionale per le Microcitemie, Cagliari, de Italia.
Se informó la media ±DE (desviación estándar) de la edad de los pacientes en años. Se determinó la frecuencia y porcentaje del polimorfismo p.K952L como: número de alelos presentes en el polimorfismo p.K952L/Número total de alelos totales. Para analizar si había o no diferencias significativas con lo informado en otras poblaciones, se aplicó la prueba del Chi-cuadrado.
El análisis descriptivo se llevó a cabo mediante estadígrafos de tendencia central (media aritmética) y de dispersión (mínimo, máximo, desviación estándar e intervalos de confianza del 95 %).
RESULTADOS
La edad de inicio en los 35 pacientes estudiados con la EW fue 26,4 años con una desviación estándar de 11 años. El intervalo fue de 6 años (mínimo) y 39 años (máximo).
La edad de inicio en los 21 pacientes cubanos que presentaron el polimorfismo p.K952L fue 30,45 años, con una desviación estándar de 11 años. El intervalo fue de 7 años (mínimo) y 39 años (máximo).
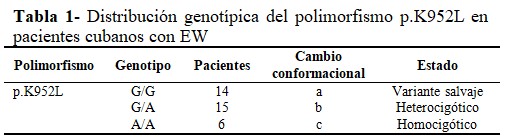
Se detectó el cambio conformacional b en 15 pacientes, el cambio conformacional c en 6 y el cambio conformacional a en 14 individuos. Los cambios conformacionales a, b y c correspondieron a la variante salvaje, estado heterocigótico y homocigótico para el polimorfismo p.K952L, respectivamente. (Tabla 1).
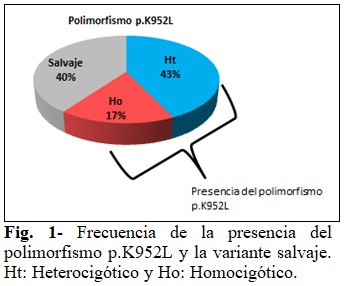
De los 35 pacientes cubanos con diagnóstico clínico presuntivo de la EW, se identificaron 15 pacientes heterocigóticos (43 %) y seis homocigóticos (17 %) para el polimorfismo p.K952L. La variante salvaje se detectó en el 40 % de los individuos estudiados. La presencia del polimorfismo p.K952L representó el 60 % del total de pacientes. (Fig. 1).
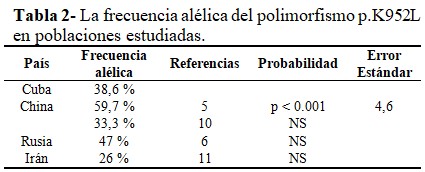
La frecuencia alélica del polimorfismo p.K952L fue de 38,6 %. (Tabla 2).
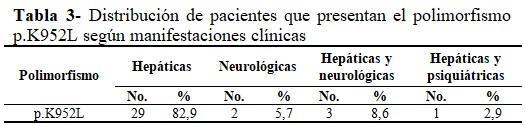
Entre las principales manifestaciones clínicas en los pacientes que presentaron el polimorfismo p.K952L, fueron más frecuentes las hepáticas (82,9 %), seguidas de las manifestaciones mixtas: hepáticas y neurológicas (8,6 %). (Tabla 3).
Se identificó en un paciente (2,9 %) homocigótico con el polimorfismo p.K952L, la presencia de los anillos de Kayser Fleischer; precisamente uno de los que presentó manifestaciones hepáticas y neurológicas. Estos anillos constituyen un criterio de diagnóstico clínico de la EW.
DISCUSIÓN
El polimorfismo p.K952L se encuentra localizado en el quinto segmento de transmembrana TM5 de la proteína ATP7B. Esta variante polimórfica no afecta la función de la proteína transportadora de cobre en humanos, y se identifica en diversas poblaciones con una frecuencia mayor que el 1 %.(5,6,7)
La frecuencia del polimorfismo p.K952L obtenida en este estudio es similar a la observada en uno de los estudios realizados en China,(10) sin que existan diferencias significativas; y como se esperaba, es mayor que el 1 %. En la otra investigación informada en China(5) hubo diferencias significativas y dos de las causas pudiera ser el origen étnico de la población y el número de muestras. En estudios posteriores, se analizará el impacto de este polimorfismo en los pacientes cubanos con diagnóstico presuntivo de la EW. En otros países, como Bulgaria,(11) y Taiwán(12) presentan este polimorfismo, pero no informan la frecuencia, por lo que no es posible comparar con sus resultados.
Para el diagnóstico molecular de enfermedades genéticas que posean uno o más genes con un número elevado de exones, se requiere de una tecnología de avanzada, que garantice el éxito del mismo. En el caso del gen ATP7B, posee 21 exones; el diagnóstico molecular se complejiza debido a la variedad de exones a estudiar, y la frecuencia de las mutaciones es baja. En la actualidad con el avance de la tecnología existen diversos estudios moleculares en los pacientes con la EW.(3,13,14,15,16,17) Sin embargo, hay que tener en cuenta que el médico que atiende al paciente con sospecha de EW, siempre debe hacer un minucioso diagnóstico clínico.(3)
En Cuba se han identificado mutaciones como p. L708P,(18,19) y p.N41S,(20) que han permitido el diagnóstico molecular de algunos pacientes. Sin embargo, una alternativa para el diagnóstico de la EW puede, ser el diagnóstico molecular por métodos indirectos, con la utilización de los polimorfismos. En tal sentido, se propone la utilización de los siguientes polimorfismos en los pacientes cubanos p.K832R,(21) p.L456V,(22) p.T991T(21) y p.K952L, para los estudios indirectos e incorporarlos en el diagnóstico molecular.
Se concluye, una vez identificado el polimorfismo p.K952L en el 60 % de los pacientes estudiados, que se dispone de una nueva herramienta molecular para ampliar el diagnóstico molecular de la EW en Cuba por métodos indirectos.
Los autores agradecen a los pacientes por participar en este estudio, así como a la DrC. Teresa Collazo, por sus aportes a la investigación; a Lídice Reyes, por realizar la extracción de ADN; al Ministerio de Salud Pública; al DrC. Georgios Loudianos y al DrC. Theodor Todorov, por el envío de controles positivos.
Conflicto de interés:
No existe conflicto de interés.
Contribución de los autores:
Conceptualización: Yulia Clark Feoktistova, Caridad Ruenes Domech, Elsa F García Bacallao
Curación de datos: Yulia Clark Feoktistova, Caridad Ruenes Domech, Elsa F García Bacallao
Análisis formal: Yulia Clark Feoktistova, Caridad Ruenes Domech, Elsa F García Bacallao
Investigación: Yulia Clark Feoktistova, Caridad Ruenes Domech, Elsa F García Bacallao, Hilda Roblejo Balbuena, Liudmila Feoktistova Victorova, Estela Morales Peralta
Metodología: Yulia Clark Feoktistova, Caridad Ruenes Domech, Elsa F García Bacallao, Hilda Roblejo Balbuena, Liudmila Feoktistova Victorova, Estela Morales Peralta
Visualización: Yulia Clark Feoktistova, Caridad Ruenes Domech, Elsa F García Bacallao, Hilda Roblejo Balbuena, Liudmila Feoktistova Victorova, Estela Morales Peralta
Administración del proyecto: Yulia Clark Feoktistova
Supervisión: Yulia Clark Feoktistova y Caridad Ruenes Domech
Validación: Yulia Clark Feoktistova y Caridad Ruenes Domech
Redacción-borrador original: Yulia Clark Feoktistova, Caridad Ruenes Domech, Elsa F García Bacallao, Hilda Roblejo Balbuena, Liudmila Feoktistova Victorova, Estela Morales Peralta
Redacción-revisión y edición: Yulia Clark Feoktistova y Liudmila Feoktistova Victorova.
Financiación:
Centro Nacional de Genética Médica e Instituto Nacional de Gastroenterología.