INTRODUCCIÓN
Las enfermedades infecciosas constituyen un problema de salud importante, tanto por su frecuencia de aparición como por su posible gravedad en las complicaciones locales o sistémicas que pudieran presentarse, de ahí la responsabilidad del prescriptor en el diagnóstico y tratamiento correcto de las mismas.
La aparición de los antibióticos en el siglo pasado, no solamente contribuyó a disminuir las tasas de morbilidad y mortalidad prohibitivamente altas que existían, sino que también cimentó las bases del progreso de procedimientos complejos y altamente riesgosos, tales como la profilaxis quirúrgica, quimioterapias, trasplantes de órganos y de células hematopoyéticas. Sería inconcebible la vida tal cual la conocemos actualmente sin la presencia de los antimicrobianos.
Este progreso alcanzado en la cura de las enfermedades infecciosas está amenazado debido al alza importante de las tasas de resistencia de las bacterias a los antibióticos, existiendo bacterias con una creciente tasa de resistencia. Según declaraciones de la Organización Mundial de la Salud, bacterias como la Escherichia coli, Klebsiella pneumoniae, Staphylococcus aureus y Streptococcus pneumoniae, seguidas de Salmonella spp, entre otras, tendrán tan alto su grado de resistencia que las enfermedades provocadas por ellas poseerán escasas o nulas opciones de tratamiento.(1)
En la época actual los hospitales del mundo ya han descrito desenlaces clínicos más desfavorables, atribuibles a este fenómeno: mayor estancia intrahospitalaria, mayores costos de atención médica y mayor tasa de muerte y discapacidad.
Esta revisión bibliográfica tiene como objetivo describir los aspectos más significativos del desarrollo de los antibióticos y su impacto en la sociedad.
DESARROLLO
Historia del desarrollo de los antibióticos
Las bacterias están presentes en nuestro planeta casi desde el inicio de la vida; en él han evolucionado y se han adaptado desde nuestros primeros ancestros. La terapéutica de las enfermedades infecciosas encontró, con el advenimiento de los antibióticos, un avance notable en la historia de la humanidad.
Desde tiempos inmemorables, casi con el propio surgimiento del hombre, las infecciones constituían una de las dolencias que más lo aquejaban, para lo cual buscaban diferentes tipos de remedios, sobre todo de plantas, minerales y algún que otro compuesto animal. Mediante el método de ensayo error, fueron encontrando aquellas con propiedades beneficiosas y el descubrimiento del fuego y su aplicación permitió la elaboración de los primeros preparados farmacéuticos.
Desde épocas tan lejanas como la Edad Media y el Renacimiento diferentes civilizaciones, entre ellas, chinos, griegos, romanos y otros pueblos ya aplicaban sustancias potencialmente activas contra estos procesos morbosos.
En los siglos XVIII y XIX se da un notable salto; en este sentido podemos mencionar los descubrimientos de Luis Pasteur realizado junto a Joubert en el bacilo del carbunco, donde queda demostrado la relación entre el microorganismo y el proceso infeccioso.(2)
El descubrimiento de los colorantes artificiales en el siglo XIX fue un hecho decisivo en la terapia antiinfecciosa, se aplicaron en el mundo de la microbiología, lo que posibilitó la diferenciación y clasificación de las bacterias en función de sus apetencias tintoriales.(2)
El destacado alemán Paul Ehrlich, eminente médico y bacteriólogo, ganador del premio Nobel de Medicina en 1908, fue el primero en aplicar los colorantes con fines terapéuticos en las infecciones. A partir de compuestos arsenicales obtuvo el atoxil y de este una gran cantidad de derivados. Su laboratorio descubrió la arsfenamina, el primer tratamiento medicinal eficaz contra la sífilis, iniciando así y dando nombre al concepto de quimioterapia.(2)
El colorante con más impacto en el tratamiento de las enfermedades infecciosas fue el rojo anaranjado o rojo prontosil, primera sulfamida; de él se obtuvieron, en pocos años, una gran variedad de derivados (sulfamidas). Uno de ellos, la sulfadiazina, que se introdujo en 1941, salvó numerosas vidas de soldados durante la Segunda Guerra Mundial. En 1949 estaban comercializadas más de 50 sulfamidas, tanto en forma tópica como oral.(2)
Con el descubrimiento de la penicilina y otras sustancias similares capaces de eliminar las bacterias, comenzó la época dorada para el tratamiento de las enfermedades infecciosas. Tras los primeros y extraordinarios resultados de la administración de antibióticos, la humanidad concibió la idea de eliminar las enfermedades infecciosas, por lo que el uso de los antimicrobianos constituyó un avance sin precedentes en la historia. Fue y es la curación y control de las enfermedades infecciosas lo que permitió modificar favorablemente el panorama de la morbilidad y mortalidad humana.
Durante la segunda mitad del siglo XIX, fueron surgiendo diferentes grupos de antimicrobianos. Infinidad de investigadores dieron continuidad a estos descubrimientos, apareciendo una gran diversidad de antimicrobianos agrupados según su estructura química y su acción sobre los microorganismos.
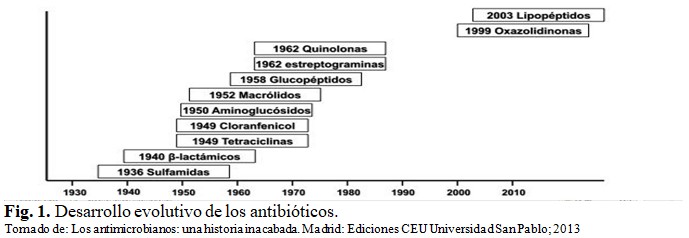
Así encontramos los antibióticos betalactámicos; que incluye las penicilinas, las diferentes generaciones de cefalosporinas, monobactámicos y carbapenemos. Tetraciclinas, macrólidos, fenicoles, aminoglucósidos, quinolonas y las familias más recientes oxazolidinonas, cetólidos, everninomicinas y estreprograminas, han arrebatado de la muerte a millones de pacientes, ya que hasta la cuarta década del siglo XX la mortalidad por enfermedades infecciosas predominaba en las estadísticas vitales.(2) (Fig. 1).
A todos estos grupos de antimicrobianos, además de su estructura química, los distingue su espectro antibacteriano y sus características farmacocinéticas, lo que permite realizar una prescripción adecuada siguiendo los criterios de eficacia, seguridad, conveniencia y costo y para ello se debe tener en cuenta las características del huésped, del germen y del fármaco.
Sin embargo, actualmente constituye una aspiración difícil la eliminación de las enfermedades infecciosas por los increíbles mecanismos de las bacterias de disminuir o inactivar la acción de los antimicrobianos, trayendo como consecuencia la no efectividad de estos.
Existe una preocupación considerable en este sentido, con la reciente aparición de factores de resistencia global que demuestran la naturaleza generalizada del problema, por lo que es de vital importancia mejorar la vigilancia mundial. Un ejemplo es el aumento de reportes de resistencia a los carbapenemos por cepas de Klebsiella pneumoniae en Estados Unidos; la detección de bacterias con el gen blaNDM-1 mediado por plásmido que confiere resistencia a los carbapenemos en la India; en otros lugares, como China, fue descubierto el gen mcr-1 de E. coli mediado por plásmidos que confiere resistencia a la colistina.(3)
Situación actual del desarrollo de los antibióticos
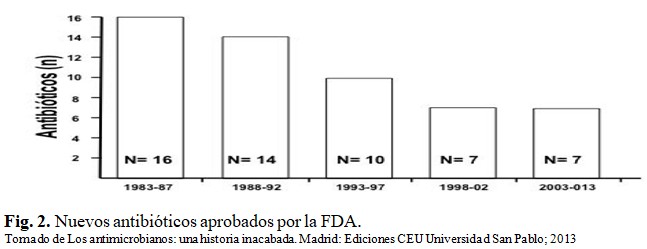
El estado actual de la terapia antimicrobiana no es la mejor, sobre todo a partir del año 2000. La época dorada de los antibióticos, cuando la aparición de nuevas moléculas era lo habitual, ha dado paso a otra de sequía en la que es raro el desarrollo de este grupo farmacológico. Entre 1983 y 1987 se aprobaron en Estados Unidos 16 nuevos antibióticos, lo que contrasta con los 7 aprobados entre 2003 y 2013. La situación no sólo no tiene perspectivas de mejorar, sino que, por el contrario, tiende incluso a empeorar, con un solo antibacteriano, doripenem, aprobado entre 2008 y 2013.(2) (Fig. 2).
La investigación básica en nuevos antibióticos es especialmente compleja. El largo tiempo de desarrollo de una molécula ronda los 10 años y a un elevado coste; 500-800 millones de moneda dura. De cada 5.000 a 10.000 compuestos inicialmente elegidos en la fase de investigación inicial, solo cinco logran alcanzar la fase de desarrollo clínico y, por término medio, solo uno llega a ser aprobado.(4)
Las diferentes agencias regulatorias y gobiernos se muestran cada vez más estrictos respecto a la eficacia y seguridad de los nuevos medicamentos, teniendo los nuevos antibióticos que demostrar su valía frente a todas y cada una de las diferentes indicaciones como la neumonía, infección intraabdominal, infección de piel y partes blandas, bacteriemia, entre otras infecciones, a diferencia de otros fármacos como los antimicóticos y los antivirales.(4)
El aumento de las exigencias y las dificultades regulatorias es especialmente costoso para los antibióticos, lo que afecta aún más su costo potencial y hace que proyectos inicialmente aceptables acaben considerándose inasumibles. Además, es pertinente recordar que el tiempo transcurrido entre la introducción de un nuevo antibiótico y la aparición de cepas resistentes es cada vez más corto, lo que se traduce en una pérdida de su eficacia; por esta causa dos de cada diez moléculas comercializadas producen ingresos que superan sus propios costos de inversión y, por tanto, deben cubrir las pérdidas que suponen las restantes, proporcionando además los beneficios precisos para mantener la elevada inversión en Investigación + Desarrollo a largo plazo.(4)
Tenemos, pues, por un lado, la existencia de una necesidad médica real de nuevos antibióticos para tratar a pacientes con patógenos resistentes de importancia para la salud pública y por otro, su clara desventaja competitiva entre las prioridades de inversión de las diversas compañías farmacéuticas. Lamentablemente, este último aspecto en la actualidad tiene mayor preponderancia y sitúa a los antibióticos al mismo borde de la viabilidad económica. Es por ello que, al no resultar una inversión rentable, la industria ha disminuido la investigación en este campo a favor de otros fármacos más provechosos, por ejemplo, los utilizados para enfermedades no transmisibles por lo que mucho habrán de cambiar las cosas si esperamos que con las actuales reglas de juego la industria farmacéutica sola, continúe proporcionándonos los nuevos antibióticos que necesitamos.
Se hace necesario fomentar la investigación y el desarrollo de nuevos antibióticos, movilizando recursos de los Estados, pero también explorar otras alternativas de profilaxis y tratamiento menos sujetas a la rápida aparición de resistencia.
Los péptidos antimicrobianos (AMP, por su sigla en inglés) son agentes naturales o sintéticos con actividad contra las membranas de los procariotas. Por ejemplo, las bacteriocinas son AMP producidas por prácticamente todas las especies bacterianas. Al ejercer presión selectiva solo sobre una especie bacteriana específica tendrían menor tendencia a desarrollar resistencia y podrían ser administrados en preparaciones múltiples o en combinación con antibióticos. Otra estrategia que podría prolongar la vida útil de los antibióticos es la búsqueda de un vehículo que los traslade directamente al sitio de infección. Las nanopartículas podrían cumplir esa función, para conseguir una concentración mayor del antibiótico que disminuya el riesgo de resistencia y evitar también la exposición al antibiótico de otras bacterias comensales. Los bacteriófagos, virus que infectan la célula bacteriana y producen su lisis, pueden actuar de manera más rápida y eficiente que cualquier antibiótico. Tienen también la ventaja de ser específicos para una especie bacteriana, por lo que administrados como tratamiento mantendrían al resto de la microbiota intacta. La terapia fágica y los probióticos podrían sustituir, al menos en parte, a los antibióticos en la profilaxis de infecciones en humanos y animales.(5)
No obstante, dos nuevos informes fueron presentados a la Organización Mundial de la Salud (OMS) a finales del 2019 (Antibacterial agents in clinical development - an analysis of the antibacterial clinical development pipeline y la publicación conexa Antibacterial agents in preclinical development). Ambos ponen de manifiesto que hay muy pocos agentes antibióticos en vías de desarrollo. Los 60 productos en desarrollo (50 antibióticos y 10 biológicos) aportan pocos beneficios con respecto a los tratamientos existentes, muy pocos están concebidos específicamente para luchar contra las bacterias resistentes que representan una mayor amenaza (bacterias gramnegativas) y son impulsados principalmente por pequeñas o medianas empresas, mientras que las grandes farmacéuticas siguen quedándose fuera.(6)
En los informes se pone de relieve una preocupante brecha en la actividad contra la NDM-1 (Nueva Delhi metalo-β-lactamasa 1) altamente resistente, ya que solo hay tres antibióticos en vías de desarrollo. La NDM-1 hace que las bacterias sean resistentes a una amplia gama de antibióticos, incluidos los de la familia de los carbapenemas, que hoy en día son la última línea de defensa contra las infecciones bacterianas resistentes a los antibióticos. Como dato más positivo cabe señalar que los agentes antibacterianos en vías de desarrollo para tratar la tuberculosis y la infección por Clostridium difficile (que provoca diarrea) son más prometedores, ya que más de la mitad de los tratamientos cumplen todos los criterios de innovación definidos por la OMS.(6)
La línea de desarrollo preclínico es más innovadora y diversa: se están desarrollando 252 agentes para tratar los patógenos prioritarios establecidos por la OMS, pero estos productos se encuentran en las primeras fases de desarrollo y en el mejor de los casos, los primeros dos a cinco productos estarán disponibles en unos 10 años.(6)
Es por ello que, en el ámbito de la investigación y el desarrollo, la OMS y la Iniciativa Medicamentos para las Enfermedades Desatendidas han establecido la Alianza Mundial para la Investigación y Desarrollo de Antibióticos (GARDP), cuya estrategia es ofrecer cinco nuevos tratamientos para 2025. La GARDP trabaja con más de 50 asociados de los sectores público y privado en 20 países para desarrollar y garantizar el acceso sostenible a los tratamientos, promoviendo su uso responsable y su asequibilidad para todos los que los necesiten.(6)
Estas acciones de investigación y desarrollo sin fines de lucro, pudieran ser la solución para el registro de nuevos y mejores antibióticos para combatir las infecciones farmacorresistentes y de esta forma modificar el panorama infeccioso actual que es bastante complejo.
La resistencia bacteriana a los antibióticos
Se entiende por resistencia el mecanismo a través del cual la bacteria puede disminuir o inactivar la acción de los agentes antimicrobianos. Este fenómeno no es más que la historia evolutiva de los organismos vivos en su intento de adaptarse a un medio que le es hostil y está presente también en los parásitos multicelulares y en las células malignas.(7)
Cuando un nuevo antimicrobiano amenaza la supervivencia de un microorganismo, este desarrolla complejos mecanismos de resistencia para sobrevivir, y como generalmente el medicamento se sigue utilizando, los gérmenes sensibles mueren, pero los resistentes se siguen multiplicando. Se produce una selección de cepas resistentes que se incrementa hasta que aparezca un nuevo fármaco antimicrobiano capaz de destruirlo.(7)
La resistencia bacteriana puede aparecer de forma natural y adquirida. Esta última se produce por una mutación cromosómica o la bacteria adquiere un plásmido de resistencia, es decir, un fragmento extracromosómico de ADN portador de genes que modifican la resistencia al antibiótico. La información genética, presente en algunos plásmidos, es un factor importante en la patogenicidad o la invasividad de las bacterias, en la velocidad de aparición de cepas patógenas o invasivas resistentes a los fármacos antimicrobianos y en la evolución del cuadro clínico.(7)
Considerada en décadas pasadas un problema exclusivamente intrahospitalario, la resistencia bacteriana ahora también se ha extendido a la comunidad, como resultado del trasiego de enfermos que ingresan y son dados de alta, trasladando las bacterias resistentes al exterior. A esto se ha sumado la globalización, con ilimitados intercambios de personas y mercaderías, tanto en el ámbito nacional como internacional, lo que agrava el problema y contribuye a la diseminación de los gérmenes resistentes.(7)
La crisis actual es indudablemente resultado del comportamiento del hombre, que ha provocado un aumento exponencial en la exposición de las bacterias, patógenas y no patógenas, a los antibióticos. Un ejemplo del aumento vertiginoso de la resistencia es la historia evolutiva reciente de las enzimas capaces de inactivar los antibióticos beta-lactámicos: el número de beta-lactamasas identificadas se ha multiplicado por diez desde 1990, sobrepasando actualmente las 1.000 enzimas diferentes.(5)
Hace no muchos años se hacía particular énfasis en seis organismos intrahospitalarios resistentes: Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa y Enterobacter spp (el tan citado acrónimo ESKAPE). Sin embargo, cada vez está mejor documentada en la comunidad la presencia de infecciones cutáneas por SARM, de infecciones de vías urinarias por bacilos gramnegativos productores de betalactamasas de espectro extendido (BLEE) y carbapenemasas, de tuberculosis multidrogorresistente y extensamente drogorresistente, e incluso de enfermedades de transmisión sexual por Neisseria gonorrhoeae resistente. Se incluyen microorganismos como Campylobacter spp resistente, Candida spp resistente a fluconazol, enterococo resistente a vancomicina, Salmonella spp resistente, Shigella spp resistente, Streptococcus pneumoniae resistente y otras especies de estreptococo resistentes a eritromicina y clindamicina.(1)
En 2017, la OMS publicó su primera lista de "patógenos prioritarios" resistentes a los antibióticos, en la que se incluyen las doce familias de bacterias más peligrosas para la salud humana. Esta lista se elaboró para tratar de guiar y promover la investigación y desarrollo de nuevos antibióticos, como parte de las actividades que realizan para combatir el creciente problema mundial de la resistencia antimicrobiana. El grupo de prioridad crítica incluye las bacterias multirresistentes que son especialmente peligrosas en hospitales, residencias de ancianos y entre los pacientes que necesitan ser atendidos con dispositivos como ventiladores y catéteres intravenosos. Entre tales bacterias se incluyen las siguientes: Acinetobacter baumannii, Pseudomonas y varias enterobacteriáceas como Klebsiella pneumoniae, Escherichia coli, Serratia, y Proteus. Son bacterias que pueden provocar infecciones graves y a menudo letales.(8)
Este aumento creciente de la resistencia bacteriana, no es exclusiva de un país determinado, sino que es un fenómeno global.
En España, que es considerada como uno de los países de la Unión Europea con mayores tasas de resistencia bacteriana, sobre todo en patógenos comunitarios (Streptococcus pneumoniae, Hemophilus influenzae, Escherichia coli, Salmonella spp) ha ocurrido también un rápido aumento de la resistencia a cefalosporinas de tercera generación e imipenem en cultivos de Klebsiella pneumoniae.(7,9)
Estimaciones recogidas en el Informe O´Neill, presentado por el Gobierno del Reino Unido en 2016 muestran que, si no se controla la resistencia, para el año 2050 las infecciones por bacterias resistentes causarán 10 millones de muertes anuales, sobrepasando la mortalidad por cáncer, además de afectar la economía mundial con cifras que alcanzarían los 100 mil millones de dólares al año.(10)
Datos presentados en el reporte de 2019 por el Centro para Control y Prevención de Enfermedades de los Estados Unidos confirman que más de 2.8 millones de infecciones resistentes a los antibióticos ocurren cada año y más de 35 000 personas mueren como resultado de estas en ese país.(11)
En América Latina, la situación es variable ya que, países como Colombia, Argentina y México exhiben altos porcentajes de infección por baterías resistentes.
En una clínica de tercer nivel de la ciudad de Medellín en Colombia se realizó un estudio de la susceptibilidad de microorganismos aislados de muestras clínicas encontrándose altos porcientos de resistencia de las bacterias frente a los antibióticos probados.(12)
En Argentina se realizó una revisión retrospectiva durante 12 años de las infecciones por Staphylococcus aureus en pacientes adultos y pediátricos asistidos en un Hospital para, entre otras cosas, analizar el perfil de resistencia antimicrobiana, observándose un incremento notable de la misma.(13)
En estudio realizado en México, en el período del 2009 a 2012, mostró que la Pseudomonas aeruginosa pasó del 47.1 al 60.5 porciento de resistencia a imipenem; Escherichia coli mostró un aumento en la resistencia a aztreonam, cefepime y ceftazidima; Acinetobacter baumannii incrementó su resistencia a amikacina, cefepime, ceftazidima y ciprofloxacino y la resistencia a vancomicina creció del 3.6 al 25.5 por ciento.(14)
Cuba no está ajena a esta situación. El Staphylococcus aureus es responsable de elevadas tasas de infección nosocomial y comunitaria a lo largo de la isla y ha sido mejor estudiado en provincias como Sancti Spíritus, La Habana, Ciego de Ávila, Holguín y Cienfuegos.
Un estudio transversal de 79 cepas de Staphylococcus aureus en muestras de pacientes ingresados en el Hospital “Camilo Cienfuegos” de Sancti Spíritus desde el 1 de diciembre de 2011 al 30 de mayo de 2012, mostró que la mitad de las cepas estudiadas resultó resistente a meticilina. La susceptibilidad a los antibióticos mostró elevados porcentajes de resistencia, excepto para vancomicina y tetraciclina.(15)
En el Hospital Ortopédico Docente “Fructuoso Rodríguez” se realizó un estudio de enero a mayo de 2014 en el que se analizaron 134 muestras de pacientes hospitalizados y se encontró que 50,9 % de los aislamientos de Staphylococcus aureus fueron meticillin resistentes. No se encontró ninguna cepa resistente a vancomicina. Los aislamientos de SARM resultaron ser significativamente más resistentes que los de S. aureus meticillin sensibles para eritromicina y las tetraciclinas (tetraciclina y doxiciclina) lo que representó un aumento en la estadía hospitalaria y en el costo de la atención médica en aquellos pacientes con infecciones por SARM.(16)
Otro estudio realizado en el Servicio de Otorrinolaringología del Hospital Universitario “Dr. Antonio Luaces Iraola” de Ciego de Ávila muestra resultados de aumento de la resistencia de los antibióticos a las bacterias aisladas.(17)
También se realizó un estudio descriptivo en el Hospital “Dr. Gustavo Aldereguía Lima”, de Cienfuegos, a partir del análisis de muestras clínicas de pacientes atendidos en dicha institución durante el año 2014, en las cuales se aisló el SARM que mostró mayor resistencia a eritromicina y azitromicina, tanto en pacientes hospitalizados como atendidos en consulta externa. Se obtuvieron 15 patrones de corresistencia, de los cuales el patrón azitromicina, eritromicina, ciprofloxacino, fue el más frecuente.(18)
En el Hospital "Hermanos Ameijeiras", centro médico de atención terciaria de altísima complejidad se han efectuado investigaciones en las que se ha observado un incremento de los patrones de resistencia bacteriana. En el caso del SARM, con valores que fluctúan entre un 20-80 porciento y siendo responsables de las infecciones hospitalarias o nosocomiales. También el Acinetobacter baumannii, resistente no sólo a la mayor parte de los antibióticos disponibles, sino también a condiciones adversas del medio donde se desarrolla, muestra la mayor resistencia frente al meropenem que se tenía como antimicrobiano de elección en estas infecciones en pacientes críticos y se asocia con mayor frecuencia a infecciones nosocomiales graves y a la muerte. Esta especie se ha convertido en uno de los gérmenes de mayor relevancia clínica, constituyendo un verdadero paradigma de las infecciones nosocomiales multirresistentes.(19,20,21)
Aunque la dispersión mundial de la resistencia a antibióticos tiene un origen multifactorial, la inadecuada utilización de los antibióticos es el principal factor que facilita y condiciona dicho proceso. Está dada por prescripciones superfluas (cuando se prescriben y no son necesarios), omisión de la prescripción (cuando son necesarias y no se prescriben), dosis inadecuadas (en exceso o defecto), duración inapropiada (tratamientos prolongados o muy cortos), selección inadecuada (cuando no hay concordancia entre la etiología y el espectro de cobertura del fármaco), gasto innecesario (cuando se seleccionan drogas nuevas y caras existiendo más antiguas, baratas y clínicamente efectivas) y riesgo innecesario (al elegir las vías endovenosa o intramuscular cuando la vía oral es la adecuada).
Por tanto, la solución óptima de la resistencia bacteriana radica en el uso racional de los antibióticos por el sistema sanitario, a través de un conjunto de intervenciones coordinadas para mejorar la selección del mismo, dosis, duración y vía de administración óptimos con el objetivo de minimizar la toxicidad, mejorar los desenlaces clínicos, reducir los costos y disminuir la presión selectiva para el surgimiento de organismos resistentes. Pero se sabe que esta responsabilidad no es competencia exclusiva de los sistemas de salud, aunque el ámbito médico tenga la obligación de liderar estos esfuerzos.
Esto está dado, porque el 40 porciento del consumo global de este grupo de fármacos se da en actividades de ganadería, agricultura, acuicultura y una proporción menor en actividades de investigación y desarrollo de productos higiénicos. El paso de los antibióticos a los ambientes terrestres y acuáticos, como resultado de estas usanzas, selecciona bacterias resistentes y aumenta la frecuencia de variación genética en ellas fomentando la mutación, la recombinación de ADN y la transferencia horizontal de variantes y de nuevos genes de resistencia a los mismos.(22)
Los líderes mundiales reunidos en la Asamblea General de las Naciones Unidas (ONU) en 2016, en lo que se califica como hecho sin precedentes, centraron su atención en cómo detener la propagación de las infecciones resistentes a los medicamentos antibióticos. Por vez primera, los Jefes de Estado se han comprometido a adoptar una estrategia de amplio alcance y coordinada para abordar las causas fundamentales de la AMR (resistencia a los antibióticos) desde un enfoque “One Health” implicando como “una sola salud” a la salud humana, la salud animal y al medio ambiente.(23)
En la declaración se dice que la resistencia a los antibióticos es el riesgo mundial más grave y urgente y requiere una mayor atención y coherencia a nivel internacional, nacional y regional. En la asamblea se alertó sobre la amenaza que este problema supone sobre la consecución de los Objetivos de Desarrollo Sostenible y que requiere una respuesta global. Los países reafirmaron su compromiso de desarrollar planes nacionales de acción frente a las resistencias a los antibióticos, basándose en el Plan de Acción Mundial para la Resistencia a los Antimicrobianos establecido en mayo de 2015, por la sexagésima octava Asamblea Mundial de la OMS, en colaboración con la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y la Organización Mundial de Sanidad Animal (OIE). La principal aportación de esta Asamblea es la coordinación mundial, más allá de los planes nacionales para paliar un problema, ya que diversos organismos internacionales, tales como la FAO, la OIE y la OMS ya habían publicado numerosos documentos y directrices destinadas a promover el uso prudente de los antibióticos, tanto en medicina humana como en medicina veterinaria. Además, el problema de la resistencia a los antibióticos se ha incluido en agendas de grupos como el G20 o el Foro de Davos, valorado entre los riesgos importantes para la economía mundial y que se debe abordar desde una perspectiva multisectorial.(24, 25)
One Health o «Una Salud» es un término utilizado para describir un principio que reconoce que la salud humana y animal están interconectadas, que las enfermedades se transmiten de los humanos a los animales y viceversa y, por lo tanto, deben abordarse desde ambos aspectos. Hacer frente a la creciente amenaza de la resistencia a los antibióticos requiere un enfoque holístico y multisectorial porque los antibióticos utilizados para tratar diversas enfermedades infecciosas en animales pueden ser los mismos o similares a los utilizados en humanos. Este enfoque también abarca el medio ambiente, otro vínculo adicional entre humanos y animales, y también una fuente potencial de nuevos microorganismos resistentes.(26)
Desde el Consejo de la Unión Europea, el Parlamento Europeo, la Comisión y sus Agencias (EMA, ECDC y EFSA) se había identificado la necesidad de una estrategia común europea para valorar y afrontar el problema. España impulsó la creación de un Plan Nacional de Resistencias a los Antibióticos que fue adoptado en el año 2014 y desde entonces se han desarrollado numerosas medidas y acciones para combatir este fenómeno en línea con las políticas comunitarias y el plan mundial de la OMS antes mencionado. Este se estructura en seis líneas estratégicas, comunes para la sanidad humana y veterinaria, subdividida en medidas y acciones concretas.(27)
Varios países en Europa han desarrollado con financiación pública programas para la vigilancia de la resistencia a los antibióticos, así como EE. UU., Canadá, China, Corea, Tailandia, Singapur y Australia, entre otros. Pero la red europea de vigilancia de resistencia a los antibióticos (European Antimicrobial Resistance Surveillance Network) es probablemente la base de datos supranacional más importante en este ámbito. En la misma se recoge información de unos 1.400 hospitales (que atiende en torno a los 100 millones de habitantes) procedente de múltiples redes nacionales que envían su información al European Center for Disease Prevention and Control. La base de datos abarca los microorganismos causantes de infecciones invasivas, para los que se dispone de información comparativa de más de 400.000 aislados obtenidos desde 1999.(28)
En la misma línea, los países de las Américas respaldaron el Plan de Acción Regional sobre Resistencia a los Antimicrobianos, adoptado por el 55to Consejo Directivo de la Organización Panamericana de la Salud (OPS). El plan regional, alineado con el Plan Mundial, prioriza una estrategia coordinada hacia la mejora de la vigilancia integrada de la resistencia a los antibióticos, con una respuesta multisectorial al reconocer las diversas necesidades de salud pública, recursos y prácticas dentro de la región.(29)
Los países latinoamericanos integran la Red Latinoamericana de Vigilancia de la Resistencia a los Antibióticos (ReLAVRA) coordinada por la OPS/OMS. Esta red fue creada en 1996 con el fin de obtener datos microbiológicos fidedignos, oportunos y reproducibles para mejorar la atención del paciente y fortalecer la vigilancia de la resistencia a los antibióticos mediante programas de garantía de calidad sostenibles en todos los laboratorios latinoamericanos de microbiología clínica humana, a fin de estandarizar la nomenclatura de categorización de los niveles de resistencia en bacterias patógenas causantes de infecciones comunitarias o asociadas a la atención de la salud. En una reunión bienal conjunta de ReLAVRA y la Red Interamericana de Laboratorios de Análisis de Alimentos en Montevideo, Uruguay, el 30 de noviembre de 2017, los representantes de todos los países que en la actualidad forman parte de ReLAVRA participaron de la elaboración de un Consenso Latinoamericano para definir, categorizar y notificar patógenos multirresistentes, con resistencia extendida o panresistentes, el cual fue revisado y distribuido a todos los centros nacionales de referencia para su aprobación.(29)
Además de esta red existen otras dos redes orientadas a la vigilancia de la resistencia en alimentos. En el 2004, los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos (CDC) en colaboración con la OPS/OMS iniciaron un programa en América Latina, denominada Red de vigilancia de Pulse Net Latinoamérica, con la meta de fortalecer la cooperación técnica entre países participantes. Está conformada por los laboratorios de referencia en 14 países (Argentina, Bolivia, Brasil, Chile, Colombia, Costa Rica, Cuba, Guatemala, México, Nicaragua, Paraguay, Perú, Uruguay y Venezuela).La misma estableció la capacidad en los países participantes para la identificación del genotipo de cepas de bacterias patógenas con protocolos estandarizados. La vigilancia se centra en agentes patógenos seleccionados (Salmonella spp., Vibrio cholerae, Escherichia coli O157, Shigella spp., Campylobacter spp., Listeria monocitogenes), creando una base de datos regional de los aislamientos. También existe la Red Mundial de Infecciones Transmitida por los Alimentos, creada en el 2011 por el Departamento de Inocuidad de los Alimentos, Zoonosis y Enfermedades de Transmisión Alimentaria de la OMS.(30)
Cuba, además de ser miembro de ReLAVRA y Pulse Net Latinoamérica, lo es de la Alianza para el Uso Prudente de los Antibióticos (APUA) desde el año 1996; organización internacional compuesta por más de 60 capítulos nacionales de cinco continentes y con miembros individuales de más de 100 países. Esta organización surge en 1981 destinada a promover el uso racional y adecuado de los antibióticos reconociendo que la resistencia a estos compuestos es uno de los problemas de mayor magnitud que enfrenta el siglo XXI en relación con las enfermedades infecciosas.(31)
Desde 1998, en Cuba, mediante el Programa Nacional de Medicamentos, se han desarrollado estrategias para promover la prescripción y uso racional de los fármacos, con énfasis en algunos grupos terapéuticos donde se destacan por su importancia los antibióticos. En cada unidad asistencial existe una Política Antimicrobiana, un Comité Fármaco-Terapéutico y específicamente un Comité de Antibióticos, que norman su utilización (protocolos de actuación) en la distintas patologías, existiendo determinados antibióticos que para su indicación y aplicación tienen que ser discutidos en el Comité, como son: cefalosporinas de 4ta generación, carbapenémicos, vancomicina, ureidopenicilinas; estos solo son de consumo intrahospitalario, no pueden ser extraídos ni adquiridos fuera de los hospitales.(32,33)
Respecto al uso comunitario, que se considera el 90% del consumo, en farmacias comunitarias existe un restringido número de antibióticos, todos por receta médica y al formular la misma se requiere definir el diagnóstico que motivó la prescripción en el recetario. Los mismos están dirigidos al tratamiento de patologías infecciosas no graves, que no necesitan ingreso hospitalario. Se han realizado intervenciones reguladoras del uso de los medicamentos como la restricción de su prescripción a determinados especialistas y listas limitadas.(32)
Para, un tanto, contrarrestar ese uso inadecuado se trabaja constantemente, tanto a nivel comunitario como hospitalario, en la divulgación y actualización del uso de los antibióticos a través de los comités de farmacia y terapéutica e intervenciones educacionales como los programas de educación continuada, boletines, guía terapéutica, guías para la práctica clínica para el manejo de algunas de las patologías infecciosas más frecuentes, intercambios con líderes de opinión, talleres, simposios, congresos, y de esta forma tratamos de controlar que nuestros niveles de resistencia bacteriana no asciendan, al menos excesivamente.(32)
También se ha fortalecido el conocimiento a través de la vigilancia e investigación, en el Instituto Pedro Kouri (IPK) se han llevado a cabo protocolos avalados internacionalmente para la búsqueda de fenotipos emergentes de resistencia y la vigilancia sostenida. Estos protocolos han permitido detectar y alertar oportunamente sobre la circulación en Cuba de patógenos gramnegativos causantes de infecciones asociadas a la asistencia sanitaria productores de carbapenemasas tipo KPC y NDM-1, una de las más temibles amenazas sobre la que la OMS ha llamado la atención, así como una prevalencia elevada de E. coli y K. pneumoniae productora de BLEE, a nivel nacional.(33)
Por tanto, podemos decir que la vigilancia epidemiológica general en las instituciones y localidades, los Comité de Infección Hospitalaria, la información de las resistencias a través de los mapas microbiológicos periódicos, el análisis de la calidad del adecuado uso de antibióticos, las medidas restrictivas de la prescripción y las intervenciones educacionales que se realizan en la mayoría de los países del mundo, son acciones importantes para el enfrentamiento a esta problemática de salud.
Impacto de la resistencia bacteriana a los antibióticos
En los albores del siglo XXI, después de más de ocho décadas de tratamiento con antibióticos, las enfermedades infecciosas constituyen la segunda causa de muerte, la primera de años perdidos de vida saludable por discapacidad en el mundo y la tercera de muerte en los Estados Unidos. Entre las infecciones que causan mayor mortalidad a nivel mundial, predominan las del tracto respiratorio inferior, el VIH/SIDA, las enfermedades diarreicas, la tuberculosis y la malaria. Esta situación tan dramática contrasta con las predicciones de algunos como el “Cirujano General de los Estados Unidos”, William H. Stewart, quien, en diciembre de 1967, al contemplar los beneficios logrados por los antibióticos y las vacunas, declaró la victoria contra la amenaza de las enfermedades infecciosas. A pesar de los esfuerzos, el panorama infeccioso actual es bien distinto.(34)
En un comunicado de prensa emitido el 29 de abril de 2019, la ONU, varios organismos internacionales y un grupo de expertos han hecho público un alarmante informe en que se pide una acción inmediata, coordinada y a gran escala para evitar una crisis causada por la resistencia a los antibióticos, que podría tener consecuencias desastrosas. Se advierte que, si no se toman medidas el continuo incremento de la resistencia hacia el año 2050 podría causar 10 millones de defunciones anuales.(35)
El Foro Económico Mundial considera la resistencia a los antibióticos una amenaza real para el desarrollo de la economía en los próximos años; un estudio publicado por el Banco Mundial en marzo de 2017 estimó que podría representar un lastre en el producto interior bruto (PIB) global de 1,1-3,8 puntos porcentuales hasta 2050, lo que podría sumir en la pobreza extrema hasta 24 millones de personas por lo que tendría un impacto económico global.(36)
La resistencia a los antibióticos es un problema social multifactorial, con implicaciones microbiológicas, terapéuticas, económicas, epidemiológicas y de salud pública; cuestan dinero, medios de subsistencia, vidas humanas y amenazan con socavar la eficacia de los programas de atención a la salud.
- Impacto biológico
Los antibióticos no sólo se usan en clínica humana (profilaxis y tratamiento), sino también en veterinaria, en agricultura o en otras situaciones más singulares, como el tratamiento de oleoductos. Hay evidencias sólidas de que el ecosistema de las bacterias resistentes forma un nicho único. Esto tiene impacto en el medio ambiente, ya que puede disminuir la diversidad biológica.(22)
La selección de resistencias en el medio hospitalario, en la comunidad o en animales, acaba teniendo un impacto en el resto de estos ecosistemas parciales. Con frecuencia, las cepas resistentes a una familia de antibióticos suelen ser resistentes también a otras familias de compuestos que no están relacionados por sus mecanismos de acción o de resistencia. La mayoría de estos mecanismos, suponen también un coste biológico para el microorganismo.(34)
- Impacto para el diagnóstico microbiológico
El problema de la resistencia tiene un impacto inmediato en la actividad del laboratorio de microbiología clínica, donde se lleva a cabo la detección del problema. Esta tarea, sin embargo, no siempre es sencilla, ni barata y requiere personal con suficiente formación e infraestructuras mínimas que garanticen la posibilidad de llevar a cabo los estudios pertinentes y el análisis fiable de los resultados obtenidos. La realización de pruebas rápidas (point-of-care) ha estado influenciada por los costes, lo cual ha limitado su uso sin valorar el impacto clínico de su utilización.(34,37)
- Impacto clínico-terapéutico
Este tiene mayor repercusión pues compromete gravemente la eficacia del tratamiento antibiótico. Las infecciones por cepas resistentes suelen aparecer en pacientes más graves, la demostración de una cepa resistente disminuye considerablemente las opciones para un tratamiento dirigido correcto, obligando al uso de antibióticos con mayor espectro o actividad intrínseca, que podrían haberse reservado para una menor proporción de casos.
- Impacto económico en los sistemas de salud
Las infecciones bacterianas por bacterias multirresistentes son más difíciles de tratar con lo que en ocasiones se generan procesos patológicos más largos y más graves, mayores períodos de contagio, aparición de efectos secundarios e ingresos hospitalarios más prolongados con el consiguiente aumento de costes hospitalarios y se asocian a una mayor mortalidad. Algunas estimaciones establecen este cálculo en cuatro millones de días extras, aumentando con ello la carga económica para los sistemas de salud hasta en 1.500 millones de euros al año.(38)
- Impacto epidemiológico
La selección de cepas resistentes no solo es importante para un paciente aislado que esté recibiendo antibióticos, pues dichas cepas pueden acabar colonizando e infectando a individuos sanos o a pacientes no infectados. Cabe, pues, la diseminación entre unidades del mismo hospital, o entre hospitales de la misma zona, e incluso entre centros de diferentes áreas, en el caso de pacientes trasladados, a veces procedentes de países donde la resistencia supone un problema grave. Es obvio, por todo ello, que las consecuencias de la resistencia sobrepasan el ámbito del paciente, para entrar en el de la salud pública.(34,38)
- Impacto en la industria farmacéutica
Finalmente, el imparable aumento y la diseminación de microorganismos resistentes implican la necesidad de desarrollar a corto y medio plazo nuevos antibióticos que puedan ser usados en un entorno de multirresistencia creciente, lo cual conlleva un enorme gasto en innovación y desarrollo por la industria farmacéutica.(34)
CONCLUSIONES
Los antibióticos son el resultado del desarrollo científico tecnológico del hombre y constituyen una clase única de fármacos por su impacto en la sociedad, ya que han prestado y siguen prestando un enorme servicio a la humanidad, reduciendo significativamente la mortalidad de las enfermedades infecciosas. En los últimos años han perdido efectividad por el aumento de las resistencias bacterianas, sin que haya nuevos agentes sustitutivos.
La resistencia a los antibióticos es un problema social que tiene gran impacto microbiológico, terapéutico, económico, epidemiológico y en la salud pública; cuesta dinero, medios de subsistencia, vidas humanas y amenaza con socavar la eficacia de los programas de atención a la salud. Por esta razón el uso de este grupo farmacológico requiere de un enfoque integral con el concepto de una única salud, teniendo en cuenta las consecuencias, tanto positivas como negativas que puede tener su empleo para la salud humana y la existencia de la humanidad y debe sustentarse en las más estrictas consideraciones éticas y bioéticas.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Contribuciones de los autores
Conceptualización: Diana Rosa Fernández Ruiz; Maira Quirós Enríquez; Olga Lidia Cuevas Pérez.
Visualización: Olga Lidia Cuevas Pérez.
Redacción del borrador original: Diana Rosa Fernández Ruiz
Redacción, revisión y edición: Diana Rosa Fernández Ruiz; Maira Quirós Enríquez; Olga Lidia Cuevas Pérez.
Financiación
Universidad de Ciencias Médicas de Cienfuegos. Cuba.