INTRODUCCIÓN
Los coronavirus pertenecen a la familia Coronaviridae y deben su nombre a la apariencia detectada a través de la microscopía electrónica, donde se pueden observar proyecciones proteínicas externas, que dan a la partícula vírica un aspecto de corona. Son capaces de producir enfermedades en animales y en los humanos el espectro clínico incluye desde un simple resfriado, hasta neumonías y síndrome de dificultad respiratoria.(1,2)
La primera epidemia de severe acute respiratory syndrome (SARS, por sus siglas en inglés) se inició en el año 2002 en China, hubo más de 8000 pacientes afectados y se reportaron 774 muertes relacionadas con la infección. Posteriormente, en el año 2012, ocurrió en Arabia Saudita el brote de middle east respiratory síndrome (MERS, por sus siglas en inglés), con 2494 casos y 858 defunciones.(3,4) A finales de diciembre del año 2019 se reportaron en Hubei, China, casos de infección respiratoria causada por un nuevo coronavirus: el SARS-CoV-2. A la enfermedad provocada se le denominó COVID-19 y fue considerada por la Organización Mundial de la Salud (OMS) como pandemia, el 11 de marzo del año 2020.(5) Una importante proporción de los casos progresan a formas graves, aproximadamente 5 % de los pacientes requieren de cuidados intensivos y más de 20 % de los casos críticos, fallecen por la enfermedad.(6)
En ausencia de una terapia efectiva y específica, el tratamiento para el SARS-CoV-2 ha sido principalmente empírico y experimental.(7) En la actualidad se desarrollan múltiples ensayos en busca de nuevas alternativas terapéuticas que pudieran aplicarse. Entre ellas destacan:
1- Inhibidores de la síntesis del ácido ribonucleico (ARN) viral: remdesivir, favipiranir, rivabirina, lopinavir y darunavir.
2- Inhibidores de la entrada del virus a la célula: camostat, umifenovir, hidroxicloroquina, cloroquina, oseltamivir, baricitinib.
3- Inmunomoduladores y otras terapias inmunes: corticoides, tocilizumab, siltuximab, inmunizaciónpasiva.
Entre las formas de inmunización pasiva, el uso de trasfusiones de plasma de convalecientes (PC), obtenido de pacientes recuperados de la COVID-19, resulta de gran interés, apoyado por los datos históricos de su empleo en otras enfermedades infecciosas emergentes.(8,9)
Con el objetivo de examinar aspectos relacionados con la eficacia y seguridad de esta terapia, durante la actual pandemia, se realizó esta revisión.
DESARROLLO
Antecedentes históricos
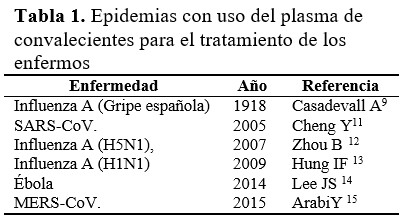
El uso terapéutico de derivados de la sangre, obtenidos de pacientes recuperados de diversas enfermedades, data de finales del siglo XIX.(10) En la década del 30 del pasado siglo, se utilizaba el suero como tratamiento de la escarlatina, de la neumonía neumocócica y de otras infecciones. Su indicación disminuyó después de 1950, debido al desarrollo de los antibióticos, pero, en los últimos años, se ha renovado el interés por la transferencia pasiva de anticuerpos (Ac). En la tabla 1 se detallan las epidemias en las cuales se usó transfusiones de PC como forma de tratamiento.
Justificación del uso de plasma de pacientes convalecientes
La inmunidad puede ser innata y adaptativa. La inmunidad innata constituye la primera línea de defensa contra agentes patógenos. Se compone por mecanismos de defensa celulares y bioquímicos que existen previos a cualquier infección. Utiliza mecanismos de reconocimientos groseros, reacciona de forma idéntica a exposiciones repetidas de diferentes patógenos.(16) La inmunidad adaptativa (activa y pasiva) es la que surge como respuesta a una infección, es específica y deja memoria, por lo que respuestas posteriores serán más efectivas. En la forma activa hay formación de mediadores de la respuesta inmune por la exposición a un antígeno extraño. En la pasiva, existe un estado transitorio que genera la transferencia de plasma, suero o linfocitos procedentes de un individuo previamente inmunizado a otro sujeto.(17)
La inmunización pasiva, como principio general, busca evitar el desarrollo de enfermedades en pacientes infectados que no cuentan con el tiempo necesario para desarrollar una respuesta inmune adaptativa propia. Su aplicación se justifica en infecciones graves y cuando hay supresión o inmadurez del sistema inmune del receptor. En caso de enfermedades en curso, la inmunización pasiva pudiera disminuir la gravedad del proceso y acortar su duración.
Aspectos básicos para la obtención y transfusión del plasma
El PC se obtiene de enfermos “recuperados” de la COVID-19. De manera general, los pacientes deben estar sin manifestaciones respiratorias, ni fiebre por más de siete días, con mejoría radiográfica, negativización del test de ácido ribonucleico (ARN) para SARS-CoV2 (realización del estudio en dos o más ocasiones) y tener prueba para Ac IgM negativa y positiva para Ac IgG.(18) Además los estudios de detección de sífilis, virus B y C de la hepatitis y virus de la inmunodeficiencia humana (VIH), deben ser negativos.
Se colecta entre 400 y 900 mL de plasma por aféresis, este volumen puede fraccionarse en bolsas de aproximadamente 200-225 mL. La extracción se efectúa entre los 14 y 21 días posteriores al inicio de los síntomas, teniendo en cuenta que los Ac anti-coronavirus, raramente aparecen antes de las dos o tres semanas.(19,20)
El título de Ac IgG del donante, no ha sido considerado en todos los estudios realizados. En los que fueron tomados en cuenta, debían tener un valor mínimo por encima de 1: 160. La pesquisa de los títulos de Ac en los recuperados de la enfermedad puede realizarse por técnicas de ELISA (acrónimo del inglés enzyme-linked immunosorbent assay, ensayo por inmunoabsorción ligado a enzimas).(21)
En algunos casos, el hemocomponente se ha sometido a inactivación viral con azul de metileno y fototerapia.(22) La trasfusión se cumple considerando la compatibilidad ABO, de acuerdo a los procedimientos establecidos para la administración de plasma.(23,24)
Estudios clínicos del uso de transfusiones de plasma de convalecientes en pacientes con COVID-19
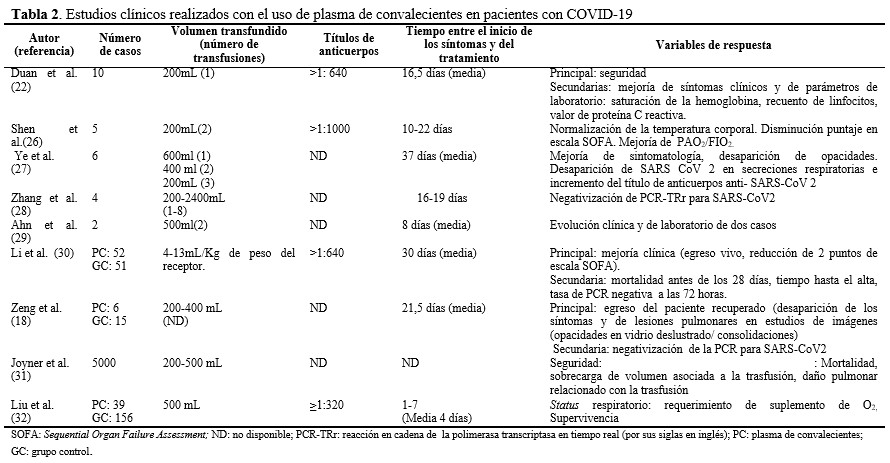
Aunque en la COVID-19 no está bien establecida la correlación entre gravedad de la enfermedad y la respuesta de los Ac,(25) las transfusiones de PC, pudiera brindar una opción de tratamiento. Los primeros reportes durante la actual pandemia en China, mostraron resultados alentadores en tres series con número limitado de casos.(22,26,27) Posteriormente se ha extendido el uso de esta terapia, a varios países afectados. En el sitio www.ClinicalTrials.gov, existen más de 100 de ensayos clínicos registrados, que intentan demostrar los efectos beneficiosos del uso de PC en pacientes aquejados por la COVID-19. En los estudios publicados no hay coincidencia total en los volúmenes de plasma administrado, la titulación de Ac requerida, momento de inicio del tratamiento y en las variables seleccionadas para evaluar la respuesta. En la tabla 2 se resumen algunas características de estos reportes.
En varios estudios efectuados, se carece de grupo control y las transfusiones de PC se administraron asociada a otros tratamientos, lo que dificulta la evaluación del impacto de la terapia. No obstante, la mayoría reporta evolución favorable de los enfermos y el balance de los riesgos y beneficios, favorece la recomendación de esta forma de inmunización pasiva.
Resultados de eficacia
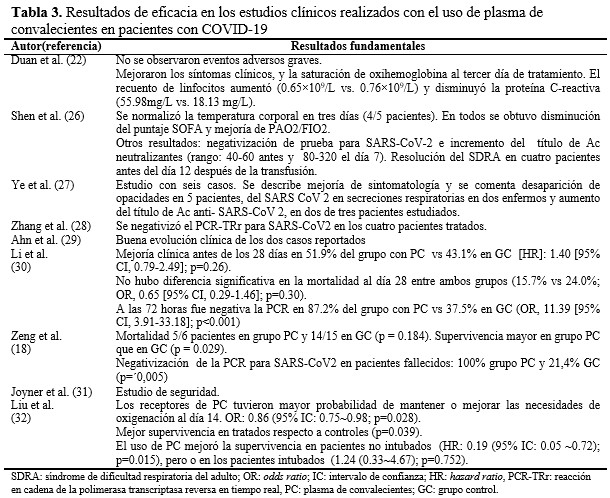
En la evaluación de la eficacia, se han utilizado variables clínicas (síntomas respiratorios, fiebre), parámetros gasométricos, disminución del puntaje en la escala SOFA (Sequential Organ Failure Assessment), estado al egreso del paciente (vivo o fallecido), evolución de parámetros de laboratorio (recuento de linfocitos, proteína C reactiva), negativización de la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés), evolución de las imágenes y tiempo de supervivencia (Tabla 3).
Resultados de seguridad en el uso de PC en pacientes con COVID-19
Los investigadores concuerdan en la seguridad del empleo de esta modalidad terapéutica. Duan et al, describieron enrojecimiento facial en un enfermo y no reportaron eventos adversos (EA) con peligros para la vida de los pacientes. En el estudio con mayor número de casos publicado hasta el momento, se determinó que la incidencia de EA en las primeras cuatro horas, fue menor de 1 %. De los 36 eventos serios reportados, 25 tuvieron algún tipo de relación con la administración del PC. Estos fueron: muerte (n=4), sobrecarga de volumen asociada a la trasfusión(n=7), daño pulmonar relacionado con la trasfusión (TRALI) (n=11), reacciones alérgicas graves (n=3). Al analizar la causalidad, solamente dos eventos, tuvieron una asociación definitiva con el PC.(31) Se describe que cerca de10 % de los pacientes críticos que reciben transfusiones de plasma pueden tener EA. El más común es la sobrecarga de volumen, con una incidencia de 12 %.(33) La de TRALI puede variar entre 0,01 % y 8 %, según el diseño de los estudios que informan estos resultados.(34)
CONSIDERACIONES FINALES
La mayoría de los estudios publicados tienen limitaciones que dificultan evaluar con certeza la utilidad del PC en pacientes infectados con COVID-19. Entre estas tenemos:
-Investigaciones con pocos casos.
-Estudios sin grupo control y sin aleatorización.
-Irregularidades en cuanto al inicio y frecuencia del tratamiento.
-No estandarización del título de anticuerpos necesario para realizar la donación.
-Coexistencia del tratamiento con el uso de esteroides y antivirales.
Como elementos a favor de esta modalidad terapéutica, destacan su probable eficacia clínica, amplia disponibilidad del recurso, forma de obtención sencilla y el menor costo que los fármacos antivirales en estudio. Como conflictos de su empleo están: las barreras administrativas y logísticas en la identificación, reclutamiento y chequeo de donantes; así como la carencia de un prueba disponible y ampliamente validada, para detección de Ac anti SARS-CoV-2, que permita seleccionar los donantes con una respuesta humoral “vigorosa”.(35)
Al realizar un balance de estos aspectos, la Food and Drug Administration (FDA), dictó sus recomendaciones para la colecta de PC y aprobó el uso de PC en pacientes con formas graves de COVID-19. Existe además un protocolo de uso clínico expandido.(36,37) El PC representa un tratamiento prometedor tanto en el tratamiento como en la profilaxis del SARS‐CoV‐2 y otros virus. Las evaluaciones de los resultados deben adaptarse a las características de la población en estudio.(38)
En Cuba se implementó la colecta PC de COVID-19 en todas las provincias. Se han tratado pacientes en estado de cuidado, graves no ventilados y asintomáticos con PCR positivo de forma persistente. Se alcanzó mejoría en el estado clínico y negativización del PCR. No se reportan complicaciones con esta terapia (datos no publicados).
Conflicto de intereses:
No hay conflictos.
Contribuciones de los autores:
Leobaldo Prieto Jiménez: concepción teórica, búsqueda de información, organización del tema, redacción. Dariel Díaz Díaz: búsqueda de información, organización del tema, redacción. Annalia González Betancourt: búsqueda de información, redacción. Julio D. Fernández Águila: concepción teórica, búsqueda de información, organización del tema, redacción, revisión crítica.
Financiación:
Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos.