INTRODUCCIÓN
En la actualidad, entre las primeras causas de muerte están las enfermedades crónicas degenerativas como diabetes mellitus, enfermedades cardiovasculares, hipertensión arterial, obesidad e insuficiencia renal. Este grupo de enfermedades están relacionadas con un conjunto de factores de riesgo comunes y a la mayoría de ellos se les considera modificables y prevenibles.(1)
La diabetes es una enfermedad que, al no ser controlada o detectada a tiempo, menoscaba la vida de las personas que la padecen.(2) La prevención de la enfermedad renal diabética es substancial porque su profilaxis y adecuado tratamiento disminuye la mortalidad temprana, así como la aparición y progresión de las complicaciones tardías de la diabetes.(3,4) Es necesario que una prueba nos permita conocer de forma temprana el pronóstico y la posibilidad de progresión y/o complicaciones.
Como lo indica la Asociación Americana de Diabetes, cuando se establece la enfermedad renal diabética en las primeras etapas, existen pruebas diagnósticas que se deben realizar para con ello, de forma oportuna, estadificar, optimizar tratamiento y disminuir su evolución a enfermedad renal crónica en etapa terminal.(1,5) Una de las pruebas de referencia más utilizadas es la recolección de orina cronometrada o de 24 horas, es un método que está sujeto a errores, son más onerosas y agregan poco a la predicción o la precisión.(2)
Por esta razón se han desarrollado otros estudios más específicos como lo es el cociente albumina/creatinina en orina parcial que es utilizado como prueba diagnóstica.(6) Esta no se ve alterada por la variación biológica que es el principal error preanalítico en la recolección de la muestra.(7,8) Con estas acciones se aspira predecir el riesgo y con esto evitar la progresión a enfermedad renal diabética en etapa terminal y las complicaciones que esto implica.
Los resultados de la décima edición de la Federación Internacional de Diabetes (FID) (2021) confirman que la diabetes mellitus (DM) es una de las emergencias sanitarias mundiales de más rápido crecimiento del siglo XXI y se estima que 537 millones de personas presentaban DM, este número se proyecta que llegue a 643 millones para 2030, y 783 millones para 2045.(9)
Este aumento general en el número de personas con DM ha tenido un gran impacto en el desarrollo de la enfermedad renal diabética o nefropatía diabética (DKD, por sus siglas en inglés) que ocurre en el 20-40 % de estos pacientes. En tal sentido, esta enfermedad es una de las complicaciones más frecuentes en los diabéticos tipo 1 (DT1) y tipo 2 (DT2).(1)
La DKD es una de las complicaciones microvasculares más comunes de la diabetes y una de las principales causas de morbilidad y mortalidad, puede progresar a enfermedad renal en etapa terminal (ESRD, por sus siglas en inglés) que requiere diálisis o trasplante de riñón y es la principal causa de ESRD en los EEUU. La prevalencia atribuible solo a la DM oscila entre el 12 % y el 55 %, estimaciones descritas por Aden y colaboradores.(6) Además, entre las personas con DT1 y DT2, la presencia de DKD aumenta notablemente el riesgo cardiovascular y los costos de atención médica.(1,3,5)
En tal sentido, las referencias sobre la DKD en Latinoamérica son escasas y se ha observado que la mayor incidencia de ESRD por diabetes se registró en Puerto Rico (66, 8 %), México (61,8 %) y Colombia (42,5 %), y el más bajo fue en Cuba (26,2 %) y Uruguay (23,2 %), según datos publicados por González y colaboradores.(10,11)
De igual manera, la información disponible sobre prevalencia de la DKD en Venezuela es limitada. Sin embargo, es importante mencionar los datos nacionales más recientes con relación a la DM observados en el Estudio Venezolano de Salud Cardiometabólica (EVESCAM) llevado a cabo por González y colaboradores.(3) Este estudio evaluó a 3414 sujetos de las 8 regiones del país y establecieron la prevalencia de DM en un 12, 3 % de la población total, con un predominio en el género masculino (14, 5 %) y en el femenino de (10,3 %), siendo más frecuente en la región Occidental (14,3 %), Zulia (13,2), la capital (13,5 %) y en los Llanos (7,7 %).
Es conveniente acotar, aunque no representa la verdadera dimensión de la situación en el país, la investigación realizada en la ciudad de Maracay-Venezuela por Lemoine y colaboradores en una muestra representativa de 45 pacientes.(2) De este número, 27 (60 %) presentaban DT2, con DKD, caracterizada por albuminuria moderada (33, 3 %) y severa (18,5 %), así como disminución de la tasa de filtración glomerular (TFG) estadificada como grado 2 (11,1 %) y grado 3a (22,2 %), y con una evolución de la enfermedad entre cinco (5) a diez (10) años.
Por consiguiente, es necesario precisar que la DKD es una entidad clínica en la que la albuminuria persistente y la disminución de la función renal medida por la TFG son los principales hallazgos característicos, que están estrechamente relacionados con la progresión a ESRD, se ha determinado que la presencia y la gravedad de la ERC se han asociado consistente y fuertemente con un mayor riesgo de enfermedad cardiovascular (ECV) y muerte, según lo señalado por Vallianou y colaboradores.(12)
El diagnóstico en estadios incipientes puede permitir intervenciones oportunas y de mejor pronóstico, esto trae como resultado, la necesidad de buscar marcadores tempranos que sean capaces de identificar sujetos de alto riesgo de sufrir complicaciones renales y/o cardiovasculares, de esta manera se requiere la evaluación del cociente albúmina-creatinina en orina parcial y la TFG como pruebas que son ampliamente aceptadas para el diagnóstico y la clasificación clínica de la DKD.(4)
Generalmente, debido a las barreras actuales que dificultan el acceso de los pacientes a estas pruebas diagnósticas, no es frecuente la realización de estas en etapas iníciales de la DT2. Esto se debe a que típicamente la DKD se desarrolla después de una duración de la diabetes de al menos 10 años en lo que respecta a DM1, no obstante, puede estar presente en el momento del diagnóstico de DM2.
De acuerdo con los razonamientos que se han venido realizando, en Venezuela, específicamente en la Unidad de Diabetes del Centro Cardiovascular Regional Centroccidental Ascardio (CCR-Ascardio), Estado Lara, no hay trabajos que determinen el cociente albumina/creatinina en orina parcial como predictor temprano de enfermedad renal en pacientes con menos de 10 años de evolución de diabetes tipo 2.
Debido a lo anterior se realiza la presente investigación que tiene el objetivo de determinar el cociente albumina/creatinina en orina parcial como predictor temprano de enfermedad renal en pacientes con menos de 10 años de evolución de diabetes tipo 2.
MÉTODOS
La investigación es cuantitativa, no experimental, descriptiva y de campo. La población estuvo conformada por todos los pacientes que asistieran a la consulta en la Unidad de Diabetes del Centro Cardiovascular Regional Centroccidental Ascardio, Estado Lara, con diabetes tipo 2 y que tuvieran menos de 10 años de evolución de la enfermedad, durante el periodo noviembre 2022-febrero 2023.
La muestra del estudio fue censal, no probabilístico intencional (n=23), que se ajusta a los criterios de selección descritos a continuación:
Criterios de inclusión:
- Pacientes con criterios diagnósticos de diabetes tipo 2, que acudan a la consulta en la Unidad de Diabetes del Centro Cardiovascular Regional Centroccidental Ascardio, Estado Lara.
- Menos de 10 años de evolución de la diabetes tipo 2.
- Hipertensión arterial controlada.
- Consentimiento para la realización de glucemia en ayuna y posprandial, urea, creatinina, albumina/creatinina en orina parcial, examen de orina.
- Pacientes atendidos dentro del periodo de estudio
Criterios de exclusión:
- Antecedentes de patología cardiovascular aguda y/o crónica descompensada.
- Enfermedades infecciosas agudas y/o crónicas, desnutrición, entre otras causas que condicionen albuminuria.
Para el análisis del cociente de albúmina/creatinina en orina parcial se utilizó la estadificación propuesta por la Kidney Disease: Improving Global Outcomes (KDIGO, 2022)(7) en la cual se toman valores <30 mg/g entre 30-300mg/g y >300 mg/gr.
El instrumento empleado para recabar la información fue una ficha de recolección de datos, a partir de la historia clínica preestablecida en la Unidad de Diabetes. Los datos fueron registrados de la siguiente manera:
- Parte I. Datos demográficos
- Parte II. Características clínicas
- Parte III. Características paraclínicos
Como parte del procedimiento ejecutado, se solicitó por escrito el aval para la realización del estudio al coordinador de la Unidad de Diabetes. La búsqueda de la información se llevó a cabo mediante la observación directa de las historias clínicas en el tiempo pautado para la obtención de los datos. Posteriormente, se realizó el registro y procesamiento de los datos con el paquete estadístico SPSS, en su versión 25, para su tabulación y presentación de resultados mediante tablas.
RESULTADOS
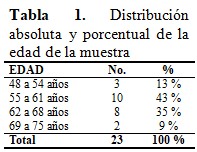
Luego de procesados los datos obtenidos, se puede afirmar que el mayor porcentaje de edad estuvo representado en el intervalo entre 55 a 61 años (43 %), mientras que el 35 % estuvo entre 62 a 68 años, el 13 % entre 48 a 54 y por último el 9 % corresponde a 69 a 75 años. (Tabla 1).
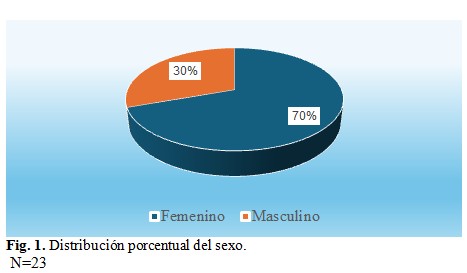
En cuanto al sexo de la muestra, el mayor porcentaje corresponde al sexo femenino en el 70 % de los casos y el sexo masculino represento el 30 %, con 16 y 7 sujetos respectivamente. (Fig. 1).
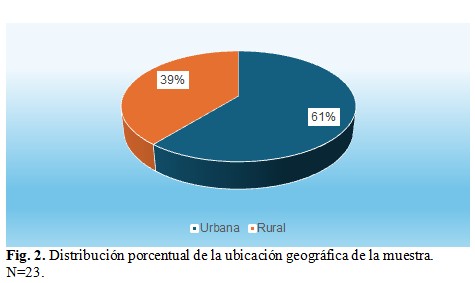
Con referencia a la ubicación geográfica de la muestra, el 61 % corresponde a zonas urbanas mientras que el 39 % a zonas rurales, con 14 y 9 sujetos respectivamente. (Fig. 2).
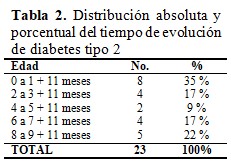
Para facilitar el análisis del tiempo de evolución de diabetes tipo 2 se agruparon las frecuencias en años de evolución: la mayor frecuencia (35 %) la obtuvieron los que tienen de 0 a 1 +11 meses con la enfermedad en tanto que el 22 % acumularon entre 8 a 9 + 11 meses, seguido del 17 % que tenía entre 6 a 7 + 11 al igual que de los de 2 a 3+ 11 meses y 4 a 5 + 11 meses solo el 9 %. (Tabla 2).
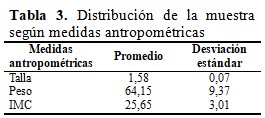
De las medidas antropométricas, la talla mantuvo un promedio de 1,58 cm con una desviación de 0,07. El peso promedio fue de 64,15 kg y una desviación de 9,37 mientras que el promedio de la IMC fue de 25,65 kg/m2 con variación de 3,01. (Tabla 3).
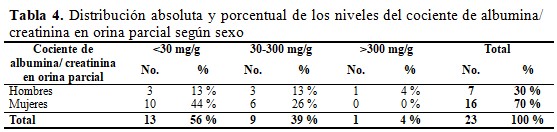
La distribución de los pacientes según sexo y el cociente de albúmina/creatinina en orina parcial mostró que en el nivel <30 mg/g se ubica el mayor porcentaje de las mujeres; entre 30-300 mg/g las mujeres predominan con mayor cifra y los hombres representan una cifra menor y finalmente en el nivel>300 mg/g solo un paciente hombre. (Tabla 4).
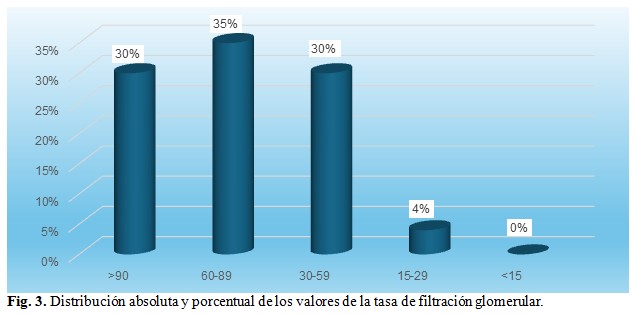
En relación con la tasa de filtración glomerular el mayor porcentaje observado fue a una TFG correspondiente entre 60-89mL/min/1.72m2 seguido de una TFG >90 y de 30 a 59 mL/min/1.72m2, respectivamente, mientras que de 15 a 29 mL/min/1.72m2 solo estuvo representado por una minoría.
El mayor porcentaje de pacientes (35 %) se concentró en una tasa de filtración glomerular (TFG) entre 60-89mL/min/1.72m2 seguido de una TFG >90 y de 30 a 59 mL/min/1.72m2 en el 30 % respectivamente, mientras que de 15 a 29 mL/min/1.72m2 solo estuvo representado por el 4 %. (Fig. 3).
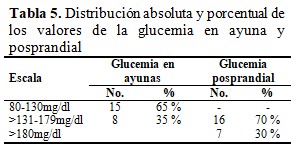
Se midieron los valores de glucemia en ayunas y posprandial y se obtuvo que: en ayunas el 65 % de la muestra estuvieron entre 80-130mg/dl, mientras que el 35 % se encontró entre 131-179 mg/dl. En relación con la glucemia posprandial el 70 % se ubicó entre 131-179 mg/dl y el 30 % en niveles >180mg/dl. (Tabla 5).
DISCUSIÓN
La hiperglucemia intracelular crónica y la predisposición genética en los pacientes con diabetes mellitus es un sustrato patogénico continuo que afecta tanto a la macro como a la microcirculación y esto conduce a una disfunción orgánica permanente, siendo evidente que un mal control glucémico constituye un predictor independiente al desarrollo de las complicaciones, principalmente renales y relevantes al estudio, entre otras, que impactan la calidad y esperanza de vida de estos pacientes. Los resultados obtenidos se demuestran en los párrafos siguientes:
En relación con la edad y el sexo estos resultados son similares a los obtenidos por Yu y colaboradores, para quienes la edad media fue de 62,6 ± 14,0, con predominio del sexo femenino y que estas tenían una mayor prevalencia de enfermedad renal diabética avanzada.(13)
Con referencia a la ubicación geográfica los resultados obtenidos coinciden con Karar y colaboradores que mencionaron que mayoritariamente su muestra fue urbana.(5)
Se considera que la presentación típica de la nefropatía diabética incluye una diabetes de larga duración, retinopatía, albuminuria sin hematuria macroscópica y pérdida gradualmente progresiva de la TFG. Sin embargo, los signos de enfermedad renal diabética pueden estar presentes en el momento del diagnóstico o sin retinopatía en la diabetes tipo 2, según descripciones propuestas por la American Diabetes Association.(1)
Adicionalmente, Lemoine y colaboradores evidenciaron mediante la estadificación de la enfermedad renal crónica (ERC) tomando en cuenta la tasa de filtración glomerual (TFG) y la relación albumina/creatinina (ACR) en orina parcial en pacientes con diabetes tipo 2, con más de cinco años de evolución de la diabetes, donde existía albuminuria severa, lo que significa un peor pronóstico y una mayor afectación renal.(2)
De las medidas antropométricas, la talla mantuvo un promedio de 1,58 cm con una desviación de 0,07. El peso promedio fue de 64,15 kg y una desviación de 9,37 mientras que el promedio de la IMC fue de 25,65 kg/m2 con variación de 3,01; en este estudio, al observar las variables de forma individual, en los que exhibían mayor IMC se demostraba aumento de la ACR y en algunos casos presencia de microalbuminuria. Sobre estos hallazgos, de acuerdo con Lu y colaboradores, en los análisis de aleatorización mendeliana, cada aumento de 1 kg/m 2 en el IMC se asoció con un mayor riesgo de nefropatía diabética (OR = 3,76; IC del 95 %, 1,88-7,53; P < 0,001) y niveles más bajos de TFG (OR = 0,71, IC 95%, 0,59-0,86, p < 0,001).(8)
Visto desde la perspectiva anterior es importante destacar el estudio de Yamanouchi y colaboradores, donde identificaron retrospectivamente 526 biopsias renales de pacientes con diabetes tipo 2, de estos, 88 (16,7 %) tenían enfermedad renal diabética (DKD) no proteinúrica (ACR <300 mg/g) y 438 (83,3 %) DKD proteinúrica (ACR ≥300 mg/g). (14) En el grupo sin proteinuria manifiesta, 19 (3,6 %) tenían normoalbuminuria (<30 mg/g) y 69 (13,1 %) tenían albuminuria moderadamente aumentada (microalbuminuria). No obstante, como se observa en muchas formas de ERC, parece que el grado de proteinuria sigue siendo un fuerte predictor del riesgo de progresión, y que la DKD no proteinúrica tiene un mejor pronóstico.(14)
De la misma manera, Kramer y colaboradores,(15) observaron que el 13% (n = 171 de la muestra) de adultos con DM tipo 2 (n = 1197) tenían ERC. Entre estos adultos con ERC, se observó que la frecuencia de microalbuminuria y macroalbuminuria fueron del 45 % (n = 64) y del 19 % (n = 47), respectivamente. La albuminuria (microalbuminuria o macroalbuminuria) estuvieron ausentes en el 30 % (n = 51) de los adultos con DM tipo 2 y ERC. En relación con los datos de este estudio hubo predominio de normoalbuminuria, no obstante, en algunos casos a expensas de la disminución de la TFG y se encontró una mayor frecuencia de microalbuminuria en contraste con los que presentaron macroalbuminuria, esto podría deberse a diversas comorbilidades y a la exposición continua de múltiples factores de riesgo que aumentan significativamente el riesgo de desarrollar nefropatía diabética.
En este mismo orden y dirección, en concordancia con la tasa de filtración glomerular de esta investigación, el mayor porcentaje observado fue del 35 % a una TFG correspondiente entre 60-89 mL/min/1.72m2 seguido de una TFG >90 y de 30 a 59 mL/min/1.72m2 en el 30 % de los pacientes, respectivamente, mientras que de 15 a 29 mL/min/1.72m2 solo estuvo representado por el 4 %. Citando a Yamanouchi y colaboradores la evidencia acumulada de varios estudios transversales reveló que una proporción de pacientes con diabetes tipo 2 desarrollan una progresión del deterioro renal sin proteinuria (macroalbuminuria) o incluso sin microalbuminuria, lo que sugiere la existencia de un fenotipo no proteinúrico de enfermedad renal diabética definida como eGFR <60 mL/min/1,73 m 2 y UACR <300 mg/g.(14)
Es relevante destacar, los estudios prospectivos, aleatorizados de la Asociación Americana de Diabetes ya descritos previamente, en donde sus directrices han demostrado que el control intensivo de la glucemia con el objetivo de alcanzar niveles casi normoglucémicos retrasa la aparición y progresión de la albuminuria y reducción de la TFG en pacientes con diabetes tipo 1 y diabetes tipo 2, siendo esto reproducido en este estudio donde se demostró que los pacientes que se encontraban en metas glucémicas tenían valores de ACR normales (normoalbuminuria).(1,16)
Boer y colaboradores, de forma similar, para pacientes con diabetes tipo 2 de reciente diagnóstico, tras 10 años de control metabólico intensivo con un nivel diana de HbA1c de un 7 %, mostraron un 24 % de reducción en el desarrollo de complicaciones microvasculares, incluyendo la DKD, mientras que después de 12 años de seguimiento, el control glucémico intensivo resultó en una reducción del 33 % de desarrollo de proteinuria.(17)
Agradecimientos
A la Universidad Nacional de Chimborazo (UNACH), a través de un proyecto aprobado por la vicerrectoría de investigación mediante resolución No.194 - CIV-30-11-2022, para el cual se trabaja el abordaje integral del paciente con diabetes mellitus.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Contribuciones de los autores
Conceptualización: Indira del Carmen Acosta Linares, Lisbeth Josefina Reales Chacón.
Curación de datos: Indira del Carmen Acosta Linares, Lisbeth Josefina Reales Chacón.
Análisis formal: Carlos David Rojas Delgado.
Investigación: Lisbeth Josefina Reales Chacón, Indira del Carmen Acosta Linares, Malena Paulina Camacho Aldaz.
Metodología: Carla Eliana Montero Guadalupe, Malena Paulina Camacho Aldaz.
Administración del proyecto: Indira Del Carmen Acosta Linares, Lisbeth Josefina Reales Chacón.
Supervisión: Lisbeth Josefina Reales Chacón, Malena Paulina Camacho Aldaz.
Validación: Carla Eliana Montero Guadalupe, Lisbeth Josefina Reales Chacón, Malena Paulina Camacho Aldaz.
Redacción-borrador original: Indira del Carmen Acosta Linares, Malena Paulina Camacho Aldaz, Carla Eliana Montero Guadalupe.
Redacción-revisión y edición: Indira del Carmen Acosta Linares, Lisbeth Josefina Reales Chacón, Malena Paulina Camacho Aldaz.
Financiación
Sin financiamiento externo.
REFERENCIAS BIBLIOGRÁFICAS
1.American Diabetes Association. Chronic kidney disease and risk management: standards of medical care in diabetes. Diabetes Care. 2025;48(Supplement_1):S239–S251
2.Lemoine C, Frattaroli F, Prato O, Navarrete L, Velásquez R. Evaluation of the renal function in patients with pre-diabetes and diabetes mellitus type 2. Central Hospital of Maracay, Venezuela. Comunidad y Salud. 2018;16(2):36-45.
3.González-Rivas JP, Mechanick JI, Ponte C, de Oliveira-Gomes D, Iglesias-Fortes R, Machado L, et al. Impact of the complex humanitarian crisis on the epidemiology of the cardiometabolic risk factors in Venezuela. Clin Investig Arterioscler Engl Ed. 2022;34(2):97-104.
4.Takashi W, Miho S, Tadashi T, Akinori H, Shuichi K, Kengo F. Clinical impact of albuminuria in diabetic nephropathy. Clin Exp Nephrol. 2012;16:96-101.
5.Karar T, Ahmed R, Alniwaider R, Abdel M, Tamimi W, Alanazi A, Qureshi S. Assessment of microalbuminuria and albumin creatinine ratio in patients with type 2 diabetes mellitus. J Nat Sci Biol Med. 2015;6(Suppl 1):S89–S92.
6.Aden S, Shalmeno B, Birhanu A, Tadesse Z, Awoke T. Incidence of diabetic nephropathy and its predictors among type 2 diabetes mellitus patients at University of Gondar Comprehensive Specialized Hospital, Northwest Ethiopia. J Nutr Metab. 2021:6757916
7.International Society of Nephrology. KDIGO. Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney International. 2022;102(Suppl 5S):S1–S127
8.Lu J, Liu X, Jiang S, Kan S, An Y, Zheng C, et al. Body Mass Index and Risk of Diabetic Nephropathy: A Mendelian Randomization Study. J Clin Endocrinol Metab. 2022;107(6):1599-1608.
9.Federación Internacional de Diabetes. The global picture: Diabetes prevalencia. IDF Diabetes Atlas. 10ma ed. Bruselas: FID; 2021.
10.González M, Rosa G, Pecoits R, Ferreiro A, García G, et al. Burden of disease: prevalence and incidence of ESRD in Latin America. Clin Nephrol. 2015;83(7 Suppl 1):3-6.
11.Pérez A, Pérez J, Zayas J. Polifarmacia e interacciones medicamentosas potenciales en el adulto mayor, una polémica en la prescripción. Rev Cub Farm[Internet]. 2019[citado 23/09/2024];52(2):[aprox. 9 p.]. Disponible en:. https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=93935
12.Vallianou N, Mitesh S, Gkogkou A, Geladari E. Enfermedad renal crónica y enfermedad cardiovascular: ¿existe alguna relación? Current Cardiology Reports. 2019;15(1):55-63.
13.Yu M, Lyles C, Bent L, Young B. Risk factor, age and sex differences in chronic kidney disease prevalence in a diabetic cohort: The Pathways Study. Am J Nephrol. 2012;36(3):245-51.
14.Yamanouchi M, Furuichi K, Hoshino J, Toyama T, Hara A, Shimizo M, et al. Fenotipos no proteinúricos versus proteinúricos en la enfermedad renal diabética: un análisis emparejado por puntaje de propensión de un estudio de cohorte basado en biopsias a nivel nacional. Diabetes Care. 2019;42(5):891-902.
15.Kramer HJ, Nguyen QD, Curhan G, Hsu C. Insuficiencia renal en ausencia de albuminuria y retinopatía entre adultos con diabetes mellitus tipo 2. JAMA. 2003;289(24):3273-77.
16.Ramírez A, Pérez J, Borrell J. Interacciones medicamentosas como un problema de salud imperceptible en la población. Rev Cubana Med Gen Integr. 2020;36(1):1-15.
17.de Boer IH, Sun W, Cleary PA, Lachin JM, Molitch ME, Steffes MW, Zinman B. Intensive diabetes therapy and glomerular filtration rate in type 1 diabetes. N Engl J Med. 2017;365(25):2366-76.