Introducción
El síndrome de hiperestimulación ovárica (SHO) es una complicación casi exclusivamente iatrogénica derivada de la hiperestimulación farmacológica del ovario y desencadenada tras la administración de la hormona gonadotrofina coriónica (hCG), para los tratamientos de reproducción asistida (TRA). La hiperestimulación ovárica controlada (HOC) tiene como objetivo reclutar múltiples folículos para incrementar el número de ovocitos disponibles y con ello las posibilidades de embarazo en un ciclo de estimulación.(1,2,3)
No obstante, existen casos descritos de SHO en ciclos estimulados con clomifeno o bien sin estimulación, como por ejemplo en casos de síndrome de ovarios poliquísticos (SOP), gestaciones multifetales, gestaciones molares, hipotiroidismo, adenomas hipofisarios, etc.(1,2)
Desde hace años, el síndrome de hiperestimulación ovárica ha cuestionado el actuar de los médicos por su compleja fisiopatogenia y sus devastadoras consecuencias en pacientes en edad reproductiva. Como auténtica enfermedad, la clínica guarda una estrecha relación con el grado de severidad, reflejado en los signos y síntomas de la paciente y en los cambios enzimáticos, celulares y electrolíticos.(2)
A menudo, es mejor prevenir que curar. Sin embargo, usar solo el índice de masa corporal (IMC) y la edad para predecir el SHO antes de la HOC sigue siendo una tarea ardua en un ciclo individual de FIV. La monitorización del nivel sérico de estradiol (E2) y el recuento de folículos antrales (AFC) son métodos convencionales para la prevención del SHO. Los marcadores hormonales séricos, como la hormona anti-Mülleriana (AMH), se están aplicando cada vez más para predecir la respuesta ovárica a la estimulación. Sin embargo, estos índices de diagnóstico no pueden predecir con precisión el SHO antes de iniciar la HOC, por lo que se necesita una mejor alternativa para el diagnóstico temprano.(4)
La incidencia del síndrome de hiperestimulación ovárica está subestimada por el amplio universo de clasificaciones clínicas y diferentes operadores independientes en su evaluación; también por aspectos propios de la paciente; así, es más frecuente en jóvenes, delgadas y con síndrome de ovario poliquístico (SOP); influyen, también, los diferentes tratamientos realizados. Se reporta en 3 a 6 % y de 0,1 a 2 % en los casos moderados y severos, respectivamente.
Otros autores señalan una incidencia entre un 3-8 % de los ciclos de fecundación in vitro, llegando al 20 % en los casos de mujeres con riesgo elevado.(2)
En los últimos 25 años se han descrito diferentes clasificaciones para su prevención y tratamiento. La primera clasificación la propuso Rabau en 1967: dividió en seis grados la severidad del síndrome, posteriormente la modificaron Schenker y Weinstein, en 1978, y lo clasificaron en: leve, moderado y severo y subdividieron la severidad en seis grados. Golan, en 1989, adaptó una clasificación similar que resumió en cinco grados y Navot, en 1992, contribuyó a esta categoría agregando el estado de “crítico”. Por último, Rizk y su grupo, en 1999, trataron de resumir la clasificación de Golan al clasificar los grados de severidad en tres categorías: temprano, tardío y sin etiología.(2)
Desde hace años, esta afección ha cuestionado el actuar de los médicos por su compleja fisiopatogenia y sus devastadoras consecuencias en pacientes en edad reproductiva. Por tales razones se presenta el caso de una paciente sometida a tratamiento médico y quirúrgico, con fertilización in vitro, y transferencia embrionaria, que desarrolló un síndrome de hiperestimulación ovárica grave con embarazo.
Se presenta el caso más complejo del servicio, en los inicios de la implementación de los tratamientos de fertilización in vitro, en la provincia de Cienfuegos, con el propósito de compartir la experiencia vivida y que ayude a la comunidad médica de gineco-obstetras a conocer la importancia del manejo individual y especializado de la inducción de la ovulación en las técnicas de alta complejidad, que debe ser realizada por los especialistas más expertos, y que ante la eventualidad de aparición del síndrome, se debe tener un accionar rápido, no ocultar o negar la presencia del mismo, y tratar en tiempo y adecuadamente para evitar las complicaciones mortales.
Presentación del caso
Se trata de una paciente femenina, de color de piel blanca, de área rural, de 33 años de edad, antecedentes patológicos personales (APP) de asma bronquial grado I y sepsis urinarias a repetición, con antecedentes de infertilidad, G1P0A1 por embarazo ectópico operado y salpingectomía derecha, que se diagnosticó con un factor tuboperitoneal, y por tanto se definió tenía criterio de una fertilización in vitro, con transferencia de embriones, para lograr su embarazo. Además, con síndrome de ovarios poliquísticos y operada varias veces por cirugía mínimamente invasiva, de quistes foliculares persistentes, de gran tamaño.
Se comenzó la inducción de la ovulación el 26 de mayo del 2016, con Folitrofina alfa recombinante, Gonal F de Merck Serono, 225 UI, y 75 UI de merapur, se le añadió acetato de cetrorelix (0,25) en 7mo día, con folículos de más de 14 mm. Se realizó disparo día 12 del ciclo, con gonadotropina coriónica recombinante ovidrell ( Merck Serono). Se realizó aspiración folicular en día 14 del ciclo, se obtuvieron 12 ovocitos, semen del esposo de buena calidad y se transfirieron tres embriones, en día tres.
Pasados los 10 días de la transferencia (5/6/2016) comenzó con distención abdominal, náuseas, vómitos, fatigas, debilidad, y acudió al cuerpo de guardia del Hospital Gustavo Aldereguía Lima de Cienfuegos.
Al examen físico se observó:
Mucosas húmedas pero hipocoloreadas, no edemas.
Tensión arterial (TA) 140/90 mm Hg, frecuencia respiratoria (FR) 19 x minuto.
Aparato respiratorio: murmullo vesicular conservado, no estertores.
Aparato cardiovascular: ruidos cardíacos rítmicos, de buen tono, no soplos.
Frecuencia cardíaca (FC) 90 x minuto.
Abdomen con distensión ligera, pero suave, depresible, con ruidos hidroaéreos presentes, con maniobra de Tarral positiva discretamente.
Consciente, orientada, con buen estado general a pesar de las molestias.
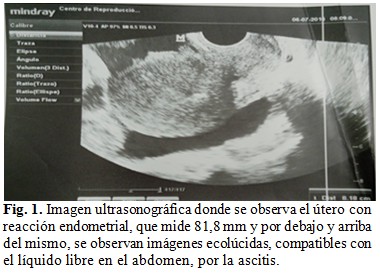
Se le realizó ultrasonido transvaginal ginecológico, y se diagnosticó un síndrome de hiperestimulación ovárica postransferencia, tardío de moderada intensidad, con líquido ascítico libre en cavidad abdominal, ambos ovarios con varios cuerpos lúteos, propios del proceso de estimulación, pero agrandados, ovario derecho medía 67nx 58 mm y el izquierdo 82nx 72 mm, útero con marcada reacción endometrial, de tamaño normal. (Fig. 1).
Dado que en la provincia de Cienfuegos se tiene como protocolo establecido tratar a estas pacientes en la Unidad de Cuidados Intensivos, “política de puertas abiertas” y por la magnitud de la enfermedad, se traslada hacia esta unidad, tomando todas las medidas necesarias para su tratamiento.
Se mantuvo con hidratación controlada, monitorización continua, toma de signos vitales cada cuatro horas, peso diario, balance hidromineral, vigilancia de la orina, reposo, administración de albúmina humana al 20 %. Se le administró, también, heparina de bajo peso molecular (Fraxiheparina) 0.3 UD s/c por día para la prevención de la enfermedad tromboembólica, algunas dosis de furosemida de 20 mg.
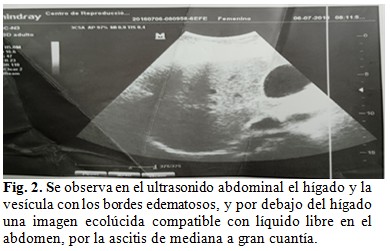
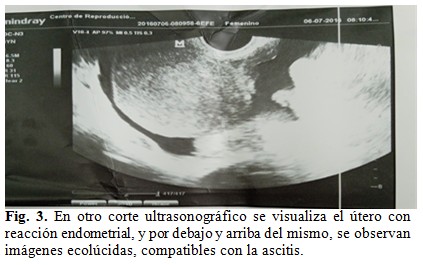
Se le realizaron complementarios diarios, hemograma, con leucograma, ionograma, gasometría, coagulograma, creatinina, TGP, TGO, GGT, LDH, fosfatasa alcalina, proteínas totales y fraccionadas, rayos X de tórax, bilirrubinas, ácido úrico, creatinina, glicemia, ultrasonidos seriados. (Fig. 2 y Fig. 3).
Además de la valoración médica y de enfermería cada cuatro horas, se mantuvo con la valoración del especialista en medicina reproductiva para dar seguimiento al cuadro clínico.
En el día segundo del ingreso, con 11 días pos transferencia embrionaria, se le realizó una determinación de la fracción Beta de la gonadotropina coriónica sanguínea (hCG-B) dando como resultado 113,2 m UI/ ml, que confirmó embarazo bioquímico, y que esclarece o justifica la aparición tardía del síndrome.
A medida que avanzó el embarazo y ascendieron los niveles en sangre de gonadotropina, pues se fue agravando el síndrome, apareció polipnea, hemoconcentración; 0,45 el hematocrito, disminución del ritmo diurético, apareció ligero derrame pleural e incremento de 2 kg de peso y la distención abdominal creció, por gran presencia de líquido ascítico interasas, por lo que requirió de realizar, bajo anestesia general, una evacuación de 1700 ml, paracentesis transvaginal ecoguiada, que alivió los síntomas de compresión. Se realizó en dos ocasiones la evacuación, y el resto del tiempo se manejó con el balance hidromineral estricto.
La hCG- Beta siguió incrementando, 324,4 m UI/ ml, se logró observar el saco gestacional intraútero.
A los 16 días de ingreso, se agravó el cuadro clínico porque aparecieron orinas colúricas, oscuras, turbias o sedimentosas, bajo ritmo diurético, una fascie característica con nariz agilada, aspecto enfermo, la piel brillante, una leucocitosis, 12,2 x 109/l, una disminución del ritmo diurético, y se le realizó un urocultivo, por sus antecedentes y se constata una infección del tracto urinario, por Klebsiella neumoniae. Apareció anemia, de 10 g/l, pérdida de la masa muscular, también se alteró la TGP 246 UI/ ml, TGO 164 UI/ ml, fosfatasa alcalina en 721 uds, FC 110 x min, y una congestión en las bases pulmonares, de aspecto inflamatorio. (Fig. 4).
Dado que el síndrome no se logró controlar y empeoró con el embarazo y la sepsis, con cambios, además de disfunción hepatorrenal, se decidió, con seis semanas de gestación, hacer la interrupción del mismo, ya que se ponía en peligro la vida de la paciente, y se incorporó terapia antibiótica para la sepsis con ceftriaxona (1g) endovenoso (EV) cada 12 horas, por 7 días. Luego de 25 días de hospitalización, ya recuperada se egresó de la institución y se le dio seguimiento por consulta de reproducción asistida.
Se le mantuvo un año sin realizar ningún proceder, para su total recuperación, y luego de este tiempo, pues se volvió a realizar una fertilización in vitro, a partir del 31 de octubre del 2017, lográndose un embarazo clínico, con evolución favorable, y con un recién nacido, vivo, masculino, sano, con peso de 4000 gramos, y apgar de 8/9.
Discusión
Para el diagnóstico y tratamiento adecuado de un trastorno es necesario contar con una clasificación adecuada. La clasificación del síndrome de hiperestimulación es la siguiente:
Grado I – Leve. Se caracteriza por aumento bilateral de los ovarios hasta 5x5 cm con múltiples folículos y cuerpos lúteos. El estradiol es mayor a 1500 pg/mL (6000 pmol/L)
Grado II — Moderada. Los ovarios son de mayor tamaño, hasta 12 cm, y la paciente presenta dolor o disconfort abdominal y síntomas gastrointestinales (náuseas, vómitos y diarrea). Un aumento repentino de peso de más de 3 Kg puede ser un signo temprano de SHEO moderada.
Grado III — Severa. Ovarios mayores de 12 cm, ascitis y disfunción renal. Se considera crítica cuando se objetiva derrame pleural y/o pericárdico, alteración electrolítica (hiponatremia, hiperkaliemia), hipovolemia y shock hipovolémico.
Hemoconcentración marcada, aumento de viscosidad sanguínea, fenómenos tromboembólicos, incluida coagulación intravascular diseminada en los casos más severos.(5,6,7,8)
El síndrome de hiperestimulación ovárica puede ser temprano o tardío. Esta denominación se basa en la presentación de signos y síntomas. Se considera temprano si los signos y síntomas aparecen entre 3 y 7 días posteriores a la administración de la hormona gonadotropina coriónica humana (hGC). Será tardío cuando sobrepasen los 10 días; por lo general, la fuente de producción es de origen endógeno. Existe mayor predisposición al clasificar en grado de severidad cuando éste es de inicio tardío y es responsable de 70 % de los casos de síndrome de hiperestimulación ovárica severo. Ambas denominaciones o entidades comparten una fisiopatogenia en común al estimular las células de la granulosa por acción directa de hCG lo que desencadena la producción no controlada de sustancias vasoactivas que inducirán una permeabilidad vascular excesiva y pérdidas insensibles.(2,8)
La incidencia del SHO se ha incrementado en las últimas décadas con el mayor uso de gonadotropinas en la hiperestimulación ovárica controlada (HOC) para fecundación in vitro (FIV). Es especialmente frecuente cuando las pacientes son sometidas a tratamiento con gonadotropinas. Esta variación también depende de la disparidad de los protocolos de estimulación utilizados en los distintos trabajos de la selección de pacientes y de la capacidad de predicción del riesgo de SHO. En un estudio realizado en 29 700 pacientes se encontró que el SHO severo sólo ocurrió en 0,7 % de las pacientes.(1,2)
Es de advertir que los efectos adversos como el embarazo múltiple y el SHO no son informados en la mayoría de estudios sobre fertilización asistida por lo que sus incidencias pueden ser mayores.
La frecuencia del SHO aumenta en los ciclos en que se logra el embarazo. Se han identificado diferentes sustancias responsables de la fisiopatología y severidad de la enfermedad: prorrenina, renina, prostaglandinas, angiotensina II, factor de crecimiento endotelial vascular (FCEV), factor de necrosis tumoral alfa, factor de crecimiento similar a la insulina tipo 1, factor de crecimiento epidérmico.(2)
El factor de crecimiento endotelial vascular producido por las células de la granulosa y considerado una de las sustancias vasoactivas más relevantes en la fisiopatogenia del síndrome de hiperestimulación ovárica tiene una afinidad 50,000 veces más potente que la histamina en cuanto a permeabilidad vascular, el FCEV-1 (Flt-1) y FCEV-2 (Flk1/KDR)) expresa su actividad biológica al unirse a los receptores en la capa endotelial. El receptor FCEV-2 ejerce sus propiedades en la regulación de la permeabilidad vascular, angiogénesis y vasculogénesis, y el receptores 1 y 2 en conjunto con el FCEV 2 al inhibir la permeabilidad vascular. En el síndrome de hiperestimulación ovárica hay una sobreexpresión del FCEV y del FCEV-2 en respuesta a la hCG. Esto provoca un descontrol en la producción de factores, induce una excesiva permeabilidad vascular, pérdidas insensibles que afectan la homeostasis y la función de diferentes sistemas celulares.(2)
Marcadores genéticos
En los receptores FSH-R y LH-R se han identificado algunas variantes polimórficas que adjudican una regulación directa en respuesta a las gonadotropinas utilizadas. En un estudio que intencionadamente buscó mutaciones activas se encontró una prevalencia del alelo N680 en pacientes con síndrome de hiperestimulación ovárica severo comparado con los que lo tuvieron moderado. Por desgracia, este alelo no puede predecir el síndrome de hiperestimulación ovárica, sólo se utiliza como indicador en el grado de severidad.(2)
Factores de riesgo:
Todas las mujeres sometidas a un tratamiento de fertilidad tienen riesgo de sufrir una hiperestimulación ovárica. Sin embargo, hay unas más susceptibles que otras, por lo que el conocimiento de los factores de riesgo es útil para su prevención. Los factores de riesgo más comunes son:
- Edad joven (menos de 30 años): responden más a las gonadotropinas ya que tienen mayor densidad de receptores y más número de folículos susceptibles de responder a éstas.
- Bajo peso corporal: algunos autores encontraron una incidencia mayor de SHO en pacientes con bajo índice de masa corporal, aunque posteriormente otros no han hallado los mismos resultados.(6,7,8,9)
- Síndrome de ovario poliquístico (SOP): el hiperandrogenismo, el hiperinsulinismo y el cociente LH/FSH> 2 son condiciones que predisponen a la respuesta exagerada y a la aparición del cuadro.
- Imagen ovárica en la ecografía: «ovarios en collar».
- Niveles elevados de concentración de estradiol inmediatamente antes de la administración de la hCG o incrementos bruscos de los niveles previo a administrar la misma. Los valores de riesgo no están claramente establecidos, pero se puede considerar que el riesgo está muy aumentado con niveles de estradiol > 2.500 pg/ml, otros autores plantean superior a 3500 pg/ml.
- Formación de un número elevado de folículos de tamaño intermedio (10-14 mm).
- Instauración del embarazo y mayor riesgo si éste es múltiple.
- Mujeres que han desarrollado otras hiperestimulaciones en ciclos previos.
- Uso de hCG como soporte de fase lútea en lugar de progesterona.
- Alérgicas: la fisiopatología es similar por la respuesta inflamatoria que se produce en ambos cuadros (liberación de citoquinas e inmunomoduladores).
- Pico endógeno de LH: la hiperestimulación grave muy raramente se puede producir tras el pico endógeno de LH por un desarrollo espontáneo o farmacológico de múltiples folículos, aún sin administrar la hCG. Se han descrito casos en mujeres con ovario poliquístico o hipotiroidismo.(6,7,8,9)
En resumen, el síndrome de hiperestimulación ovárica grave es una patología predecible, prevenible y evitable en la mayoría de las ocasiones. Pese a todo, ninguna estrategia es totalmente efectiva. En los casos en que se desencadena, el manejo debe ser sintomático y muchas veces multidisciplinario, atendiendo a la corrección de la disfunción en el balance hídrico y en la prevención de sus complicaciones, con las medidas menos invasivas posibles, y siempre teniendo en cuenta la posibilidad de un embarazo siempre que se haya realizado la transferencia embrionaria.(5)
En las pacientes que son sometidas a este tipo de tratamientos de infertilidad, sobre todo para técnicas de alta complejidad, se pueden presentar complicaciones relacionadas con el síndrome de hiperestimulación ovárica, el cual cursa con aumento en el volumen de los ovarios, hemoconcentración por incremento de la permeabilidad capilar y subsecuente producción de un tercer espacio observado clínicamente como edema. En casos severos se desarrolla ascitis, derrame pleural y pericárdico.(8)
Los signos clínicos incluyen alguno o varios de los siguientes: aumento rápido de peso, oliguria o anuria, hemoconcentración, leucocitosis, hipovolemia, descontrol electrolítico (hiponatremia e hiperkalemia), ascitis, derrame pleural y pericárdico, síndrome de distrés respiratorio del adulto (SDRA), hipercoagulabilidad con secuelas tromboembólicas y falla orgánica múltiple. Sin embargo, a pesar de muchos años de experiencia clínica, la patogenia del SHO sigue siendo ambigua.(2,3,4,5,6,7,8,9,10)
Se han descrito dos tipos de SHO según su momento de aparición. El SHO de aparición temprana aparece dentro de los primeros 10 días después de la administración de la hormona gonadotropina coriónica (hCG). Esta presentación clínica se asocia a una respuesta ovárica exagerada a la administración de hCG exógena, teniendo además un carácter habitualmente autolimitado en pacientes que no conciben, y que típicamente se resuelve al momento de la siguiente menstruación.(2,3,4,5,6,7,8,9,10)
La presentación de aparición tardía aparece 10 días después de la administración de hCG exógena, estos casos ocurren cuando las mujeres conciben y hay producción endógena de hCG asociada a un embarazo temprano.(7,8,9,10,11,12,13)
Dentro de los diagnósticos diferenciales a descartar se encuentran la enfermedad pélvica inflamatoria, apendicitis, embarazo ectópico, hemorragias intraabdominales o torsión ovárica.(11)
El manejo de este síndrome es principalmente de soporte porque suele ser autolimitado, sin embargo, dependerá de la gravedad con la que se presenten los síntomas y de si la paciente se encuentra embarazada en el momento de la presentación.(11)
Los casos clasificados como leves o moderados pueden ser tratados de forma ambulatoria y existe la posibilidad de regresión espontánea en los 10-14 días posteriores al inicio de la clínica, principalmente en los casos en los que no haya ocurrido la implantación. Por lo contrario, las pacientes que presenten casos severos o críticos deberán ser hospitalizadas para disminuir el riesgo de presentar complicaciones serias. En la experiencia de la autora, se sugiere el ingreso en casos de cuantía moderada, ya que la evolución hacia la severidad puede ser rápida y con terapia precoz se puede evitar o reducir el riesgo.
El manejo ambulatorio requiere un asesoramiento adecuado de la paciente, se le debe enfatizar la importancia de la ingesta de líquidos, con la recomendación de al menos 1 litro diario, e informar sobre los síntomas y signos de alarma. Dichos signos de alarma incluyen la presencia de disnea, disminución del volumen urinario, edemas en miembros inferiores o alteraciones neurológicas.(7,10)
Es recomendable un seguimiento continuo, al menos dos consultas por semana para evaluar laboratorios: hemograma completo, pruebas de coagulación, función hepática, función renal, electrolitos y ecografía pélvica, además de instruirlas para que registren su peso diariamente.
Con respecto a las pacientes que ameriten manejo intrahospitalario, estas requerirán mayor observación de sus signos vitales, un registro diario de la ingesta de líquidos, diuresis, circunferencia abdominal y peso, así como exámenes de laboratorio frecuentes. Se debe evaluar la ascitis y el tamaño ovárico por medio de ecografía y en caso de presentar datos de derrame pleural o pericárdico, realizar radiografía de tórax.(3, 7,11)
La clave del tratamiento consiste en mantener un adecuado estado de hidratación y equilibrio electrolítico, por lo tanto, se debe considerar la administración de fluidos intravenosos en caso de deshidratación o hemoconcentración. Se recomienda iniciar con soluciones cristaloides, una opción es iniciar con 1bolo rápido de 1L de solución salina al 0,9 %, seguido de solución de dextrosa al 5 %, de 125 a150 mL/h. El objetivo es mantener un gasto urinario mayor a 20-30 mL/h y corregir la hemoconcentración. Si con esta solución no se logra el objetivo, se recomienda cambiar a una solución coloide alternativa o expansores de plasma.
El uso de expansores del plasma, como albúmina, manitol o plasma fresco congelado puede tener un efecto beneficioso al aumentar la presión oncótica para mantener el volumen intravascular; sin embargo deben utilizarse con precaución debido al riesgo de exacerbar la ascitis. La albúmina al 20 % es el expansor de plasma más utilizado, en una dosis de 50 g infundida durante 4 horas. No se recomienda el uso de diuréticos de rutina, éstos pueden disminuir el volumen intravascular, causar hipotensión y aumentar el riesgo de trombosis venosa al aumentar la viscosidad sanguínea.(2,11,12,13)
Sin embargo, si se considera necesario su uso, pueden indicarse junto con solución coloide una vez que el volumen intravascular sea adecuado y se haya revertido la hemoconcentración.
La hemoconcentración, el estado de hipercoagulabilidad en el caso de las pacientes embarazadas y la inmovilización producto del internamiento hospitalario, aumentan el riesgo de presentar un tromboembolismo, por lo tanto, las pacientes requieren anticoagulación profiláctica con heparina de bajo peso molecular, como enoxaparina 40-80 mg/día, sin necesidad de monitoreo. Si la paciente presenta ascitis a tensión, que le provoca dolor abdominal, dificultad respiratoria o presenta oliguria, está indicado realizar paracentesis con el fin de evitar la progresión a casos más críticos.(2,11,12,13,14,15)
Por otra parte, el aumento en el volumen ovárico secundario a la estimulación hormonal puede a su vez generar complicaciones como torsión y ruptura ovárica. El diagnóstico de estas entidades resulta particularmente difícil, ya que los síntomas son inespecíficos y se pueden confundir con los hallazgos del SHO, pero el dolor abdominal súbito, de inicio nocturno y que persiste por más de 24 horas sugiere compromiso anexial. El reconocimiento temprano de estas complicaciones es crucial para evitar la necrosis ovárica y preservar la fertilidad, y aunque la evaluación por ecografía puede ser de utilidad, no es una prueba específica o sensible para torsión ovárica.(11,13,14,15,16,17,18,19,20)
Aunque la fertilización in vitro (FIV) es un enfoque de tratamiento común y seguro para la infertilidad, todavía quedan algunos efectos secundarios no deseados.(4)
Prevención:
La prevención recae en revisiones periódicas por parte del médico con análisis de niveles hormonales y ecografías pélvicas, para descartar la hiperestimulación. También se requiere un tratamiento hormonal individualizado ajustando la dosis a cada paciente. Si se observa un aumento de los niveles de estradiol, superándose los 2500 pg/ml, se deberá seguir uno de los siguientes tratamientos: administrar menos cantidad de hCG (hormona suministrada para inducir la ovulación), continuar con la estimulación varios días sin añadir más medicamentos, tratamiento conocido como coasting, o suprimir la administración de hCG y cancelar el ciclo de inseminación artificial (IA) o fecundación in vitro.
Evitar:
• Administración de hCG para desencadenar la ovulación.
• La producción de hCG por la mujer en el embarazo temprano.
• La supresión hipofisaria mediada por antagonistas de GnRH hace posible la administración de un bolo agonista de GnRH al final de la estimulación ovárica, lo que provoca la liberación brusca de FSH y LH capaces de reproducir el pico fisiológico de LH con la consiguiente maduración ovocitaria y conseguir evitar el uso de hCG.
• Para evitar la producción de hCG exógena, lo más seguro es no realizar la transferencia embrionaria en el ciclo estimulado, sino realizar la criopreservación programada de los embriones (vitrificación) y la criotransferencia en un ciclo posterior no estimulado. La estrategia que combina la administración de un bolo agonista de GnRH con la vitrificación programada de embriones (conocida como “freeze-all”) parece ofrecer una alternativa segura y eficiente para prevenir el SHO sin reducir las posibilidades de embarazo en mujeres con riesgo de desarrollar esta complicación.(14,15,16,17,18)
En cuanto al tratamiento farmacológico se utilizan los siguientes:
Anticoagulantes y heparinas para prevenir trombosis.
Cabergolina: agonista del receptor D2 de dopamina que reduce la hemoconcentración y ascitis en mujeres hiperestimuladas.
Quinagolida: otro agonista de dopamina utilizado para prevenir la hiperestimulación ovárica temprana en pacientes sometidas a fertilización in vitro (FIV).(14,15,16,17,18,19,20)
Conforme aumenta el uso de TRA a nivel mundial, aumenta la importancia del SHO como entidad clínica a incluir dentro de los diagnósticos diferenciales en mujeres que reciben estos tratamientos. Por ello, es importante identificar los síntomas iniciales que puede presentar esta condición para orientar a un diagnóstico oportuno y manejo adecuado de esta condición. Es por ello que la aplicación de medidas preventivas es fundamental ya que, si bien el SHO es una complicación poco frecuente, tiene implicaciones severas para estas pacientes. Ante esto, la educación y la buena comunicación médico-paciente se convierte en una piedra angular que permitirá acceder a una salud reproductiva cada vez más segura.
Se presenta este caso, debido a que en Cienfuegos se comenzó la fertilización in vitro por primera vez en el año 2014, y esta ha sido la paciente que más sintomatología y gravedad presentó en el Centro de Reproducción Asistida de este territorio, sirviendo de experiencia para evitar cuadros tan graves como éste. Se han iniciado hasta la fecha 749 ciclos, presentándose el síndrome en el 1,8 % de los casos, la mayoría han sido ligeros y moderados, y sólo ella con esta gravedad, para el 0,1 %. En la revisión del caso, y ya ahora con una mayor experiencia alcanzada en realizar estos tratamientos, se encontraron aspectos que pudieron ser prevenidos o manejados de forma diferente, como los niveles de estradiol, y el disparo con la gonadotropina coriónica recombinante, o el coasting, ya que no se cuenta en la actualidad con la posibilidad de criopreservar los embriones y transferir en otros ciclos. El diagnóstico fue inmediato, los cuidados en la unidad de terapia intensiva fueron determinantes en la evolución favorable de la paciente, y haber logrado en ciclo posterior de FIV una hiperestimulación ovárica controlada, sin complicaciones y con el resultado satisfactorio de lograr un embarazo clínico y el nacimiento de un niño sano, es de gran satisfacción para médicos y familiares.
Conflicto de intereses
Los autores plantean que no existen conflictos de intereses.
Contribuciones de los autores
Conceptualización: Práxedes de Regla Rojas Quintana, Sandra Gómez Fonseca, Alejadrina Najarro Navarro.
Visualización: Práxedes de Regla Rojas Quintana, Sandra Gómez Fonseca, Alejadrina Najarro Navarro.
Redacción del borrador original: Práxedes de Regla Rojas Quintana, Sandra Gómez Fonseca, Alejadrina Najarro Navarro.
Redacción, revisión y edición: Práxedes de Regla Rojas Quintana.
Financiamiento:
Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos.