INTRODUCCIÓN
La prevalencia de la obesidad ha aumentado rápidamente hasta convertirse en un importante problema de salud. El sobrepeso y la obesidad en la población adulta mundial es del 39 % y 13 %, respectivamente, lo que representa más de la mitad de la población adulta mundial.(1)
En Cuba, según la información aportada por la Encuesta Nacional de Salud, el sobrepeso global es de 56,1 % en la población general. El 17,7 % de los hombres y el 25,0 % de las mujeres son obesas. A la par también se ha elevado la adiposidad abdominal (42,7 %) de forma independiente al sobrepeso, con cifras muy elevadas en el sexo femenino (61,3 %).(2)
La epidemia afecta, en promedio, a un tercio de las mujeres en edad reproductiva, provocando un incremento del riesgo de complicaciones durante la gestación. Además, la obesidad durante el embarazo puede tener un impacto significativo sobre el ambiente intrauterino y, en consecuencia, sobre el desarrollo fetal.(3) La placenta es el órgano que asegura un desarrollo y un peso fetal óptimo. Por tanto, las alteraciones que impacten sobre este órgano serán de importancia crítica en todas las etapas de la preñez.(4)
La rata constituye un adecuado biomodelo para estudiar la placenta, debido a la similitud que existe entre la estructura placentaria de la zona de intercambio, entre múridos y humanos.(4) La obesidad inducida por glutamato monosódico (GMS) en ratas constituye un modelo de obesidad visceral que reproduce las alteraciones metabólicas que se describen en la obesidad humana.(5)
En una investigación previa en ratas gestadas a término (20 días de gestación) se comprobó la disminución del crecimiento y desarrollo fetal y se describió el fenotipo placentario subyacente.(6) Teniendo en cuenta esto, se hace necesario continuar la caracterización del fenotipo placentario inducido por la obesidad visceral pregestacional. Por lo que este trabajo tuvo como objetivo determinar las características morfológicas, el contenido lipídico y el estado redox de las placentas de 14 y 17 días provenientes de ratas con obesidad visceral pregestacional inducida por glutamato monosódico. Así como determinar el momento en que se establecen las alteraciones al nivel placentario.
MÉTODOS
Tipo de investigación, lugar y período: se llevó a cabo una investigación longitudinal, prospectiva, explicativa, con diseño experimental, en el ICBP Victoria de Girón, desde enero de 2023 hasta diciembre de 2023.
Inducción de obesidad:(6) Ratas Wistar hembras recién nacidas fueron divididas en dos grupos: ratas a las que se les administró glutamato monosódico (Sigma-Aldrich, 4 mg/g de peso corporal), vía subcutánea (sc), los días 2, 4, 6, 8 y 10 de vida (OBESAS, n=11) y ratas que recibieron NaCl 0,9 %, sc, en los mismos días (CONTROLES, n=12).
Los animales se mantuvieron bajo condiciones controladas de temperatura (22 ± 3°C), luz (ciclos de 12 h luz/ oscuridad) y humedad relativa (60 ± 5 %). A los 21 días fueron destetados y colocados 4 ó 5 animales por caja hasta los 90 días en que fueron ubicados en cajas independientes. Se les suministró agua y alimento (pienso granulado, Fórmula CMC 1000 producida por CENPALAB) a libre demanda durante todo el experimento.(6)
A los 90 días de vida, a los animales del grupo inyectado con GMS se les determinó el índice de Lee, mediante la raíz cúbica del peso corporal (g) dividido entre la longitud corporal (LC) (cm) como indicador de obesidad. Se consideraron obesas las ratas con IL> 0,300.(6)
Inducción de la preñez: a los 120 días de vida las ratas obesas y controles fueron apareadas durante la noche con machos sanos de la misma cepa, en las fases pro-estro y estro del ciclo estral. La mañana en que se confirmó la cópula por la presencia de espermatozoides en el lavado vaginal se consideró el día 0 (cero) de la gestación.(6,7)
Formación de los grupos experimentales: Una vez que las ratas quedaron gestadas fueron asignadas aleatoriamente a uno de los grupos experimentales:
CON (n=6): ratas sanas a las que se le administró NaCl 0,9 % en el período neonatal y se les practica eutanasia el día 14 de la gestación.
OBS (n=5): ratas obesas a las que se les administró GMS en el período neonatal y se les practica eutanasia el día 14 de la gestación.
CON (n=6): ratas sanas a las que se le administró NaCl 0,9 % en el período neonatal y se les practica eutanasia el día 17 de la gestación.
OBS (n=6): ratas obesas a las que se les administró GMS en el período neonatal y se les practica eutanasia el día 17 de la gestación.
Eutanasia y recogida de muestras: A los 14 o 17 días de gestación se les realizó eutanasia mediante desangrado por punción de la vena cava inferior, bajo anestesia con tiopental sódico (50 mg/kg de peso corporal, intraperitoneal).(7) El día 14 permite evaluar el inicio del período fetal donde la placenta está completamente formada y el día 17 se corresponde con el período de máximo crecimiento, maduración y funcionamiento placentario.(6)
Se realizó la disección de los cuernos uterinos y se colocaron en una placa Petri (100 mm) a temperatura ambiente. Con ayuda de tijeras, pinzas y bajo estereoscopio, se eliminó el tejido periuterino, la pared del útero se abrió en toda su longitud y se retiraron cuidadosamente todas las membranas. Cada feto con su placenta se colocó de forma independiente en una placa Petri con NaCl 0,9 % para la medición de las variables macroscópicas en las placentas. Aleatoriamente se seleccionó una placenta de cada cuerno uterino, a la que se le realizó un corte transversal por delante del cordón umbilical. El fragmento que contiene el cordón fue fijado en formalina tamponada al 10 % durante 24 horas, luego en etanol al 70 % a 4 °C hasta el momento de la inclusión para estudios histológicos. Las placentas restantes fueron almacenadas a -80 °C para determinaciones bioquímicas.
Criterios de exclusión: ratas que no se preñaron a los 30 días de iniciar el apareamiento (150 días de vida). Este criterio se basa en que durante 30 días se producen entre 5 y 6 ciclos estrales, lo cual es suficiente para que una rata fértil quede gestada.(6)
Variables que se determinaron
- Peso fetal (g);(8) mediante balanza digital Gibertini con sensibilidad 0,01g.
- Variables macroscópicas de placenta(8)
Peso placentario (g), mediante balanza digital Gibertini con sensibilidad 0,01g.
Diámetro mayor (mm) y diámetro menor (mm): se obtuvo utilizando un pie de rey. Para lo cual, las puntas del calibrador se colocaron en el borde de la placenta y se midieron los dos ejes que se cortan perpendicularmente en el centro de la placenta que tiene forma de elipse.
Grosor placentario (mm): fue medido tomando como referencia la línea media o sitio de inserción del cordón, usando un pie de rey.
Índice placentario, indicador de eficiencia placentaria o capacidad funcional de la placenta: peso placenta (g)/peso fetal (g).
- Variables microscópicas de placenta(8)
Se utilizaron 5 láminas del corte sagital de la placenta, teñidas con hematoxilina/eosina, por cada grupo de estudio. Por cada lámina se tomó una fotomicrografía a un aumento de 1x en la cual se calculó el área de la mitad sagital de la placenta (μm2) y de la zona del laberinto (μm2) usando la herramienta de selección de área del programa ImageJ.
A cada lámina se le tomaron 10 fotomicrografías, a un aumento de 4x y 10x. En las imágenes se determinó la localización de las zonas de la placenta (zona de unióny zona dellaberinto) y sus características.
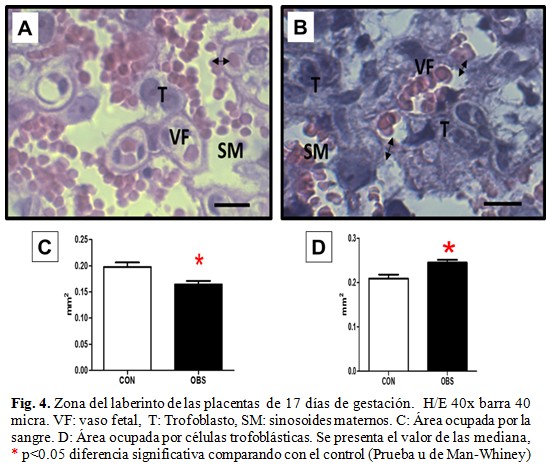
En las imágenes correspondientes a la zona del laberinto a un aumento de 40x se midió el área de sangre (μm2). La misma se calculó midiendo el área ocupada por los sinusoides maternos más los vasos fetales, en 10 campos al azar. Además, se calculó el área de células trofoblásticas en el laberinto (μm2) restando el valor del área de sangre al área total de la imagen.
Todas las imágenes se obtuvieron con un microscopio óptico (Motic BA310) y cámara acoplada (Moticam 10.0 MP) Se guardaron en formato digital (JPEG).
- Variables bioquímicas
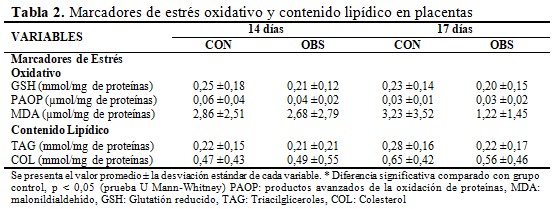
Indicadores de estrés oxidativo:(6) fueron medidos mediante técnicas espectrofotométricas. Para la determinación del malonildialdehído (MDA, indicador de daño oxidativo a lípidos), productos avanzados de oxidación a proteína (PAOP, indicador de daño oxidativo a proteínas), y glutatión reducido (GSH, indicador de capacidad antioxidante), las placentas se descongelaron y homogeneizaron en hielo [150 mg/ 0,5 mL de buffer Na2HPO4-KH2PO4 0,1 M con EDTA 0,1 mM, PMSF (fenilmetilsulfonil fluoruro) 0,5 mM, aprotinina 4 μM, leupeptina 4 μM pH 7,8], mediante homogeneizador eléctrico (HEIDOLPH) a 15000 rpm por 1-2 minutos, en ciclos de 15 segundos. Los sobrenadantes de las placentas de cada rata fueron recogidos y mezclados. De esta forma, se obtuvo una muestra de placentas por rata.
Contenido lipídico en sobrenadante de homogeneizado de placenta:(6) mediante métodos enzimáticos con juegos diagnósticos comerciales (HELFA Diagnósticos, QUIMEFA, E.P.B. “Carlos J. Finlay”) se determinó colesterol (mmol/mg de proteína) y triacilgliceroles (mmol/mg de proteína).
Procesamiento estadístico
Se utilizó el programa estadístico GraphPad Prism 5.01. Los datos se reportan como valores de la media ± la desviación estándar. Se empleó la prueba no paramétrica U de Mann-Withney para la comparación entre los grupos, debido a la no distribución normal de las variables. Las diferencias se consideraron significativas con valores de p<0,05. Para realizar el análisis de las láminas se utilizó el software imagen J.
Consideraciones éticas
Los animales fueron obtenidos del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB). El Comité de Ética para la investigación de nuestra institución aprobó los protocolos usados en este estudio. El trabajo con los animales tuvo en cuenta las regulaciones o pautas establecidas para el cuidado y uso de los mismos.(9)
RESULTADOS
El peso fetal no mostró diferencias entre los grupos el día E14. Sin embargo, el día E17 se constató una disminución significativa del peso fetal en el grupo de las ratas obesas.
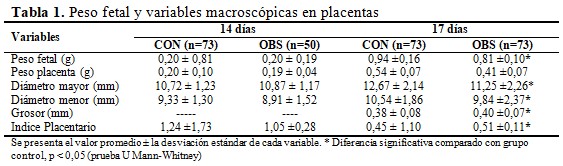
Los pesos placentarios no mostraron diferencias entre los grupos en ninguno de los dos momentos estudiados. En el día E17 se observó una disminución significativa del diámetro mayor y menor de la placenta en el grupo de las ratas obesas respecto al grupo control. Así como un incremento del grosor y del índice placentario. (Tabla 1).
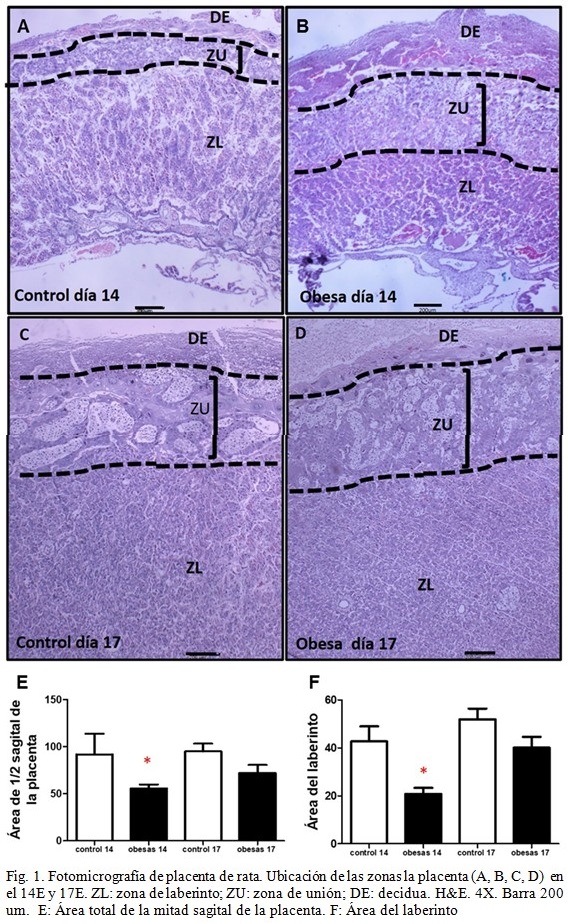
En la estructura placentaria se observaron tres zonas bien definidas histológicamente: 1) decidua materna 2) zona de unión zona y 3) zona del laberinto. La zona de unión se apreció engrosada en el grupo de las ratas obesas respecto al control en ambos momentos del desarrollo. (Fig. 1) Al cuantificar el área de la mitad sagital de la placenta (Figura 1E), se constató que en el día E14, las placentas del grupo de las ratas obesas tenían menor área (55,66 ± 9,18) con respecto al control (91,83 ± 48,83). También, el área de la zona del laberinto (Figura 1F) fue menor en el grupo de las obesas (20,75 ± 5,73) al compararla con el grupo control (42,66 ± 31,45). El día E17, el área de la mitad sagital de la placenta (CON: 94,87 ± 18,56 y OBS: 72,06 ± 19,02) y el área del laberinto (CON: 51,88 ± 10,5 y OBS: 40,05 ± 10,10) no mostraron diferencias estadísticamente significativas entre los grupos. (Figura 1E y 1F).
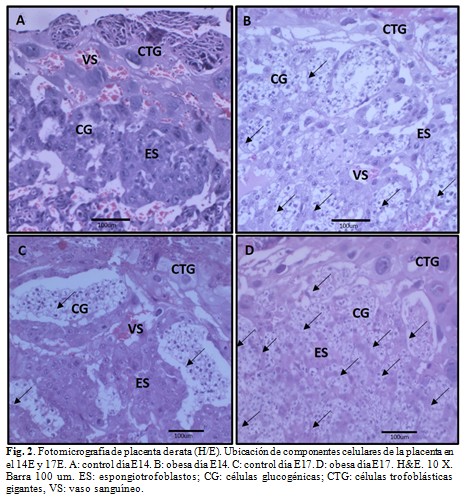
En ambos momentos del desarrollo en el grupo control (Fig. 2 A y C), hacia la parte más externa se observó la decidua materna (DE). Esta zona limita con las células gigantes del trofoblasto (CGT), dispuestas en una capa de 1 a 3 células de espesor de gran tamaño, con citoplasma eosinófilo, un núcleo central, redondo, grande y basófilo que posee de 1 a 3 nucléolos (Fig. 2 A y C).
Por debajo de las células gigantes del trofoblasto se localiza la zona de unión. En esta zona se observaron grandes vasos sanguíneos maternos (VS) y las células del espongiotrofoblasto (ES). Estas células son pequeñas, con un núcleo central redondo y basófilo. Su citoplasma es claro y eosinófilo. También, en la zona de unión se observaron células con aspecto de citoplasma vacío, denominadas células de reserva de glucógeno (CG). Estas células se organizan en forma de quistes (Fig. 2 A y C).
En el grupo de las ratas obesas, las CGT y las células del espongiotrofoblasto son similares estructuralmente al grupo control en el día E14 y E17 (Fig. 2 B y D). En la zona de unión se observó un incremento de quistes de CG con respecto al control (Fig. 2 B y D).
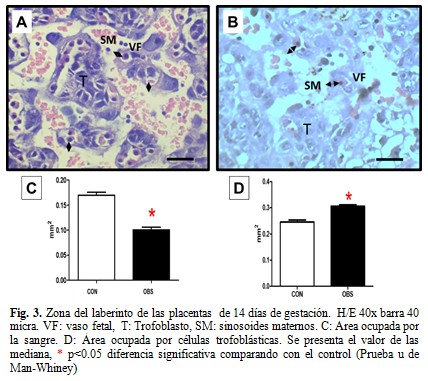
En la zona del laberinto, el día E14 y E17 (Fig. 3A y 4A), se aprecian amplios espacios correspondientes a los sinusoides maternos (SM) y las vellosidades fetales. Los SM se observan como espacios irregulares, en contacto directo con las células trofoblásticas (T) y con presencia de eritrocitos maternos de menor tamaño. Las vellosidades compuestas por células trofoblásticas y vasos fetales (VF) de pequeño calibre inmersos en ellas. Los VF están delimitados por un endotelio y contienen eritrocitos fetales de mayor tamaño (en el día E14 son eritrocitos nucleados y en el día E17 no presentan núcleos). Las células trofoblásticas y el endotelio del VF, constituyen la membrana placentaria que separa la sangre materna de la fetal y permite el intercambio materno fetal.
A diferencia del control, en el grupo de las ratas obesas tanto el día E14 como el E17 (Fig. 3B y 4 B), se observó un aumento de las células trofoblásticas y una disminución del espacio de sangre. Lo cual se corroboró al calcular dichas áreas (Fig. 3C, D y 4C, D). Además, se apreció un engrosamiento de la membrana placentaria en el grupo de las ratas obesas respecto al control. Lo que se hizo más evidente el día 17 de gestación (Fig. 4B).
En relación con las variables bioquímicas que se determinaron en placenta, no se observaron diferencias significativas en los marcadores de daño oxidativo a biomoléculas, en la capacidad antioxidante y en el contenido lipídico entre ambos grupos (Tabla 2).
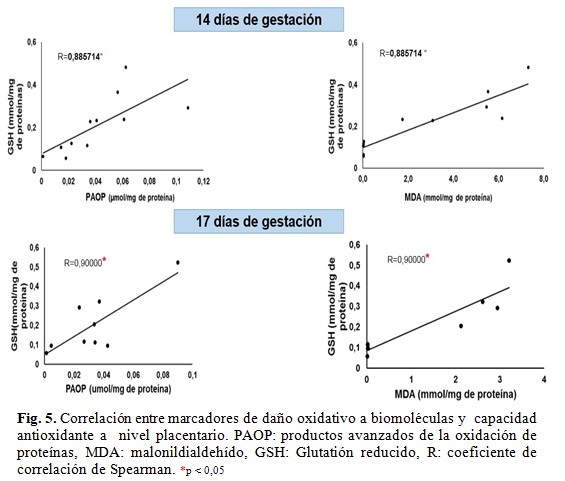
Sin embargo, se evidenció una correlación positiva entre los niveles de PAOP y GSH y entre la concentración MDA y GSH en el grupo de las ratas obesas. (Fig. 5).
DISCUSIÓN
La placenta de la rata completa su desarrollo el día E12.0, quedando conformada por tres zonas: 1) zona del laberinto, 2) zona basal (zona de unión) y 3) decidua basal. A partir de este día, la placenta continúa creciendo a expensas de la proliferación del trofoblasto, las vellosidades se ramifican, aumenta la densidad de capilares fetales por vellosidad y disminuye el grosor de la barrera placentaria, lo que conduce a la maduración placentaria.(4)
Este crecimiento placentario está influenciado por el estado nutricional materno antes y durante del embarazo y está relacionado directamente con su eficiencia funcional. Por tanto, el peso y las principales medidas placentarias (diámetros mayor y menor, grosor) reflejan el crecimiento de diferentes partes de la placenta y, por consiguiente, diferentes aspectos funcionales.(4,10)
En la literatura se plantea que el peso placentario brinda información que permite caracterizar el tamaño de la placenta.(10) En este estudio las placentas no mostraron diferencias de peso entre los grupos en ninguno de los dos momentos estudiados. Estos resultados coinciden con otros estudios realizados, en los cuales no se encontraron diferencias significativas en el peso placentario de ratas entre los grupos analizados.(4,6)
Sin embargo, hay que tener en cuenta que la determinación del peso placentario es el resultado de la suma de dos dimensiones de crecimiento, el área de superficie y el grosor placentario.(10) El área de superficie, hace referencia al área de superficie de intercambio. Para el cálculo de la misma se requiere determinar tanto diámetro mayor como menor.(10)
En este estudio, el día E17 se observó una disminución significativa del diámetro mayor y menor de la placenta en el grupo de las ratas obesas respecto al grupo control. En humanos, la literatura plantea que cuando el diámetro mayor y menor placentario está disminuido se interpreta como una disminución del paso de nutrientes al feto.(11)
Por otro lado, el grosor placentario es una variable que brinda información sobre la arborización de la zona de intercambio velloso y vascular, incluyendo la superficie de intercambio y las áreas sinciciales-vasculares de las vellosidades terminales.(10) Es importante destacar que el tamaño y densidad de las vellosidades no son constantes sino que cambian con la edad gestacional y las distintas condiciones ambientales.
El día E17 se constató un incremento del grosor placentario en las ratas obesas con respecto al control. En la literatura se plantea que condiciones como la malnutrición materna o el déficit de oxígeno aumenta el número de vellosidades y por tanto el grosor estaría aumentado. Estas condiciones adversas producen recién nacido de bajo peso.(12) Lo cual coincide con los resultados de este estudio, donde los fetos de las ratas obesas presentaron una disminución significativa del peso corporal el día E17.
En esta investigación, el aumento del grosor placentario, también pudiera estar relacionado, en parte, con el engrosamiento observado de la zona de unión a expensas de los múltiples quistes de células de reserva de glucógeno en dicha área. El contenido de glucógeno placentario alcanza su punto máximo aproximadamente el E16, 5 antes de disminuir el E18. El incremento de células de reserva de glucógeno es característico de modelos múridos donde se evidencia una disminución del crecimiento fetal.(8,10)
Desde el punto de vista morfológico, las placentas estudiadas mostraron una completa definición estructural. El día 14 de gestación, las placentas del grupo de las ratas obesas presentaron menor área total de la mitad sagital de la placenta y del laberinto, con respecto al control. Sin embargo, el día E17 no se encontraron diferencias estadísticamente significativas de estas áreas entre los grupos, lo cual pudiera sugerir que la placenta se adapta y compensa para procurar una adecuada nutrición fetal.
El crecimiento placentario está relacionado directamente con su eficiencia funcional ya que es la única fuente de nutrientes y oxígeno.(12) El día E17 se constató un incremento del índice placentario en el grupo de las ratas obesas, lo cual indica falta de capacidad del órgano para garantizar el crecimiento y desarrollo adecuado del feto. Esta razón elevada presume disminución de las reservas placentarias y los fetos tienden a mostrar restricción del crecimiento intrauterino.
Además, en el laberinto se incrementó el área ocupada por células trofoblásticas y disminuyó el área correspondiente a los sinusoides maternos en el grupo de las obesas en los dos momentos del desarrollo estudiados. Esto pudiera aumentar el grosor de la membrana vasculosincitial que separa las circulaciones materna y fetal y así justificar el incremento significativo del índice placentario encontrado en el grupo de ratas obesas el día E17 .
Estas alteraciones al nivel del laberinto, pudieran estar relacionadas con el hecho de que la obesidad materna puede modular la angiogénesis placentaria al inhibir la vía de señalización VEGF/VEGFR2. En la literatura se reporta que la obesidad disminuye la vascularización placentaria en el ratón.(13) El desarrollo anormal del tejido trofoblástico pudiera estar relacionado con la exposición al exceso de glucocorticoides. El modelo de obesidad inducida por glutamato monosódico se caracteriza por un exceso de glucocorticoides maternos.(6)
Todas estas alteraciones encontradas en la placenta de las ratas obesas indican la falta de capacidad del órgano para garantizar el crecimiento y desarrollo adecuado del feto. Además, evidencian que las principales medidas placentarias en diferentes “períodos críticos” del desarrollo son predictores del peso al nacer.(10) Por tanto, un desarrollo placentario adecuado es un requisito indispensable para la correcta maduración fetal y evitar resultados perinatales adversos.(14)
Por otro lado, la placenta es una fuente importante de producción de agentes prooxidantes en el embarazo normal. Debido principalmente a la presencia de una alta actividad metabólica mitocondrial y a la acción de enzimas como la NADPH oxidasa o la xantina oxidasa, responsables de la producción de especies reactivas del oxígeno como el anión superóxido o el peróxido de hidrógeno. En condiciones fisiológicas, estas especies reactivas desempeñan funciones importantes como segundos mensajeros en la regulación de la señalización celular. Por tanto, la placenta tiene un sistema complejo de respuesta antioxidante, que generalmente mantiene en equilibrio la acción de las especies reactivas del oxígeno.(13, 15)
En el presente estudio no se encontraron diferencias estadisticamente significativas en los marcadores de estrés oxidativo. Sin embargo, se observó que a mayor concentración de productos avanzados de la oxidación de proteínas y malonildialdehído, mayores niveles placentarios de glutatión reducido. Es decir, a medida que aumenta el daño oxidativo a biomoléculas, se incrementa la defensa antioxidante a nivel placentario.
Estos resultados apuntan a que pudiera haber una adaptación placentaria con el fin de reducir el daño oxidativo y preservar la función de la placenta durante la gestación. Lo cual concuerda con otras investigaciones realizadas.(15) En la literatura se han reportado estudios en la placenta a término de mujeres obesas donde se incrementa la actividad de enzimas antioxidantes como superóxido dismutasa, catalasa y glutatión peroxidasa al comparar con mujeres normopeso. Además, en ratas se ha se ha demostrado que la expresión de catalasa y superóxido dismutasa están considerablemente elevadas en la zona del laberinto.(15)
Se puede concluir que las placentas de ratas con obesidad visceral pregestacional inducida por glutamato monosódico presentan alteraciones estructurales que evidencian una disminución del intercambio materno-fetal.
Conflicto de intereses
Los autores plantean que no poseen conflicto de intereses.
Contribuciones de los autores
Conceptualización: Catherina Capote Guitian, Nínive Núñez López, Gladys González Aguilar, Amanda Llanes Tamayo, Maryanis Mosqueda Furones, Gipsis Suárez Román.
Curación de datos: Catherina Capote Guitian, Nínive Núñez López.
Análisis formal: Amanda Llanes Tamayo, Maryanis Mosqueda Furones, Gipsis Suárez Román.
Investigación: Catherina Capote Guitian, Nínive Núñez López, Gladys González Aguilar, Amanda Llanes Tamayo, Maryanis Mosqueda Furones, Gipsis Suárez Román.
Metodología: Catherina Capote Guitian, Nínive Núñez López.
Visualización: Gladys González Aguilar,
Redacción del borrador original: Catherina Capote Guitian, Nínive Núñez López, Gladys González Aguilar, Amanda Llanes Tamayo, Maryanis Mosqueda Furones, Gipsis Suárez Román.
Redacción, revisión y edición: Catherina Capote Guitian, Nínive Núñez López.
Financiación
Instituto de Ciencias Básicas y Preclínicas Victoria de Girón. La Habana, Cuba.
REFERENCIAS BIBLIOGRÁFICAS
1.Zhao D, Liu Y, Jia S, He Y, Wei X, Liu D, et al. Influence of maternal obesity on the multi-omics profiles of the maternal body, gestational tissue, and offspring. Biomed Pharmacother. 2022;151:113103.
2.Díaz M, Maldonado G, Suárez R, Varona P. Nuevos datos sobre el sobrepeso y la obesidad en Cuba[Internet]. En: Convención Internacional de Salud, Cuba Salud 2022. La Habana: Minsap; 2022[citado 23/06/2024]. Disponible en: file:///C:/Users/Usuario/Downloads/2123-5421-1-PB.pdf
3.Lewandowska M. Maternal Obesity and Risk of Low Birth Weight, Fetal Growth Restriction, and Macrosomia: Multiple Analyses. Nutrients. 2021;13(4):1213-9.
4.Muñoz Cerón Y. Características morfológicas de placenta de 16.5 días de gestación proveniente de ratas con obesidad pregestaciona[Internet]. Cali: Universidad del Valle; 2018[citado23/04/2024]. Disponible en: https://bibliotecadigital.univalle.edu.co/entities/publication/22e3f793-0910-41b8-9973-25a62c9394cb
5.Suárez Román G, Capote Guitián C, Acosta Sánchez T, Fernández Romero T, Clapés Hernández S. Indicadores metabólicos y de estrés oxidativo en ratas con obesidad inducida con glutamato monosódico. Revista Habanera de Ciencias Médicas[Internet]. 2021[citado 12/08/2024];20(4):e3642. Disponible en: http://www.revhabanera.sld.cu/index.php/rhab/article/view/3642.
6.Capote Guitián C, Suárez Román G, Núñez López N, Belo G, Da Costa MF, Valdés Bacallao TC, et al. Influencia de la obesidad visceral pregestacional en el desarrollo placentario y fetal. Revista Habanera de Ciencias Médicas[Internet]. 2023[citado 12/08/2024];22(5):[aprox. 8 p.] Disponible en: http://www.revhabanera.sld.cu/index.php/rhab/article/view/5077
7.Fernández Romero T, Suárez Román G, Clapés Hernández S. Protocolo para la citología vaginal directa de ratas de laboratorio. Revista Habanera de Ciencias Médicas [Internet]. 2021[citado 12/08/2024];20(3):e4086. Disponible en: https://revhabanera.sld.cu/index.php/rhab/article/view/4086/2865
8.Núñez-López N, Tejeda-Borjas V, Cruz-Álvarez Y, Morgado-Gamboa Y, San Martín Henríquez S. Influencia de la NeuroEPO en el desarrollo feto-placentario de ratas en un modelo de insuficiencia placentaria. Revista Habanera de Ciencias Médicas[Internet]. 2024[citado 12/08/2024];22(5):[aprox. 8 p.]. Disponible en: https://revhabanera.sld.cu/index.php/rhab/article/view/5481
9.McCormick-Ell J, Connell N. Laboratory safety, biosecurity, and responsible animal use. ILAR Journal[Internet]. 2019[citado 12/08/2024];60(1):24-33. Disponible en: https://academic.oup.com/ilarjournal/article/60/1/24/5550511
10.Cardoso V, Mazzitelli N, Veiga MA, Furlán R, Grandi C. Medidas del crecimiento placentario y su relación con el peso de nacimiento y la edad gestacional. Revisión bibliográfica. Revista del Hospital Materno Infantil Ramón Sardá[Internet]. 2012[citado 12/08/2024];31(2):69-74. Disponible en: https://www.redalyc.org/pdf/912/91224139006.pdf
11.Freedman AA, Hogue CJ, Marsit CJ, Rajakumar A, Smith AK, Goldenberg RL, et al. Asociaciones entre las características de la morfología placentaria macroscópica y el peso al nacer. Pediatr Dev Pathol. 2018;22(3):94-204.
12.de Paula Nascente LM, Grandi C, Casale D, Cunha V. Placental measurements and their association with birth weight in a Brazilian cohort. Rev Bras Epidemiol. 2020:23:e200004.
13.Hu C, Yang Y, Li J, Wang H, Cheng C, Yang L, et al. Maternal Diet-Induced Obesity Compromises Oxidative Stress Status and Angiogenesis in the Porcine Placenta by Upregulating Nox2 Expression. Oxid Med Cell Longev. 2019;2019:2481592.
14.Tunster SJ, Watson ED, Fowden AL, Burton GJ. Placental glycogen stores and fetal growth: insights from genetic mouse models. Reproduction. 2020;159(6):R213-R235.
15.Santos-Rosendo C, Bugatto F, González-Domínguez A, Lechuga-Sancho AM, Rosa M, Visiedo F. Placental Adaptive Changes to Protect Function and Decrease Oxidative Damage in Metabolically Healthy Maternal Obesity. Antioxidants (Basel). 2020;9(9):794.