Introducción
La inyección percutánea de etanol (IPE) se ha utilizado en el tratamiento de carcinomas hepatocelulares pequeños, lesiones hepáticas metastásicas y adenomas paratiroideos, así como en otras neoplasias endocrinas benignas como los adenomas adrenocorticales productores de aldosterona. Su empleo en el manejo de nódulos tiroideos funcionales autónomos fue introducido en la práctica clínica en 1990. En la actualidad se sugiere como un procedimiento ambulatorio efectivo, seguro y económico para el tratamiento de los nódulos tiroideos benignos.(1, 2)
Los nódulos tiroideos quísticos, aunque generalmente benignos, pueden causar síntomas clínicos (problemas compresivos o estéticos). Los resultados clínicos de la IPE se evalúan mediante la reducción del volumen y la mejora de los problemas clínicos (es decir, la mejora de los problemas estéticos, las molestias a la deglución o los síntomas compresivos).(3)
La mayoría de los autores(4, 5, 6) considera que la IPE representa el tratamiento de primera línea para los quistes y nódulos tiroideos con un componente líquido predominante.
En Cuba no se ha generalizado la inclusión de la IPE como tratamiento de primera línea en pacientes con enfermedad nodular tiroidea benigna. En el Hospital Militar Central Dr. Carlos J. Finlay se realiza este procedimiento como alternativa de primera línea frente al tratamiento quirúrgico y la observación clínica, en pacientes con enfermedad nodular benigna sintomática o con molestias cosméticas.
El objetivo de este estudio es describir los resultados del tratamiento de nódulos tiroideos quísticos y predominantemente quísticos mediante IPE.
Métodos
Se realizó un estudio longitudinal, prospectivo, en pacientes con diagnóstico de bocio nodular benigno, con nódulos quísticos y predominantemente quísticos dominantes, tratados con la IPE en el Hospital Militar Central Dr. Carlos J. Finlay, en el periodo comprendido entre noviembre de 2021 y julio de 2022. Se seleccionaron para el estudio 31 pacientes que cumplieron los siguientes criterios de inclusión:
- Pacientes mayores de 18 años de edad.
- Pacientes sin antecedentes familiares de cáncer de tiroides.
- Pacientes con nódulo dominante quístico (>90 % de componente fluido) o predominantemente quístico (51-90 % de componente fluido), con un volumen ≥ 3 cm3.
- Pacientes con citología negativa de malignidad.
- Pacientes con TSH dentro de parámetros normales (0,37- 4,7 mUl/L)
Se excluyeron pacientes con nódulo sospechoso de malignidad; con síntomas de hiperfunción tiroidea; o que no aceptaron la realización del procedimiento.
Las variables utilizadas en el estudio fueron: edad (años cumplidos en el momento de la inclusión en el estudio), sexo (femenino, masculino), valor de la hormona estimulante de la tiroides TSH (valor de la TSH, al inicio y a los seis y doce meses de realizado el tratamiento), indicación para el tratamiento (síntomas compresivos, molestias a la deglución, preocupación estética), puntuación cosmética* (1- nódulo no palpable ni visible; 2- nódulo palpable pero no visible; 3- nódulo visible a la deglución o hiperextensión del cuello; y 4- nódulo visible a simple vista), tamaño del nódulo* (pequeño, ≤10 ml; mediano, 11 a 30 ml; grande, >30 ml), volumen inicial (volumen (ml) del nódulo al inicio del tratamiento), volumen final (volumen (ml) del nódulo al final de cada periodo de seguimiento: al mes, tres meses, seis meses y doce meses de realizado el tratamiento), por ciento de reducción del volumen* (se calculó por la fórmula Vi –Vf / Vf x 100, donde Vi es volumen inicial y Vf volumen final), volumen total de etanol (cantidad de ml de etanol inyectado a cada nódulo), número de sesiones (cantidad de veces que se aplicó la inyección a cada nódulo), eficacia de la técnica* (reducción >50 % del volumen inicial del nódulo a los 12 meses de tratamiento), éxito clínico* (completo: resolución completa de los síntomas; parcial: mejoría de los síntomas, pero aún presentes; ausente: sin mejoría de los síntomas), efectos secundarios*: eventos no deseados que son algo esperados durante o después del procedimiento (ardor, dolor, disfonía transitoria, edema facial), complicaciones menores*: eventos no deseados que resuelven sin terapia, sin consecuencias o que requieren terapia nominal, sin hospitalización; complicaciones mayores*: eventos no deseados que requieren terapia con hospitalización menor (<48 horas) o que requieren terapia importante, aumento no planificado en el nivel de atención u hospitalización prolongada (>48 horas).
Las variables marcadas con el asterisco (*) se definieron de acuerdo con la propuesta de estandarización de terminología y criterios de reporte de 2019.(7) Las cualitativas se describieron por frecuencias absolutas y porcentajes; para las cuantitativas se utilizó la media, con la desviación estándar, así como el valor mínimo y el máximo. Los cambios entre los volúmenes inicial y final de los nódulos se evaluaron mediante la prueba t de Student para muestras relacionadas. Los datos fueron ingresados y analizados en el programa IBM SPSS 23. Se trabajó con un nivel de confiabilidad de un 95%.
Esta investigación se realizó cumpliendo con los principios de la Declaración de Helsinki, de las normas CIOMS-OMS para investigaciones en humanos y de la Declaración Universal sobre Bioética y Derechos humanos.
A todos los pacientes incluidos en el estudio se les explicó el procedimiento a realizar, con los posibles efectos adversos y complicaciones descritas en la literatura. Se les solicitó el consentimiento informado por escrito, en un modelo con esta explicación detallada y las otras opciones de tratamiento dispuestas en el centro. Los datos solo se emplearon con fines investigativos, sin revelar la identidad de los pacientes. La investigación fue aprobada por el Comité de Ética del Hospital Militar Central Dr. Carlos J. Finlay.
Para el procedimiento se utilizó aguja 23 G, jeringas de 5 y 10 ml, etanol 99 %, torundas y equipo de ultrasonido Aloka Alpha 5, con transductor de 7,5 MHz.
Los pacientes fueron colocados en posición decúbito supino, con una pequeña almohada detrás de las escápulas para mantener el cuello en hiperextensión. Después de la esterilización de la piel, se insertó la aguja acoplada a una jeringa, bajo guía ecográfica hasta el centro de la lesión objetivo. Se aspiró el contenido líquido, dejando escasa cantidad, para facilitar la inyección del etanol. Una vez realizada la aspiración y manteniendo la aguja en la misma localización, se evacuó el contenido aspirado y se le conectó otra jeringa con el etanol para realizar la inyección. La difusión de etanol a través de la lesión se controló como ecogenicidad intensa en la observación en tiempo real mediante ecografía. En todos los casos se inyectó el 30 % del volumen del nódulo, estimado por ecografía antes de cada aplicación, teniendo como límite máximo 4ml. No se aspiró el etanol inyectado. Las sesiones de inyección se realizaron mensualmente, previas evaluaciones del volumen nodular por ecografía y evaluación clínica. Se consideró el tratamiento concluido cuando: a) desaparecieron los síntomas o las molestias cosméticas en los pacientes; b) el volumen nodular se redujo por debajo de los 3 cm3.
La IPE fue realizada por el mismo investigador, con experiencia en la punción con aspiración con aguja fina, apoyado por otro investigador especialista en Imagenología experimentado en ultrasonido, quien realizó todas las evaluaciones ecográficas.
Se mantuvo comunicación telefónica con todos los pacientes y fueron valorados en consulta de seguimiento al mes, a los tres, a los seis meses y a los doce meses de realizado el tratamiento. Al inicio del tratamiento y en cada consulta de seguimiento se le realizó a cada paciente evaluación clínica, ecografía (inicial y evolutiva), se aplicó la puntuación cosmética, y se realizó evaluación del estado funcional de la glándula a los seis y doce meses del tratamiento, mediante el valor de la TSH.
Resultados
La edad media de los pacientes incluidos en este estudio fue de 43,6 ± 14,02 mínimo 21 y máximo 79 años. Predominó el sexo femenino (90,3 %) y el valor de la TSH se mantuvo en niveles normales durante el período de seguimiento. La indicación más frecuente fue la preocupación estética, presente en 28 pacientes (90,3 %).
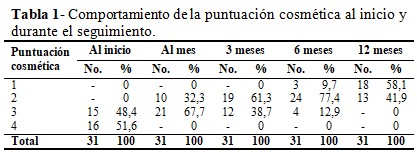
Las puntuaciones cosméticas presentes al inicio del tratamiento fueron la 3 y la 4, con 48,4 % y 51,6 % cada una, lo cual se fue desplazando a las tres primeras puntuaciones según avanzó el seguimiento, hasta concentrase a los 12 meses en las puntuaciones 1 y 2 (58,1 % y 41,9 %). (Tabla 1).
El 58,1 % de los pacientes presentó nódulos de tamaño mediano, y el 22,6 % nódulos grandes, presentaciones que fueron reduciéndose hasta lograr un 100 % de nódulos pequeños desde los seis meses. (Tabla 2).
La media del volumen total de etanol inyectado a los nódulos durante el tratamiento fue de 6,3 ± 2,8 mínimo 2 y máximo 12 ml. Con relación al número de sesiones fue de 1,7 ± 0,6 mínimo 1 y máximo 3 sesiones.
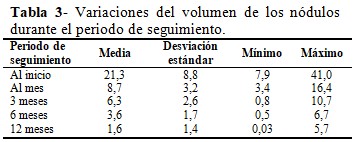
Hubo una reducción estadísticamente significativa del volumen de los nódulos (p<0,001). (Tabla 3).
La media del porciento de reducción del volumen de los nódulos fue de56,7± 10,5mínimo 33,1y máximo86,9;68,6 ± 11,7 mínimo 41,4 y máximo 92,7; 81,1 ± 9, 4 mínimo 58,9 y máximo 96,2 y 92,5 ± 5,5 mínimo 81,0 y máximo 99,8 al mes, 3,6 y 12 meses de realizado el tratamiento. La eficacia de la técnica se observó en el 100 % de los casos.
El éxito clínico fue completo en el 100 % de los pacientes, a los 12 meses de seguimiento post tratamiento. El ardor fue el efecto adverso que se presentó, referido por 2 pacientes (8,33 %). No se observaron complicaciones durante el estudio.
Discusión
La edad media de los pacientes incluidos en este estudio fue de43,6 ± 14,0. Deandrea y colaboradores(8) informan en su estudio una edad media de 53 ± 13 y 45 ± 14 en los grupos de Turín y Foggia respectivamente. Por su parte, Halenka y colaboradores(9) encontraron una edad media de 49,0. Después de los 40 años, especialmente después de los 60, el bocio nodular es más común.(1)
El predominio del sexo femenino en este estudio se corresponde con otras investigaciones.(4, 8) En general, existe una clara evidencia del predominio de la enfermedad tiroidea en el sexo femenino.(9, 10)
El valor de la TSH durante todo el estudio se mantuvo dentro de los límites normales, resultados similares a los mostrados por otros autores que sugieren que la IPE en nódulos quísticos y mixtos no interfiere con el funcionamiento de la glándula, a diferencia de otros tipos de tratamiento.(11)
La indicación más frecuente que se presentó en esta investigación fue la preocupación estética, que resulta la causa más frecuente de indicación quirúrgica del bocio nodular benigno,(12) en correspondencia con el empleo de la IPE como alternativa a la cirugía.
La desaparición de la puntuación cosmética 4 (predominante al inicio del tratamiento), al mes de seguimiento pos tratamiento y la presencia a los seis meses de realizado el tratamiento de la puntuación cosmética 1 (con predominio de esta a los doce meses se seguimiento); así como el incremento de los nódulos pequeños y la desaparición de los nódulos grandes y medianos durante el periodo de seguimiento, manifiestan los resultados positivos del tratamiento con la IPE para la reducción del volumen de los nódulos tiroideos quísticos y predominantemente quísticos, y la consecuente mejoría clínica de los pacientes con bocio nodular y estos tipos de nódulos dominantes.
La guía de práctica clínica de la Asociación Europea de Tiroides de 2020(13) para el uso de ablación guiada por imágenes en nódulos tiroideos benignos, recomienda la IPE como tratamiento de primera línea para los nódulos tiroideos quísticos benignos.
La media del volumen total de etanol inyectado, así como el número de sesiones realizadas en este estudio difieren de lo referido en otros estudios.(9, 14) No existe consenso internacional en cuanto a la frecuencia de la IPE, el volumen de etanol a inyectar en cada sesión, ni el límite de sesiones a realizar.(1, 2, 10)
La tasa de eficacia se define como el porcentaje de nódulos tratados con éxito.(8) En este estudio fue del 100 %, con una reducción media del volumen de los nódulos de 92,5 a los 12 meses de seguimiento. Solymosi y colaboradores(14) reportan una tasa de eficacia del 79,4 % en un período de seguimiento de 11 años, con una reducción media del volumen de los nódulos de 70,2 %. Por su parte, Halenka y colaboradores.(9) reportan una tasa de eficacia del 100 % en un período de seguimiento de 12 meses, con una reducción media del volumen de los nódulos de 95,0 %.
En este estudio dos pacientes (8,33 %) refirieron ardor moderado durante la realización de la IPE, que fue cediendo inmediatamente al finalizar el procedimiento, y desapareció antes de la hora siguiente. Halenka y colaboradores(9) observaron solo complicaciones menores, y fue el dolor local leve y transitorio el más frecuente (58/200, ≈29 %), que generalmente desapareció dentro de varias horas, pero no más tarde de tres días después del procedimiento. Dos pacientes (2/200, 1 %) con quistes complejos grandes experimentaron disfonía que duró de 7 a 14 días, y desapareció espontáneamente sin necesidad de un examen especializado adicional. El tratamiento de los pacientes con nódulos tiroideos con la IPE es generalmente bien tolerado y las complicaciones en su mayoría son menores y transitorias.(4, 10)
El tratamiento con la IPE en pacientes con bocio nodular y nódulos tiroideos quísticos o predominantemente quísticos es seguro y eficaz, con efectos adversos transitorios y complicaciones muy poco frecuentes a los 12 meses del tratamiento.
Conflicto de intereses:
Los autores declaran que no existe ningún conflicto de intereses.
Contribución de autores:
Conceptualización: Lázaro Lorda Galiano
Curación de datos: Lázaro Lorda Galiano, Jacinto Oscar Navas Igarza
Análisis formal: Lázaro Lorda Galiano
Investigación: Lázaro Lorda Galiano, Jacinto Oscar Navas Igarza
Metodología: Lázaro Lorda Galiano
Administración del proyecto: Lázaro Lorda Galiano
Recursos: Lázaro Lorda Galiano, Jacinto Oscar Navas Igarza
Supervisión: Lázaro Lorda Galiano, Jacinto Oscar Navas Igarza
Validación: Lázaro Lorda Galiano, Jacinto Oscar Navas Igarza
Visualización: Lázaro Lorda Galiano
Redacción- borrador orignal: Lázaro Lorda Galiano
Redacción – revisión y edición: Lázaro Lorda Galiano
Financiacion:
Hospital Militar Central Dr. Carlos J. Finlay. La Habana.