Introducción
Las reacciones adversas a medicamentos (RAM) son definidas según la Organización Mundial de la Salud (OMS) como una reacción nociva y no deseada que se produce con la administración de un medicamento, a dosis utilizadas habitualmente, para prevenir, diagnosticar, tratar una enfermedad o modificar una función biológica.(1)
La farmacovigilancia es una de las estrategias principales de la farmacoepidemiología, actividad que se inició en Europa a finales de los años 60 del siglo pasado.(2) En Cuba se implementó en 1976, y en la actualidad es dirigida por la Unidad Coordinadora Nacional de Farmacovigilancia, del Ministerio de Salud Pública.(2)
Datos y cifras registrados por la OPS, sitúan a la DM como un problema de salud En 2019, la diabetes fue la causa directa de 284,049 muertes y el 44% de todas las muertes por diabetes ocurrieron antes de los 70 años (1,5 millones de muertes y el 48% antes de los 70 años, a nivel mundial).(3) En Cuba, el reporte de la prevalencia de esta enfermedad también se eleva con los años, hasta convertirse en una de las primeras causas de muertes.(4) Una de las complicaciones más temidas de la DM es la úlcera de pie diabético (UPD), afección compleja, definida como “una alteración clínica de base etiopatogénica neuropática inducida por la hiperglucemia mantenida.(5) En el tratamiento de la UPD se emplea el Heberprot-P®, producido por el Centro de Ingeniería Genética y Biotecnología.(6)
La información sobre un fármaco reunida durante la fase de pre-comercialización es inevitablemente incompleta con respecto a las posibles reacciones adversas. La farmacovigilancia es necesaria en cada país, ya que hay diferencias entre países (y aún entre regiones en algunos países) en la manifestación de reacciones adversas a medicamentos y otros problemas relacionados con estos.(7)
Se realizó esta investigación para describir las RAM del Heberprot- P® en pacientes con UPD hospitalizados.
Métodos
Se realizó un estudio descriptivo, prospectivo, de farmacovigilancia activa en el servicio de Angiología, del Hospital General Universitario “Dr. Gustavo Aldereguía Lima”, de Cienfuegos, en el periodo enero-diciembre de 2022. Se estudiaron los 170 pacientes que en dicho lapso de tiempo cumplieron los criterios diagnósticos de UPD y fueron tratados al menos con una dosis de Heberprot- P® durante su ingreso en el servicio de Angiología.
Solo se excluyeron aquellos que por decisión propia no desearon participar en la investigación. Las variables estudiadas fueron: sexo, edad, color de la piel, ocurrencia de RAM (si o no), tipo (vómitos, tiriteo, ardor en el sitio de inyección, dolor en el sitio de inyección, escalofríos y temblores, entre otros); intensidad (leve, moderada, severa); gravedad (si, no); causalidad (muy probable/ seguro, probable, posible, improbable, no relacionado, no evaluable/no clasificable).
Las RAM fueron recogidas en una planilla de datos tomada de los ensayos clínicos que se realizan en Cuba.(7) los cuales se clasificaron:
La intensidad de la RAM se consideró leve cuando: fue bien tolerada por el sujeto; causó mínimas molestias y no interfirió con las actividades cotidianas (aseo, alimentación, cambiares de ropa); moderada: lo suficientemente molesto como para interferir las actividades cotidianas; y severa: impidió las actividades cotidianas.
Se consideraron eventos de RAM graves, cuando, a cualquier dosis, se produjo la muerte o existió amenaza para la vida del sujeto; cuando este requirió de hospitalización o prolongar la hospitalización en curso; cuando produjo una incapacidad/invalidez significativa o persistente, defecto de nacimiento o una anomalía congénita. Además, se consideraron como graves aquellos eventos que, aunque no cumplieron con alguno de los criterios anteriores, en opinión del investigador, pusieron en riesgo la salud del paciente o requirieron intervención médica o quirúrgica para prevenir la ocurrencia de alguno de los criterios anteriores.
La causalidad se clasificó de la siguiente forma:
- Muy probable/ seguro: Evento clínico con una relación temporal creíble con el medicamento y que no se puede explicar por enfermedad concomitante u otros medicamentos o productos.
- Probable: Evento clínico con una relación temporal razonable con el medicamento y que es improbable que sea explicado por enfermedad concomitante u otros medicamentos o productos.
- Posible: Evento clínico con una relación temporal razonable con el medicamento, pero que también podría ser explicado por enfermedad concomitante u otros medicamentos o productos.
- Improbable: Evento clínico con una relación temporal que hace improbable una relación con el medicamento y que podría ser creíble que sea explicado por enfermedad concomitante u otros medicamentos o productos.
- No relacionado: Evento clínico con una relación temporal con el medicamento que es incompatible con una asociación causal y que puede ser explicado por una enfermedad concomitante u otros medicamentos o productos.
- No evaluable /no clasificable: Evento clínico con información insuficiente para evaluarle.
Se elaboró una base de datos para procesar la información, mediante el paquete de programas estadísticos SPSS (Statistic Package for Social Science, Chicago Illinois, Versión 22.0). Los resultados se muestran en tablas de frecuencias absolutas y relativas.
Durante la planificación de esta investigación se respetaron las bases éticas de la investigación en seres humanos. Fue puesto a disposición del Comité de Ética de la Investigación Científica del centro y recibió su aprobación.
Resultados
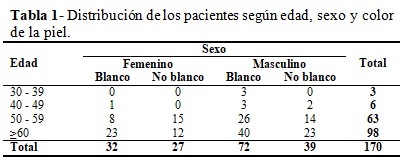
Predominaron los pacientes de piel blanca (104 y del sexo masculino (111). En cuanto a la edad, los más afectados pertenecieron al grupo de edades de 60 o más años, con 98 pacientes, seguido del grupo de 50 – 59 años. (Tabla 1).
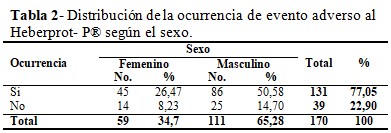
El 77 % de los pacientes tuvo algún evento adverso, sobre todo en el sexo masculino, con un 50,58 %; mientras que en mujeres se presentó en un 26,47 %. (Tabla 2).
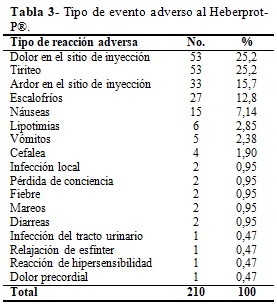
El dolor en el sitio de inyección y el tiriteo fueron los eventos más frecuentes. Ambos se presentaron en 53 pacientes (25,2 %), seguidos por ardor en el sitio de inyección (15,7 %), escalofríos (12,8 %) y náuseas (7,14%). (Tabla 3).
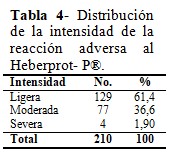
De los 210 eventos adversos, 129 fueron clasificados como ligeros para un 61,4 %, 77 como moderados y 4 como severos (1,9 %). Dentro de los 4 eventos severos se reportaron 2 pacientes con pérdida de conciencia, un paciente con una reacción anafiláctica y otro con dolor precordial. (Tabla 4). O sea, el 98,1 % fueron eventos no graves, mientras que solo 4 fueron graves, para un 1,90 %.
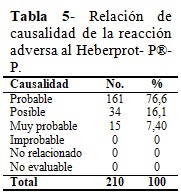
Fueron evaluados como probables 161 eventos, lo que representó el 76,6 %; 34 como posibles; y 15 eventos como muy probables, para un 7,4 %. (Tabla 5).
Discusión
Según los resultados de esta investigación y otras consultadas, existe variabilidad en cuanto a las edades y sexo más afectados por la UPD. Estudios realizados en otras provincias cubanas observaron predominio en el sexo femenino,(8, 9) a diferencia de lo obtenido en esta serie. Un análisis similar desarrollado en Ecuador también encontró mayor presencia en mujeres,(10) aunque con respecto a los grupos etarios existió correspondencia de este con el presente estudio. De tal forma, es posible señalar que la aparición de la UPD puede ocurrir en cualquier edad y género en pacientes con DM, pues más bien está condicionada por estilos de vida inadecuados, como la obesidad, el sedentarismo, el tabaquismo y los malos hábitos alimenticios, entre otros.
En investigaciones realizadas en la provincia de Cienfuegos los resultados difieren, pues la mayoría de los pacientes sometidos al medicamento no presentó eventos adversos;(8, 10, 11, 12) solo un estudio mostró similitud en este sentido.(9) A pesar de esto, y en concordancia con el resto de las investigaciones, el Heberprot- P® sigue siendo un fármaco seguro, con baja incidencia de eventos adversos. Es oportuno destacar que los 131 pacientes afectados por los 210 eventos adversos se recuperaron y no presentaron secuelas.
Muchos de los eventos adversos descritos en la serie de pacientes analizados, están registrados en la literatura,(13) y en general las experiencias de otros autores son muy similares.(6, 8, 9, 10, 14, 15)
En el estudio de Fiallo y colaboradores existen semejanzas en cuanto a la intensidad de las RAM, pues de los 51 pacientes solo 17 (33,3 %), presentaron sintomatología leve.(10)
Otros autores también mostraron iguales resultados, o sea, con predominio de la forma ligera.(8, 10, 11, 16, 17, 18, 19)
Los eventos adversos fueron evaluados según el algoritmo de causalidad establecido por la OMS. Se comprobó que fueron reacciones adversas como consecuencia de la administración del fármaco, y la mayoría fueron clasificadas como posibles, según la relación de causalidad.
En el estudio realizado en Villa Clara en 2020 predominaron los muy probables (64,73 %), seguidos de los posibles (17,44 %),(9) lo cual no se corresponde con la presente investigación.
En el estudio de Álvarez y colaboradores,(19) que tuvo como objetivo caracterizar los eventos adversos informados durante el tratamiento con Heberprot- P®-P en diferentes instituciones de salud cubanas, se obtuvo como resultado que todas las reacciones adversas que se presentaron según la relación de causalidad se consideraron posibles.
A pesar de ser un fármaco seguro, el Heberprot- P® requiere ser objeto de estudios profundos de farmacovigilancia, pues todo medicamento comercializado necesita una vigilancia continua. Su registro no significa que se conozca todo sobre él.
Conflicto de intereses:
Los autores no refieren conflicto de intereses con el producto de investigación.
Contribución de autores:
Conceptualización: Annavely González Ocaña, Ana María Ramos Cedeño.
Curación de datos: Annavely González Ocaña, Yeny Dueñas Pérez.
Análisis formal: Annavely González Ocaña, Ana María Ramos Cedeño, Yeny Dueñas Pérez, Francisco Carlos Valladares Más, Yaima Arrechea Betancourt
Investigación: Annavely González Ocaña, Ana María Ramos Cedeño, Yeny Dueñas Pérez, Francisco Carlos Valladares Más, Yaima Arrechea Betancourt.
Metodología: Annavely González Ocaña, Ana María Ramos Cedeño.
Recursos: Annavely González Ocaña, Ana María Ramos Cedeño, Yeny Dueñas Pérez, Francisco Carlos Valladares Más, Yaima Arrechea Betancourt.
Validación: Annavely González Ocaña, Ana María Ramos Cedeño, Yeny Dueñas Pérez, Francisco Carlos Valladares Más, Yaima Arrechea Betancourt.
Redacción – revisión y edición: Annavely González Ocaña, Ana María Ramos Cedeño, Yeny Dueñas Pérez, Francisco Carlos Valladares Más, Yaima Arrechea Betancourt.
Financiamiento:
No recibió financiamiento.