INTRODUCCIÓN
El experimento es un método empírico generalmente empleado en las ciencias. También conocido como método experimental, consiste en provocar intencionalmente algún cambio y observar e interpretar su resultado con una finalidad cognoscitiva.
Cuando el investigador plantea el problema de investigación, define su alcance inicial, formula la o las hipótesis y plantea los objetivos, debe visualizar la mejor manera de contestar las preguntas de investigación que lo conduzcan al cumplimiento de estos últimos. Esto implica seleccionar o desarrollar uno o más diseños de investigación y aplicarlos al contexto particular de su estudio. El término diseño se refiere al plan o estrategia concebida para obtener la información que se desea con la finalidad de responder al planteamiento del problema.
Casos particulares de investigaciones en salud en los que tiene aplicación el método experimental son los ensayos clínicos. La conceptualización de estos estudios ha sufrido transformaciones. La mayoría de las definiciones sobre el término “ensayo clínico” (EC) tienen como limitaciones referirse fundamentalmente a los EC controlados. La definición que sobre estos estudios ofrecen las Conferencias Internacionales de Armonización (conocida como ICH, por sus siglas en inglés) es más abarcadora y conceptualiza un EC/estudio clínico como cualquier investigación en sujetos humanos dirigida a descubrir o verificar los efectos clínicos, farmacológicos y/u otros efectos farmacodinámicos de un producto en investigación, y/o a identificar cualquier reacción adversa al producto en investigación, y/o a estudiar la absorción, distribución, metabolismo y excreción de un producto en investigación, con el objeto de determinar su seguridad y/o eficacia. Este concepto es aceptado en Cuba para esta actividad.(1,2)
Aunque los diseños experimentales que se presentan en textos de metodología de la investigación constituyen la base para los diseños clásicos de los EC, no suele encontrase la diagramación de ellos en la literatura específica especializada de esta actividad. Por ello, el propósito de este artículo es ejemplificar, a través de diferentes EC efectuados en Cuba con diversos productos de investigación, cómo se diagrama el estudio para su mejor comprensión y ejecución.
DESARROLLO
Para comprender mejor los diagramas que se ofrecerán posteriormente se presenta en el cuadro 1 la simbología básica para los diseños experimentales que generalmente se emplea en los textos especializados de metodología de la investigación. (Cuadro 1).(3,4)
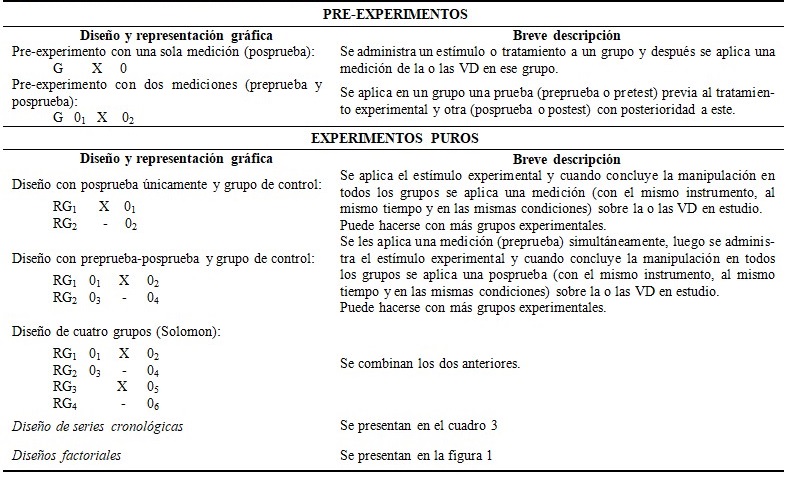
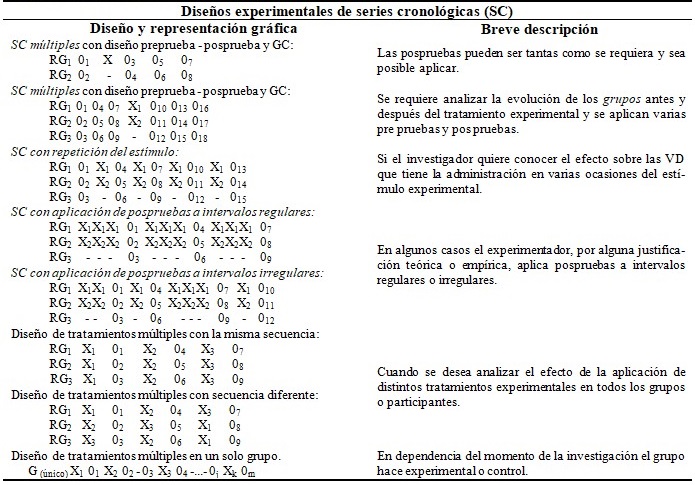
Existen varias clasificaciones para los diseños experimentales en la literatura especializada en metodología de la investigación, sin embargo en el presente trabajo se prefiere presentar la tipología de Campbell y Stanley (1966), asumida por Hernández,(3) quien los divide en tres clases: pre-experimentos, experimentos puros y cuasi-experimentos. Algunos de los diagramas de estos tipos de diseños se presentan en los cuadros 2 y 3, así como en la figura 1.
Los cuasi-experimentos son muy parecidos a los experimentos propiamente dichos o puros. En estos diseños también se manipula, al menos, una variable independiente (VI) para observar su efecto sobre una o más variables dependientes (VD). Solo difieren de los experimentos puros en el grado de seguridad que puede tenerse sobre la equivalencia inicial de los grupos, ya que en ellos no hay asignación al azar de los sujetos ni emparejamiento porque los grupos ya están conformados antes del experimento; tanto el grupo experimental (GE) como el grupo de control (GC) (si solo hubiesen dos) son grupos intactos; las razones por la que surgen y el modo en que se integran esos grupos es independiente al experimento. Los diseños cuasi-experimentales pueden ser deducidos de los correspondientes diseños experimentales puros anteriormente tratados con solo quitarles la “R” o las “E” de asignación al azar o emparejamiento en los diagramas. Las comparaciones, interpretaciones y los análisis son prácticamente equiparables.
El diseño de un EC es muy importante en el establecimiento de la integridad de los datos y la credibilidad de la información en el estudio. Estos diseños se clasifican en tradicionales y adaptativos.
Los diseños adaptativos son aquellos que permiten modificar o adaptar uno o más aspectos específicos del estudio después de su inicio en base al análisis interino de los datos sin socavar su validez e integridad. Constan de múltiples etapas y en cada una se realizan análisis de datos y adaptaciones basadas en la información actualizada para maximizar las opciones de éxito del estudio. Las modificaciones son prospectivas y planificadas y pueden llevarse a cabo con o sin cegamiento y con diferentes aproximaciones estadísticas. No se consideran como tal las enmiendas al protocolo o revisiones no previstas, independientemente de la causa que las motive. En función de la etapa de desarrollo clínico se admiten diferentes tipos de adaptaciones que se pueden resumir en:(5)
- Escalado / desescalado de dosis.
- Terminación temprana por toxicidad, éxito o no utilidad.
- Cierre o apertura de nuevos grupos de tratamiento.
- Combinación de etapas.
- Aleatorización ajustada a la respuesta, covariables o marcadores biológicos.
- Reestimación del tamaño de la muestra.
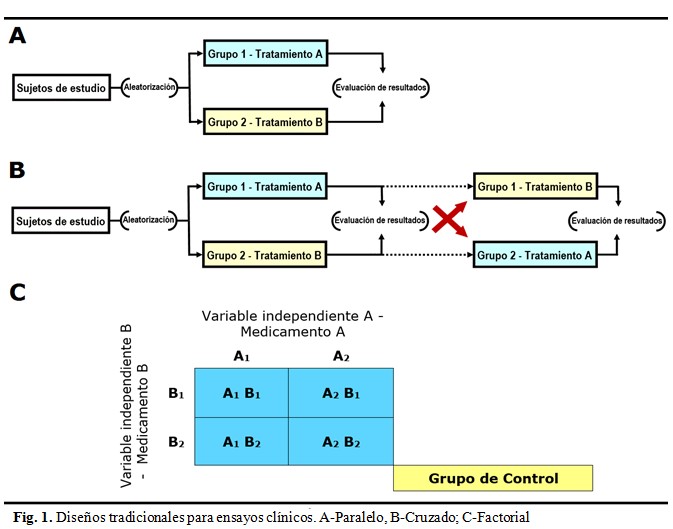
Al observar la figura 1 se comprende fácilmente el curso de los diseños paralelo y cruzado. En los diseños factoriales se manipulan dos o más VI e incluyen dos o más niveles o modalidades de presencia en cada una de ellas. La preparación básica de un diseño factorial consiste en que todos los niveles o modalidades de cada VI son tomados en combinación con todos los niveles o modalidades de las otras VI. En el diseño factorial más simple se manipulan dos variables (cada una con dos niveles). A este diseño se le conoce como “diseño factorial 2 × 2”. Si se presentara un “diseño factorial 4 x 3 x 2”, se estaría haciendo mención a un diseño con tres VI con cuatro, tres y dos niveles de manipulación respectivamente. El número de grupos o condiciones que se forman en un diseño factorial es igual a todas las posibles combinaciones que surgen cuando se cruzan los niveles de una VI con los niveles de las otras variables del mismo tipo. Así, en un diseño 2 × 2 tendremos al menos cuatro grupos.
A continuación se presentan estudios clínicos que se diagraman acorde a lo expuesto anteriormente. Es necesario aclarar que en un EC, como puede suceder en otro tipo de investigación experimental, pueden aplicarse varios diseños en dependencia de sus particularidades. Los ejemplos que se presentan pertenecen a investigaciones complejas de las que se diagrama en función de la variable escogida por los ponentes.
Ejemplo 1: Estudio “Dermofural-PD”[a]
Se realizó un EC fase II, abierto, monocéntrico y no controlado en el servicio de Angiología del Hospital Universitario Arnaldo Milián Castro, con el objetivo de evaluar el efecto y seguridad terapéutica de la aplicación tópica del producto en investigación (Dermofural® 0.15 % en ungüento) en el tratamiento de la infección leve asociada a las úlceras del pie diabético.
Los pacientes recibieron siete aplicaciones (una diaria) del medicamento, posterior a la cura de las lesiones. La variable principal fue la respuesta clínica transcurridas 24 horas de la última aplicación del tratamiento teniendo en cuenta la severidad de la infección. Los exámenes microbiológicos y las determinaciones sanguíneas de laboratorio se efectuaron antes de iniciar el tratamiento y un día después de finalizado el mismo.
Este es un ejemplo de estudio clínico sin GC, que se corresponde con un pre-experimento con preprueba y posprueba que se diagrama así:
G 01 X 02
En este caso, X representa las siete aplicaciones de Dermofural®, 01 las mediciones clínicas y de laboratorio previas a la aplicación del tratamiento y 02 las del octavo día.
Ejemplo 2: Estudio “Lipotransferencia por centrifugación asistida con células madre”.[b]
Se realizó un EC fase III, simple ciego, aleatorizado, con dos grupos en paralelo, en pacientes con signos de envejecimiento facial atendidos en el Hospital Clínico-Quirúrgico Hermanos Ameijeiras. El objetivo general del estudio fue evaluar la eficacia de la lipotransferencia por centrifugación asistida con células madre (LCACM) derivadas del tejido adiposo en los pacientes con envejecimiento facial. Se comparó un GE en el que se efectuó la lipotransferencia por centrifugación asistida con células madre, mientras que en el GC se le realizó lipotransferencia convencional (LC).
La variable primaria estudiada fue la evaluación del resultado final, que se evaluó en Bueno, Regular o Malo y el tiempo de medición fue a los 12 meses de la intervención.
Este estudio, en dependencia de la metodología seguida por los investigadores, se pudo concebir de varias formas, entre ellas la variante sólo con posprueba que se diagrama:
RG1 (LCACM) X 01
RG2 (LC) - 02
En ese caso solo se realizaría a cada paciente la medición (evaluación posquirúrgica a los 12 meses) con la correspondiente comparación entre ellas (01 y 02). La X representa la aplicación del nuevo método de tratamiento.
No obstante se hubiese podido concebir también un diseño con preprueba y posprueba, que se diagramaría de esta forma:
RG1 (LCACM) 01 X 03
RG2 (LC) 02 - 04
Este tipo de diseño implica tres comparaciones: 01 y 02 (entre las prepruebas) para comprobar equivalencia inicial entre los grupos, 01 y 03 (entre preprueba y posprueba) para constatar el cambio atribuido a la nueva terapia en el GE y 03 y 04 (entre las pospruebas) para constatar las posibles diferencias entre los grupos.
Ejemplo 3: Estudio “THERESA-4”.[c]
Se realizó un EC fase III, abierto, multicéntrico nacional, con un control positivo (con mejor terapia médica establecida) y aleatorización centralizada, cuyo objetivo fue determinar la eficacia y la seguridad de la Proctokinasa® en el tratamiento de la crisis hemorroidal. Se desarrolló con tres grupos de tratamiento: Proctokinasa® – SK 200 000 UI – Esquemas A o B (desarrollada por Heber Biotec S.A., La Habana) y Anusol-HC® (desarrollado por Salix Pharmaceuticals, Inc., Morrisville, USA). Los productos se administraron en supositorios: Esquemas A y B con Proctokinasa® (con distintas dosis totales) y Anusol-HC® según posología establecida por el fabricante. Los pacientes cumplieron el tratamiento y fueron evaluados al tercer, quinto y décimo días después de iniciado el tratamiento.
La variable principal fue la respuesta clínica al quinto día de iniciado el tratamiento (total, parcial o no respuesta, según la reducción del tamaño de la lesión hemorroidal, así como la evolución del edema y el dolor anal) y las variables secundarias fueron: la respuesta clínica al tratamiento a las 72 horas y al décimo día, la necesidad de trombectomía, así como la evolución del dolor, el edema y el tamaño de la lesión hemorroidal. Se registraron los eventos adversos durante la ejecución del ensayo.
Este es un ejemplo de EC en paralelo con tres grupos, de series cronológicas múltiples, con preprueba y pospruebas, que puede diagramarse de la siguiente forma:
RG1 (Proctokinasa®) 01 X1 (Esquema A) 04 07 010
RG2 (Proctokinasa®) 02 X2 (Esquema B) 05 08 011
RG3 (Anusol-HC®) 03 - 06 09 012
La medición inicial de las lesiones hemorroidales, que se efectúan en la consulta inicial, se representan con 01-3; las mediciones al tercer, quinto y décimo días después de iniciado el tratamiento se representan como 04-6, 07-9 y 010-12 respectivamente.
Ejemplo 4: Estudio “EPOCIM en hiperplasia prostática”. [d]
Se realizó un EC fase III, multicéntrico nacional, abierto, con dos grupos paralelos, aleatorizado, en pacientes programados para cirugía electiva por hiperplasia benigna de la próstata (HBP), con hemoglobina basal entre 10 y 13 g/dl. El objetivo general fue evaluar la eficacia y seguridad de la eritropoyetina humana recombinante ior® EPOCIM en el paciente quirúrgico electivo en la HBP con respecto al proceder convencional para disminuir las transfusiones de sangre homólogas.
Los pacientes del GE recibieron una dosis semanal de ior® EPOCIM (40 000 UI), por vía subcutánea, los días 21, 14, siete y el día previo a la intervención quirúrgica; además recibieron suplemento oral con una tableta diaria de fumarato ferroso (200 mg), ácido fólico (5 mg) y polivit. Los pacientes del GC recibieron suplemento oral con esquema similar al descrito para el CE.
La variable principal de respuesta evaluada fueron los requerimientos transfusionales; las variables secundarias, relacionadas con la eficacia, fueron el número de requerimientos transfusionales, el estado hematológico (Hemoglobina y Hematocrito) y el estado hemodinámico (frecuencia cardiaca y presión arterial) del paciente.
La evaluación previa de los pacientes se efectuó los días 21, 14, siete y el día anterior a la intervención quirúrgica. Con posterioridad al acto quirúrgico fueron seguidos el día posterior a la intervención y al tercer día (evaluación final).
Este es un ejemplo de EC en paralelo con dos grupos, de series cronológicas con repetición de estímulo, prepruebas y pospruebas, que puede diagramarse también de la siguiente forma:
RG1(ior® EPOCIM + suplemento oral diario) 01 X 03 X 05 X 07 X 09 011
RG2(suplemento oral diario) 02 - 04 - 06 - 08 - 010 012
Las evaluaciones previas al acto quirúrgico se representan 01 y 02 (21 días), 03 y 04 (14 días), 05 y 06 (siete días) y 07 y 08 (el día anterior); las evaluaciones posquirúrgicas se representan 09 y 010 (día posterior) y 011 y 012 (tercer día). Las cuatro aplicaciones de ior® EPOCIM se representan con X.
Ejemplo 5: Estudio “Evaluación de eficacia y seguridad en pacientes con tumores sólidos avanzados tratados con mezcla de interferones alfa 2b recombinante y gamma”.
Se realizó una investigación clínica unicéntrica en el Hospital Provincial Cínico-Quirúrgico “Arnaldo Milián Castro” de la provincia Villa Clara (Cuba) desde enero de 2009 hasta diciembre de 2020 para evaluar supervivencia y seguridad del tratamiento con una mezcla de interferones alfa y gamma en pacientes con tumores sólidos avanzados renales y cerebrales. Consistió en dos estudios cuasi-experimentales en los que los grupos experimentales y de control fueron conformados por casos consecutivos, con controles históricos en ambos. Ambos estudios se diferenciaron en los periodos de reclutamientos de pacientes para los grupos experimentales y de control, así como en el fármaco empleado en los respectivos GC: Interferón alfa (estudio de pacientes con tumores renales) y Nimotuzumab (estudio de pacientes con tumores cerebrales). A continuación sólo se detalla el estudio a pacientes con tumores cerebrales por ser su diseño muy semejante al que involucró a pacientes con tumores renales.
En el estudio de los pacientes con tumores cerebrales en el GE se aplicó tratamiento con la mezcla de interferones y en el GC se aplicó la terapia establecida con el anticuerpo monoclonal Nimotuzumab. Se incluyeron los pacientes en el GE desde octubre de 2011 hasta diciembre de 2012. Para la comparación se utilizó un GC histórico en el que se incluyeron los pacientes desde mayo de 2009 hasta septiembre de 2011. La mezcla de interferones se aplicó dos veces por semana hasta la aparición de algún criterio de exclusión o fallecimiento. Se realizó una fase de inducción durante un mes y posteriormente se mantuvo la terapia con la mitad de la dosis de inducción. El paciente fue evaluado mensualmente.
G1(Mezcla de interferones, 2011-2012) 01 X1 03 X2 05 X2 ... 0n
G2(Nimotuzumab, 2009-2011) 02 - 04 - 06 - ... 0n+1
En este ejemplo, como se puede apreciar, no se coloca en el diagrama la R ya que no hubo aleatorización, X1 representa la dosis total de inducción con la mezcla de interferones y X2 las dosis sucesivas del producto de investigación.
Ejemplo 6: Estudio clínico ABDALA.[e]
Se realizó un EC fases I-II, monocéntrico nacional en el Hospital Provincial Saturnino Lora, factorial con seis grupos con grupo placebo y aleatorizado. El objetivo general fue evaluar la seguridad e inmunogenicidad de la administración intramuscular del candidato vacunal CIGB-66 en la prevención de la infección por SARS-CoV-2. Fue diseñado para la aplicación de dos concentraciones distintas del producto de investigación (25 y 50 mcg) y dos esquemas de aplicación uno corto (0, 14 y 28 días) y otro largo (0, 28 y 56). Se concibieron dos grupos placebo (uno para cada esquema de inmunización). En todos los casos se aplicaron 0,5 ml del candidato vacunal o el placebo por vía intramuscular en la región deltoidea.
El EC tuvo dos variables primarias: 1.- seguridad y 2.- seroconversión (proporción de sujetos con seroconversión de anticuerpos IgG anti-RBD del SARS-CoV-2).
La primera se midió antes de la administración de cada dosis del producto de investigación, en la primera hora siguiente a la inoculación del producto (en cada dosis), a las 24, 48 y 72 horas, y al séptimo día.
La segunda se midió en los días 28 y 42 (para el esquema corto 0-14-28) y 28, 56 y 70 (para el esquema largo 0-28-56), con respecto a la medición basal.
El diagrama se representa en el cuadro 4. Como se puede apreciar los números colocados en los subín-dices representan los niveles de manipulación (dosis 1 y dosis 2) de las VI y cada combinación de A y B implica la correspondencia de un GE. En el mismo cuadro se representa la aplicación del diagrama en el estudio por grupos para la variable “seguridad” en relación con los esquemas corto o largo.
Como se puede apreciar los números colocados en los subíndices representan los niveles de manipulación (dosis 1 y dosis 2) de las VI y cada combinación de A y B implica la correspondencia de un GE. A continuación se diagrama el estudio por grupos para la variable “seguridad”:
Esquema corto (0-14-28 días)
RG1(CIGB-66, RBD 25 mcg) 01 X1 04 07 010 013 016 01 X1 04 07 010 013 016 01 X1 04 07 010 013 016
RG2(CIGB-66, RBD 50 mcg) 02 X2 05 08 011 014 017 02 X2 05 08 011 014 017 02 X2 05 08 011 014 017
RG3(Placebo) 03 - 06 09 012 015 018 03 - 06 09 012 015 018 03 - 06 09 012 015 018
Esquema largo (0-28-56 días)
RG4(CIGB-66, RBD 25 mcg) 01 X1 04 07 010 013 016 01 X1 04 07 010 013 016 01 X1 04 07 010 013 016
RG5(CIGB-66, RBD 50 mcg) 02 X2 05 08 011 014 017 02 X2 05 08 011 014 017 02 X2 05 08 011 014 017
RG6(Placebo) 03 - 06 09 012 015 018 03 - 06 09 012 015 018 03 - 06 09 012 015 018
Como se puede apreciar se representan las 18 mediciones efectuadas a cada paciente; también fueron 18 las mediciones por cada dosis para los tres grupos del esquema correspondiente. Las mediciones anteriores a la administración de cada dosis se representan 01-3, las de la primera hora siguiente a la inoculación del producto 04-6, a las 24 horas 07-9, a las 48 horas 010-12, a las 72 horas 013-15 y al séptimo día 016-18. Optamos por representar las mediciones 01-18 por dosis y esquema para facilitar la comprensión.
La representación anterior sólo es válida para la variable “seguridad” por lo que a continuación se diagrama el estudio por grupos para la variable “seroconversión”:
Esquema corto (0-14-28 días)
RG1(CIGB-66, RBD 25 mcg) 01 X1 X1 04 X1 07
RG2(CIGB-66, RBD 50 mcg) 02 X2 X2 05 X2 08
RG3(Placebo) 03 - - 06 - 09
Esquema largo (0-28-56 días)
RG4(CIGB-66, RBD 25 mcg) 01 X1 04 X1 07 X1 010
RG5(CIGB-66, RBD 50 mcg) 02 X2 05 X2 08 X2 011
RG6(Placebo) 03 - 06 - 09 - 012
Como se puede apreciar se representan las tres mediciones efectuadas a cada paciente en el esquema corto y las cuatro del esquema largo. Las mediciones basales anteriores a la administración de la primera dosis se representan de 01-3, en los seis grupos. En el esquema corto a continuación se representan las dos primeras administraciones del producto de investigación o el placebo (días 0 y 14), luego las mediciones 04-6 (día 28), seguido de la última dosis de producto de administración o placebo (día 28) y finalmente las mediciones finales 07-9 (día 42).
En el esquema largo, después de las mediciones basales, se aplica la primera dosis (día 0), luego se realizan las mediciones 04-6 (día 28), se administra segunda dosis (día 28), después se realizan mediciones 07-9 (día 56), se administra la dosis final (día 56) y para culminar se realiza la última medición 04-6 (día 70).
[a] Registro Público Cubano de Ensayos Clínicos [página en internet]. La Habana: CENCEC - MINSAP; c2014 [citado 2021 Ago 13]. Efecto y seguridad del Dermofural® 0.15 % ungüento en el tratamiento antibacteriano de pacientes con infección leve en úlceras del pie diabético; [aprox. 2 pantallas]. Disponible en: https://rpcec.sld.cu/ensayos/RPCEC00000211-Sp
[b] Registro Público Cubano de Ensayos Clínicos [página en internet]. La Habana: CENCEC - MINSAP; c2014 [citado 2021 Ago 13]. Eficacia de la lipotransferencia por centrifugación asistida con células madre derivadas del tejido adiposo en el rejuvenecimiento facial; [aprox. 2 pantallas]. Disponible en: https://rpcec.sld.cu/ensayos/RPCEC00000362-Sp
[c] Registro Público Cubano de Ensayos Clínicos [página en internet]. La Habana: CENCEC - MINSAP; c2014 [citado 2021 Ago 13]. Supositorios de Estreptoquinasa recombinante y de Anusol-HC en el tratamiento de la fluxión y la trombosis hemorroidal; [aprox. 2 pantallas]. Disponible en: https://rpcec.sld.cu/ensayos/RPCEC00000122-Sp
[d] Registro Público Cubano de Ensayos Clínicos [página en internet]. La Habana: CENCEC - MINSAP; c2014 [citado 2021 Ago 13]. Eficacia y seguridad del ior EPOCIM en la disminución de requerimientos transfusionales en pacientes quirúrgicos electivos con Hiperplasia prostática benigna; [aprox. 2 pantallas]. Disponible en: https://rpcec.sld.cu/ensayos/RPCEC00000092-Sp
[e] Registro Público Cubano de Ensayos Clínicos [página en internet]. La Habana: CENCEC - MINSAP; c2014 [citado 2021 Ago 13]. Evaluación de la seguridad e inmunogenicidad del candidato vacunal CIGB-66 contra SARS-CoV-2. (COVID-19); [aprox. 2 pantallas]. Disponible en: https://rpcec.sld.cu/ensayos/RPCEC00000346-Sp
* Receptor Binding Domain (RBD) o dominio de unión al receptor es la estructura proteica por la cual los coronavirus se unen a los receptores de la célula hospedera en el organismo para infectarla. La vacuna Abdala se encuentra formulada a partir de la proteína RBD, producida de manera recombinante en células de levadura Pichia pastoris, con hidróxido de aluminio como adyuvante.
CONCLUSIONES
El conocimiento sobre los diseños experimentales (que incluye la forma de diagramarlos) es muy importante para el diseño y ejecución de EC. Los EC son un tipo particular de experimento mediante el cual se investiga en humanos, estos presentan alta complejidad y en ellos pueden aplicarse más de un diseño en un mismo estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Contribuciones de los autores
Conceptualización: Javier Cruz Rodríguez, María Margarita Ríos Cabrera.
Visualización: Javier Cruz Rodríguez, María Margarita Ríos Cabrera.
Revisión, redacción y edición: Javier Cruz Rodríguez, María Margarita Ríos Cabrera.
Financiación
Hospital Provincial Clínico-Quirúrgico Arnaldo Milián Castro. Santa Clara. Cuba.