INTRODUCCIÓN
Los tumores benignos del esófago son poco frecuentes; constituyen menos del 1 % de las neoplasias de este órgano. De ellos, el leiomioma es el más común, y representa más del 90 %, mientras que el resto son pólipos y quistes.(1)
La localización más frecuente de los leiomiomas es la porción media y distal del esófago, con predominio en esta última región.(2) Otra de sus características es ser tumores únicos, no obstante, pueden ser múltiples en 5 % de los pacientes.(3)
Los síntomas, por lo general, transcurren durante largo tiempo, no son específicos ni se relacionan con el tamaño del tumor; muchos son asintomáticos. Cuando aparecen, se manifiestan como disfagia, acidez, regurgitación, dolor retroesternal y pérdida de peso.(3)
Los leiomiomas gigantes -mayores de 10 cm- pueden producir obstrucción del esófago, disfunción del cardias, e incluso, síntomas respiratorios por compresión de vías aereas.(3,4)
La baja incidencia de leiomiomas gigantes de esófago hace de su manejo un reto. El desarrollo de procederes diagnósticos que permiten su identificación y diferenciación, y la variedad de técnicas quirúrgicas, constituyen motivo de estudio para diversos autores.(5-9)
Compartir y divulgar un nuevo reporte de esta inusual pero compleja entidad es el propósito de este trabajo, basado en un caso de leiomioma gigante operado con evolución satisfactoria.
PRESENTACIÓN DE CASO
Se presenta el caso de un paciente de 60 años de edad, admitido en el Servicio de Cirugía del Hospital Clínico Quirúrgico Gral. Freyre de Andrade, de La Habana, por presentar en los últimos cinco meses historia de disfagia y dificultad respiratoria al realizar actividad física de moderada intensidad. El paciente refirió pérdida de peso de 3 kg en ese tiempo. No refirió comorbilidad previa. Negó tener hábitos tóxicos y alergias. No había recibido transfusión sanguínea. El examen físico no aportó ningún dato de interés.
Pruebas realizadas al ingreso:
Hemoglobina (Hb) 11 g/dl; Glucemia 5 mmol/L; Creatinina sérica 1,2 mg/dL; Proteínas totales 7 g/dL; Albúmina sérica 3,8 g/dL
Coagulograma completo: Tiempo de coagulación 7,5 min; tiempo de sangrado 2,0 min; coágulo retráctil; conteo de plaquetas 200x109 /L; Grupo sanguíneo 0 Factor RH (negativo)
Electrocardiograma: Ritmo sinusal
Pruebas funcionales respiratorias: Volumen espiratorio forzado en un segundo (FEV1) 85 %; Capacidad vital (CV) 5L; Volumen de reserva espiratoria (VRE) 1,4 L; Relación volumen espiratorio forzado/capacidad vital [FEV1/ CVF] 90 %.
Conclusión: Tolera toracotomía.
Hemogasometría arterial e ionograma: pH 7,35 EB 1,5 mmol/L SB 22 mmol/L; HBO2 97 % pCO2 35 mm Hg Pa O2 97 mm Hg; Na 135 mEq/L Cl 98 mEq/L K 3,3 mEq/L
Procederes diagnósticos específicos:
Radiografía de tórax simple antero-posterior. No se identificaron alteraciones pleuropulmonares ni mediastinales.
Esofago-gastro-duodenoscopia superior (EGD). Reveló una protuberancia de proyección posterior entre los 25 y 30 cm de la arcada dental, con conservación de la mucosa esofágica, delgada y discretamente hiperémica.
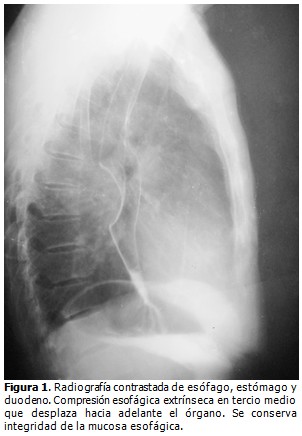
Radiografía de esófago, estómago y duodeno (EED). Mostró, por encima del tercio medio del esófago, ligera distensión; por debajo de la cual se constató defecto de lleno cóncavo con superficie mucosa lisa que impresionaba compresión de la luz esofágica extrínseca o tumor submucoso del tercio medio del esófago de posible etiología benigna. (Figura 1).
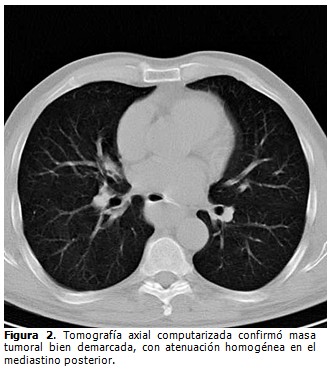
Tomografía axial computarizada (TAC). Mostró una opacidad de tejido blando bien circunscrita, de densidad homogénea, localizada en el tercio medio del esófago torácico. (Figura 2).
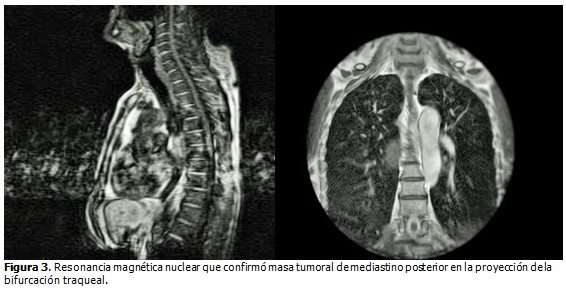
Resonancia magnética nuclear (RMN). Se realizó corte sagital y coronal que proporcionó mejor definición de los tejidos blandos, y aportó información acerca del nivel de la lesión, su relación con órganos vecinos y la no existencia de metástasis. (Figura 3).
Acto quirúrgico
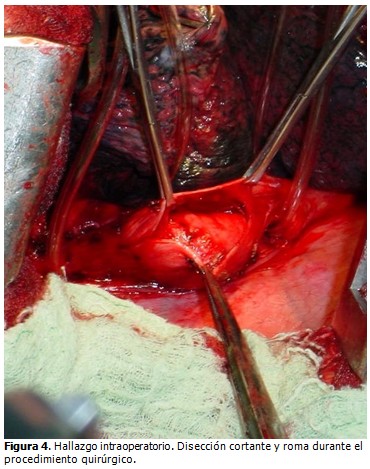
Se colocaron vendas elásticas en las extremidades inferiores, antibióticos y heparina a dosis profiláctica. Se aplicó anestesia general endotraqueal; se utilizó tubo de doble luz. Con el paciente en decúbito lateral izquierdo, se realizó incisión de toracotomía posterolateral, de aproximadamente 20 cm, a nivel del sexto espacio intercostal derecho. Se revisó cavidad torácica, sin encontrar adenopatías mediastinales; y se procedió a liberar ligamento triangular del pulmón; se abrió la pleura mediastínica encima de la masa mediastinal posterior, que se corresponde con un tejido elástico de consistencia firme, de bordes bien definidos, multilobulado en la pared posterior y lateral del esófago; se cargó el esófago con sondas torácicas por encima y por debajo del tumor. (Figura 4).
Se realizó apertura de la capa muscular y se comenzó la enucleación del tumor encapsulado con disección roma y cortante. Posteriormente, para verificar la integridad de la mucosa esofágica, fue retirada la sonda de Levine hasta el esófago, y se insufló aire con la cavidad torácica llena de solución salina; después de comprobar la ausencia de daños en la mucosa, se suturó la capa muscular con puntos de colchonero con material absorbible a mediano plazo.
Se colocaron sondas de drenaje por contra abertura a nivel del noveno espacio intercostal línea axilar posterior y séptimo espacio; se reexpandió el pulmón antes del cierre de la cavidad torácica. Las pérdidas hemáticas fueron aproximadamente de de 60 mL.
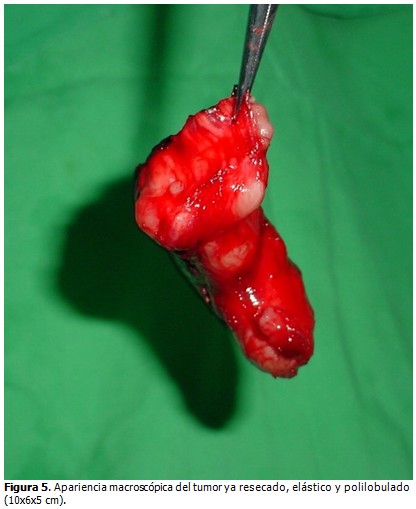
Después de resecado el tumor (Figura 5) se envía a Anatomía Patológica que informa un tumor de 10 x 6 x 5 cm y en cortes de congelación, no encuentran evidencias de malignidad. Cierre de la cavidad torácica.
El curso posoperatorio durante las primeras 72 h transcurrió sin eventos significativos, en la Unidad de Cuidados Intensivos. Se restableció la vía oral a las 24 h, con líquidos; y en los días siguientes, con sólidos. Requirió de algunos analgésicos, pero pudo deambular entre el segundo y tercer días. Las sondas torácicas se retiraron al cuarto día. El egreso aconteció al octavo día del posoperatorio, con remisión de los síntomas. El informe final de anatomía patológica fue leiomioma esofágico.
DISCUSIÓN
La edad promedio de incidencia del leiomioma esofágico es aproximadamente entre los 40 y 60 años con un ligero predominio en el sexo masculino;(10) datos que se corresponden con las características del paciente presentado.
El diagnóstico de certeza de leiomioma esofágico no se realiza en la mayor parte de los enfermos a su llegada. Se puede presentar con síntomas vagos en un paciente con una masa mediastinal, en una radiografía de tórax, como un hallazgo incidental.(11)
El diagnóstico diferencial incluye compresión por enfermedad extrínseca al esófago, tumor maligno esofágico como carcinoma escamoso, leiomiosarcoma, tumores del estroma gastrointestinal (infrecuente en esófago) y otros de naturaleza benigna.(3,5,11)
Hay una gama de posibles procederes diagnósticos de imágenes (área de rápido desarrollo en la medicina) y endoscópicos, que se adicionan al cuadro clínico, para definir la etiología de la lesión. En este paciente se precisó de una imagen radiológica simple de tórax y una serie de EED para iniciar el estudio.
La serie de EED es una prueba no invasiva de alta sensibilidad, no obstante, no se puede dejar de pensar en el diagnóstico diferencial con el carcinoma esofágico, 50 veces más frecuente que el leiomioma.(12)
Su estudio también incluyó la TAC contrastada y la RMN, útiles en la búsqueda de lesiones mediastinales; mientras que la TAC en tercera dimensión con esofagografía contrastada y la tomografía por emisión de positrones (TEP) son también herramientas útiles, que se realizan en centros de alto nivel.(12)
La TAC permite identificar posibles metástasis en tumores malignos, diseminación de tumor a otros tejidos, fistulas broncoesofágicas, pleuroesofágicas y aortoesofágicas, así como compresión externa por adenopatías, entre otras alteraciones.(12)
Los leiomiomas gigantes se identifican en la TAC como una masa con crecimiento extraluminal, homogénea y circunscrita, que ocasionalmente presenta calcificaciones, lo cual es muy raro en otras lesiones esofágicas submucosas. La RMN proporciona mejor definición de los tejidos blandos y resolución espacial que la TAC.(12) Ambas proporcionaron información de interés acerca de las características de un tumor que ocupaba mediastino posterior en el caso en estudio.
La TEP es una técnica tridimensional de diagnóstico por imagen, con la ventaja de dar información adicional sobre el tumor, su progresión y las metástasis; resulta útil fundamentalmente en el estudio y evaluación de lesiones malignas.(13)
Con relación a las pruebas de imágenes, se considera acertado el criterio de Vasylkivskyi VV y colaboradores, cuando plantean que no hay signos específicos para el diagnóstico de leiomioma, sino que es la utilización de varias pruebas en conjunto lo que supera la predicción en este.(14)
La EGD mostró características de una lesión submucosa. Esta prueba permite, además, identificar la presencia de más de un leiomioma. De 39 pacientes con leiomioma, en 11 de ellos Yun-Xi y colaboradores lograron identificar, aparte de la lesión submucosa, estenosis del esófago.(15)
La ecografía esofágica intraluminal (EEI) es útil e indispensable en tumores pequeños. No solo muestra la lesión dentro de la pared esofágica, tamaño, localización (plano de muscularis mucosae o muscular propria), sino sus relaciones con los órganos vecinos, lo que es de gran valor clínico para determinar el tratamiento óptimo, dependiendo de estas características. Hay consenso de que es la prueba más exacta para diagnosticar leiomioma esofágico.(8,15,16)
Esta prueba también proporciona información sobre las características ultrasonográficas que orientan al diagnóstico diferencial de leiomioma esofágico.(16,17) En un interesante estudio Codipilly y colaboradores identificaron que el EEI resultó una prueba de elevada certeza diagnóstica, con un valor predictivo positivo de 68 % y un valor predictivo negativo de 100 % para leiomioma o tumor estromal, comparado con la biopsia operatoria.(5)
En este paciente no se realizó biopsia preoperatoria. Esta constituye un tema de debate en el leiomioma esofágico, pues se plantea que puede provocar una fuga esofágica o fístula a órganos contiguos con riesgo potencial de mediastinitis. Se considera, además, que durante la cirugía se pueden producir daños en la mucosa, por adherencias entre la superficie de punción y el tumor subyacente.(18)
Algunos afirman que la aspiración con aguja fina no proporciona suficiente material para establecer un diagnóstico histopatológico preciso. El alto riesgo de complicaciones, como hemorragia y hematoma en contraposición al beneficio para el paciente con leiomioma esofágico, hace que no sea recomendable llevar a cabo este procedimiento diagnóstico.(7)
El leiomioma gigante debe ser extirpado una vez diagnosticado. Las opciones de cirugía abierta comprenden: toracotomía, laparotomía o combinación de ambas para conseguir su enucleación o resección esofágica con interposición de intestino delgado o colon, cuando no es posible preservar el esófago.(15)
Después de realizada la enucleación del tumor gigante –propósito principal de la cirugía-, se debe cerrar el plano muscular para prevenir hernia de la mucosa y preservar la actividad propulsora. En los casos asociados a atrofia de la capa muscular, se debe reparar con un colgajo de pleura, omento o pericardio. Otro detalle técnico interesante es asociar a la enucleación un proceder anti-reflujo en los leiomiomas del tercio inferior del esófago.(10)
En el transcurso de la cirugía, el grupo quirúrgico tiene que realizar biopsia transoperatoria, por la probabilidad de encontrar focos de malignización en el interior del tumor, que hagan modificar el plan inicial.(9,10)
Desde finales de los años noventa del pasado siglo, se vienen implementando procedimientos, con entusiasmo progresivo, de rápido desarrollo, como la toracotomía video-asistida (TVA). Resulta un cambio de paradigma, pero plantea aspectos no resueltos, como la propia dimensión del tumor a enuclear y las dificultades que enfrenta el cirujano para identificar un plano de clivaje entre el tumor y la submucosa esofágica.(4,8,20)
Del mismo modo, la cirugía robótica video-asistida (CRVA) –todavía pendiente de mayor evidencia- plantea sus cultores, que supera a la TVA, pues con esta los ángulos y las dimensiones de los espacios intercostales limitan el movimiento, sutura y disección, mientras que con la CRVA se sobrepasan estas limitaciones. La CRVA mantiene los beneficios de la TVA sin comprometer las ventajas de la cirugía abierta, como habilidad, precisión y destreza.(21,22)
Los procederes endoscópicos intraluminales –que desbordan los límites de este trabajo- se desarrollan de modo progresivo. Aun tienen aspectos no resueltos; como la imposibilidad de resecar tumores grandes, la incidencia de complicaciones relacionadas con la disección endoscópica y el bajo grado de resección en bloque.(5,6)
El leiomioma esofágico gigante, entidad poco frecuente, se diagnostica mediante la sospecha clínica y el apoyo de estudios de imágenes y endoscópicos de alta tecnología. La cirugía es perentoria, la toracotomía abierta con biopsia transoperatoria y resección adecuada a las particularidades del tumor, son procederes efectivos para su manejo.
Conflicto de intereses: Ninguno.
Contribución de autores: Idea conceptual: Tomas Ariel Lombardo Vaillant; revisión bibliográfica: Leopoldo de Quesada Suárez; escritura del artículo: Tomas Ariel Lombardo Vaillant, Leopoldo de Quesada Suárez; revisión crítica del artículo: Tomas Ariel Lombardo Vaillant, Leopoldo de Quesada Suárez.
Financiamiento: Hospital Clínico Quirúrgico Gral. Freyre Andrade.