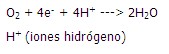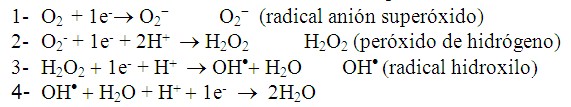INTRODUCCIÓN
El envejecimiento es un proceso biológico, irreversible, deletéreo, progresivo, intrínseco y universal que con el tiempo ocurre en todo ser vivo a consecuencia de la interacción de la genética del individuo y su medio ambiente. Podría también definirse como todas las alteraciones que se producen en un organismo con el paso del tiempo y que conducen a pérdidas funcionales y a la muerte.1
Las principales causas de morbimortalidad geriátrica son las enfermedades crónicas degenerativas tales como las enfermedades cardiovasculares, el cáncer, la diabetes mellitus y sus complicaciones. Es importante destacar también las afecciones demenciales y particularmente la enfermedad de Alzheimer, las afecciones osteoarticulares y el deterioro sensorial, auditivo y visual. El deterioro cerebral afecta hasta al 10 % de los mayores de 60 años y para el cual no existe forma alguna de prevención.2
El envejecimiento de la población fue uno de los fenómenos más marcados en el siglo XX. Según cálculos demográficos mundiales de las Naciones Unidas en el año 1950 habían alrededor de 200 000 000 de personas de 60 años y más, que aumentaron en el año 1975 a 350 000 000. Actualmente esta cifra va en ascenso debido, entre otros factores, a la disminución de las tasas de natalidad y de mortalidad infantil, la mejoría en la atención sanitaria, el control de enfermedades infecto-transmisibles y el aumento en la expectativa de vida.3,4 Se estima que en 2030 el 16,6 por ciento de la población mundial esté envejecida y en 2050, esta cifra podría ascender a 21,4 por ciento. En otras palabras, mientras que en 2000 una de cada diez personas en el mundo era un adulto mayor, a mitad de siglo será una de cada cinco. La tasa anual de crecimiento de este grupo en la actualidad es de 2,2 %, y llegará a ser hasta de 3 % en la segunda década del siglo XXI. Dentro de este panorama resaltan las nacionalidades de Japón y China.5
En el 2000, la población de América Latina y el Caribe de 60 años y más, era de 43 millones de personas, cifra que irá en aumento hacia el año 2025, cuando las personas de edad alcancen los 101,1 millones, que representa el 15,1 % de la población total de la región. Llegado el año 2050 se estima un porcentaje de 25.5, o sea, una de cada cuatro personas tendrá una edad superior a los 60 años. Cuba, Uruguay y Chile destacan entre los países más envejecidos.6-8
El envejecimiento en Cuba constituye el principal problema demográfico, con cifras que alcanzan 18,3 % de la población con 60 años y más; se espera que para el 2025 este grupo alcance más del 25 % de la población total, por lo que Cuba es uno de los países más envejecidos de América Latina. Hoy existen en nuestro país cerca de 2 millones de personas de 60 años y más, para el 2030 serán 3,3 millones. Todas las provincias del país, excepto Guantánamo (13,4 %) y el municipio especial de la Isla de la Juventud (14, 4 %) que están en el segundo grupo, pertenecen al tercer grupo con valores por encima del 15 % de la población envejecida respecto al total, incluyendo la provincia de Cienfuegos.9
Pero, ¿cuál es la causa fundamental del envejecimiento? Durante el transcurso del pasado siglo se ha propuesto un gran número de teorías para explicar la naturaleza del envejecimiento. Estas se pueden agrupar en dos grandes vertientes: las teorías estocásticas que cuentan con la acumulación fortuita de acontecimientos perjudiciales debido a la exposición a factores exógenos adversos y las teorías deterministas que engloban aquellos fenómenos que se describen mediante un número limitado de variables conocidas. Dentro del primer grupo tenemos las teorías genéticas, teoría de los radicales libres (1956), teoría de mutación somática (Szilard, 1959), teoría error-catástrofe (Orgel, 1963 y modificada 1970), teoría de la acumulación de productos de desecho (Sheldrake, 1974), teoría de la unión cruzada de estructuras celulares (Brownlee, 1991), teoría inmunológica. Integrando las teorías deterministas están la teoría de la capacidad replicativa finita de las células (Hayflick y Moorhead, 1961), hipótesis de los genes determinantes de la longevidad (Cutler, 1975) y las teorías evolutivas. Otras teorías clásicas del envejecimiento fueron las de Minot en 1907 que preconizaba que era el precio pagado por la diferenciación celular; Pearl en 1928 proclamaba que el envejecimiento es un «efecto secundario» del metabolismo y Gerschman en 1962, lo consideraba como efecto de la toxicidad del oxígeno, por insuficiencia de las defensas antioxidantes.10,11
En la actualidad, se acepta generalmente que el envejecimiento está ligado a la desorganización celular por el estrés oxidativo causado por los radicales libres (RL) y otras especies reactivas de oxígeno (ERO), de acuerdo con las teorías publicadas independientemente por Harman y Gerschman en la década del 50 del siglo XX, cuyo dogma central radica en analizar cómo, durante el metabolismo aerobio, se producen de forma incidental e incontrolable especies radicálicas derivadas del oxígeno, las macromoléculas se dañan irreversiblemente, daño que se acumula en el tiempo, y esto resulta en una pérdida gradual de los mecanismos homeostáticos, interferencia de patrones de expresión génica y pérdida de la capacidad funcional de la célula conduciendo al envejecimiento de la misma y su muerte; además del papel clave del genoma de las mitocondrias de las células diferenciadas como principal diana de las ERO, según la teoría del estrés oxidativo/lesión mitocondrial.12
La relación que existe entre la concentración de RL y el estado de salud de los seres humanos es un hecho aceptado en la actualidad por la comunidad científico-médica, razón que nos conduce a la formulación de la siguiente interrogante científica: ¿Cuál es el papel del estrés oxidativo sobre el envejecimiento celular?
La creciente avalancha informativa desde los inicios de los primeros estudios hasta ahora, plasmado en las diferentes bases de datos biomédicas, 85 467 artículos de estrés oxidativo entre los años 2009 y 2016 en Pubmed/ Medline, por citar un ejemplo; el interés cada vez más creciente de la comunidad científica sobre el tema y el uso, cada vez más frecuente, de vocablos como estrés oxidativo, radicales libres, actividad proxidante, producto antioxidante, entre otros, justifican el presente trabajo, que pretende responder la interrogante antes planteada, el mismo contempla como objetivos mencionar las fuentes fundamentales de generación de radicales libres en los organismos superiores, explicar la intervención de las especies reactivas del oxígeno en el envejecimiento de las colonias celulares, así como argumentar acerca de la terapia antioxidante para mejorar la calidad de vida de la población.
DESARROLLO
La teoría del estrés oxidativo (EO) es una de las hipótesis que intenta explicar los cambios degenerativos y la pérdida neuronal que ocurren durante la senescencia. Considera que el envejecimiento y el desarrollo no son fases distintas de la vida, sino más bien que el envejecimiento es la etapa final del desarrollo y que aun cuando no es un fenómeno genéticamente programado ocurre por la influencia del EO en el programa genético.13
La esencia de esta teoría radica en que las células aeróbicas, al captar la molécula oxígeno (O2) imprescindible para la viabilidad celular por su papel como aceptor final de la cadena transportadora de electrones (CTE) en la respiración mitocondrial, producen una reducción parcial de este oxígeno y además de originar agua (H2O) como producto final, se generan RL y ERO. Un exceso de RL rompe el equilibrio celular dando lugar al inicio de una serie de reacciones químicas que pueden conducir a la aparición de graves desórdenes fisiológicos y la agudización de la enfermedad o incluso alterar el desempeño físico o psíquico de una persona supuestamente sana. No obstante, ciertos autores consideran que esto ocurre exactamente al revés; es decir, que el EO conduce a la aparición de la enfermedad y es la causa de las alteraciones que se observan después en sistemas biológicos.14,15
En opinión de los autores de la revisión, para la mejor comprensión de las reacciones que originan estos RL dentro de las células y en especial en la mitocondria, es necesario la conceptualización de algunos términos. En bioquímica se considera oxidación a todo proceso en el que ocurre pérdida de electrones (e-), captación de oxígeno o una cesión de hidrógeno (deshidrogenación) y reducción a aquel otro en el cual se captan electrones o se pierden oxígenos. Todo proceso de oxidación va siempre acompañado de otro de reducción. Son reacción de óxido-reducción o reacciones redox entre pares conjugados.
El proceso de reducción desde el punto de vista clásico podría resumirse en la siguiente reacción: (Figura 1).
Esta reacción global es la que se produce por acción del complejo citocromo-oxidasa o IV (citocromo a + a3) de la CTE en la membrana interna mitocondrial, donde el O2 el aceptor final de los electrones, se reduce a agua como demuestra la ecuación de la reacción; esta vía es la que utiliza la mayor parte del oxígeno del organismo humano, con el objetivo de producir un gradiente electroquímico de iones H+ que atravesará posteriormente la membrana interna mitocondrial por el complejo V o ATP sintetasa generando la energía necesaria para la síntesis de adenosina trifosfato o ATP.16
Ahora bien, desde el punto de vista químico, el O2 es fundamentalmente birradical, ya que tiene 2 electrones no apareados en su orbital externo, ambos con el mismo giro paralelo, impidiendo que capte 2 electrones simultáneamente en las reacciones que interviene, esto traduce que el oxígeno solo puede intervenir en reacciones univalente y aceptar los electrones de uno en uno. Por lo tanto la reacción antes escrita ocurrirá en cuatro pasos univalentes: (Figura 2).
Como se puede observar cada reacción capta 1e- y cuando realizamos la sumatoria de las cuatro ecuaciones obtenemos la reacción global descrita anteriormente. Estos intermediarios señalados (O2-,H2O,OH·) quedan unidos al sitio activo de la citocromo-oxidasa y no difunden al resto de la célula en condiciones normales. En sí la reacción global no produce daño celular en el organismo pues su producto final son dos moléculas de agua; sin embargo, estos RL producidos son altamente nocivos.15
Los autores de esta revisión consideran necesario aclarar otros conceptos para conocer la dinámica de estos RL y cómo actúan sobre las distintas biomoléculas del organismo. Los átomos, primer nivel de organización de la materia, se encuentran formados por un núcleo de protones y neutrones, y alrededor de este la nube electrónica formada por orbitales perfectamente ubicados (s, p, d, f). Cada orbital contiene un máximo de dos electrones que se hallan apareados, es decir, tienen espines opuestos, otorgando gran estabilidad desde el punto de vista químico. La mayoría de las sustancias presentes en el organismo contienen solo electrones apareados y suelen ser, por tanto, químicamente estables. Sin embargo los radicales libres son especies químicas que contienen electrones desapareados en su orbital más externo. Estos electrones desapareados les confieren una enorme reactividad química que los conducirá a interactuar rápidamente con otras moléculas produciendo cambios en la composición química o en la estructura de los elementos celulares que los hace incompatibles con la vida, además son altamente inestables y de vida efímera.17
Por consiguiente estos RL pueden reaccionar con las especies químicas estables que conforman la anatomía celular. El RL puede, en este caso, cederle su electrón desapareado, tomar uno de esta molécula para aparear su electrón (oxidándola), o unirse a ella. En cualquiera de los tres casos la situación resultante es la génesis de otro radical químicamente agresivo.18
Entre los ERO inorgánicas debemos destacar al radical anión superóxido, al radical hidroxilo, al peróxido de hidrógeno (el cual no es estrictamente un RL pero su capacidad para generar radicales hidroxilo en presencia de metales como el hierro, se le incorpora como tal) y el oxígeno singlete o molecular (O2·) y los RL orgánicos el radical peroxilo (ROO-), el hidro-peróxido orgánico (ROOH) y los lípidos peroxidados. Otros de los radicales que resulta una especie muy tóxica son el peroxinitrito (ONOO) y el ácido hipocloroso (HOCL).19, 20
La fuente biológica fundamental de estos RL, como ya se ha descrito, es la mitocondria, como consecuencia directa del proceso de respiración celular; alrededor del 5 % del oxígeno que consumimos siguen la vía univalente originando metabolitos intermediarios parcialmente reducidos o con diferente grado de oxidación los cuales constituyen RL, por tanto el metabolismo normal que ocurre en la célula es fuente de estas especies nocivas.21, 22
La segunda fuente de radicales libres es también endógena y está constituida por el metabolismo de los fagocitos (neutrófilos y macrófagos). Estos están dotados de diversas enzimas líticas (proteasas, lipasas, nucleasas), así como de vías metabólicas (mieloperoxidasa en el caso de neutrófilos) que generan diversas especies químicas agresivas como O2-, H2O2, OH·.(21) Los leucocitos poseen en sus membranas la enzima NADPH oxidasa generadora de O2, el cual en presencia de hierro se transforma en el altamente tóxico OH·. Esta situación se da particularmente en los procesos inflamatorios.22 La xantina oxidasa (enzima responsable de la conversión de hipoxantina en ácido úrico) también genera radicales libres, específicamente aniones superóxido. Otras fuentes son los peroxisomas, organelos del citosol muy ricos en enzimas oxidasas y que generan H2O2, el cual es depurado por enzimas específicas (catalasas) y transformado en agua.23,24
Los oxidantes pueden proceder del exterior, ya sea directamente o como consecuencia del metabolismo de ciertas sustancias. De las fuentes exógenas de radicales libres, el tabaquismo es una de las más importantes. El humo del tabaco es una mezcla de sustancias entre las cuales destacan los óxidos de nitrógeno y de azufre. Otros componentes del humo del tabaco pueden interaccionar con el citocromo P450 y con el catabolismo del ácido araquidónico y de las flavonas. El ozono (O3) es una ERO dotada de un extraordinario poder oxidante. Puede proceder de la acción fotoquímica de las radiaciones electromagnéticas sobre el oxígeno, de los campos eléctricos o de la combustión de los carburantes. Su toxicidad se manifiesta tras exposiciones de pocas horas a concentración de tan solo 3 o 4 partes por millón (ppm). El O3 puede oxidar grupos (-SH, -NH2, –OH y –COH), y en los fosfolípidos de las membranas celulares induce la peroxidación lipídica. Asimismo una concentración de O2 demasiado elevada puede generar también una sobrecarga de ERO. Así, cuando esta concentración en el aire inspirado sobrepasa el 30-40 %, las defensas antioxidantes comienzan a fracasar. Una concentración del 100 % es altamente tóxica y solo se suele resistir, sin que aparezcan lesiones, durante unos pocos minutos.25
La evidencia funcional de que el daño producido por las ERO tiene relación con el envejecimiento viene dado por su mecanismo de acción, el cual puede conducir a un estrés oxidativo crónico. Las sustancias oxidantes pueden actuar sobre cualquier molécula, aunque algunas parecen ser más susceptibles que otras a la acción de los antioxidantes. Especialmente sensibles resultan los carbohidratos, ácidos nucleicos, las proteínas y los fosfolípidos presentes en todas las membranas celulares, incluyendo sus posibles derivados. La interacción de los oxidantes con estas moléculas producirá en ellas una modificación estructural, que se traducirá en una alteración funcional. 26
Estos daños provocados serán descritos a continuación:
- La alta inestabilidad atómica de los RL provoca su colisión con otras biomoléculas a las cuales le sustraen un electrón, oxidándola, perdiendo de esta manera su función específica en la célula. Si se trata de los lípidos (ácidos grasos polinsaturados), se dañan las estructuras ricas en ellas como las membranas celulares y las lipoproteínas. En las primeras se altera la permeabilidad conduciendo al edema y la muerte celular y en la segunda, la oxidación de las lipoproteínas de baja densidad (LDL) y conduce a la génesis de la placa ateromatosa. Esta oxidación lipídica consta de reacciones en cadena que al oxidar un ácido graso lo convierte en un radical de ácido graso con capacidad de oxidar otra molécula vecina. Este proceso es conocido como perioxidación lipídica, genera numerosos subproductos, muchos de ellos como el malondialdehído (MDA), cuya determinación en tejidos, plasma u orina es uno de los métodos de evaluar el estrés oxidativo.27
- De las proteínas se oxidan preferentemente los aminoácidos (fenilalanina, tirosina, triptófano, histidina y metionina) y como consecuencia se forman entrecruzamientos de cadenas peptídicas, fragmentación de la proteína y formación de grupos carbonilos e impiden el normal desarrollo de sus funciones (transportadores iónicos de membranas, receptores y mensajeros celulares, enzimas que regulan el metabolismo celular, etcétera.)28,29
- El daño a los ácidos nucleicos, específicamente los ácidos desoxirribonucleicos (DNA) produce bases modificadas, lo que tiene serias consecuencias en el desarrollo de mutaciones y carcinogénesis por una parte, o la pérdida de expresión por daño al gen específico. Las enzimas reparadoras del ADN son capaces de eliminar la mayoría de las lesiones oxidativas, pero no todas. Estas lesiones se acumulan con la edad y la mayoría se originan en el ADN mitocondrial, no en el ADN nuclear. Se ha demostrado que la oxidación del ADN mitocondrial se asocia con la oxidación del glutatión mitocondrial. Como consecuencia de esto la actividad respiratoria global de las mitocondrias disminuye con la edad en hígado, músculo esquelético y cerebro. Las mitocondrias más envejecidas producen más radicales libres que las jóvenes. En cuanto al ácido ribonucleico (ARN) es alterado por exposición de la célula a estas ERO. En organismos en desarrollo, en tejidos de individuos senescentes y en tejidos bombardeados con O2- se ha encontrado ARN inmaduro en el citoplasma, lo que sugiere que los cambios asociados con el envejecimiento y el desarrollo pueden ser mediados por la generación y eliminación de RL.30,31
- La utilización de oxígeno no es el único aspecto del uso de combustibles que puede tener consecuencias lesivas. Algunos combustibles son también moléculas reactivas que pueden producir daño por sí mismas. La más estudiada en este aspecto es la glucosa. La glucosa, al igual que otros azúcares reductores, puede reaccionar, sin necesidad de catalización por enzimas, con el grupo amino de las proteínas, produciéndose una base de Schiff, que se convierte espontáneamente en producto de Amadori. Sucesivas reacciones de los productos de Amadori y sus derivados con grupos amino de distintas proteínas producen los llamados productos de Maillard, más conocidos como productos terminales de glicosilación avanzada (PTGAs). La estructura química exacta de estos productos es variada y no completamente conocida, pero al modificar la estructura química de las proteínas modifica de forma evidente la estructura terciara de estas proteínas y su balance de cargas, lo que modifica las actividades funcionales que dependen de ello, incluyendo actividad enzimática, unión de ligandos, posición en los membranas, así como sus propiedades mecánicas (elasticidad, resistencia a la torsión). Una evidencia del papel de los PTGAs en el envejecimiento lo demuestra el hecho de que en la diabetes, en la cual aumenta la concentración de los PTGAs, los síntomas de envejecimiento (cambios en la elasticidad de las arterias, pulmones y articulaciones, aumento de la anchura de las membranas basales de los capilares, disminución de la solubilidad del colágeno y del cristalino), aparecen más precozmente. Además, la diabetes mellitus también favorece la aparición de patologías como cataratas, arteriosclerosis, artritis, enfisema y disminución de la función del sistema inmune, asociados normalmente a la edad. Hay que tener en cuenta que frente a la aparición de proteínas conteniendo PTGAs, hay mecanismos que protegen de los daños producidos por ellos, esto explica que la acumulación de PTGAs es la consecuencia de un balance entre su formación y su degradación. Por lo tanto, los daños asociados a la edad pueden deberse a un aumento de formación de proteínas conteniendo PTGAs o a una disminución de su tasa de eliminación. Los macrófagos contienen receptores para proteínas conteniendo PTGAs, lo que permite su eliminación, y a su vez, durante este proceso, el macrófago libera citocinas como factor de necrosis tumoral (TNF, por sus siglas en inglés) e interleucina 1, que colaboran en el control del proceso de reparación tisular. Así, la bien conocida disminución de la función del sistema inmune con la edad podría explicar la aceleración de los daños tisulares inducidos por los PTGAs. Además de su interacción con las proteínas, los azúcares reductores pueden también formar aductos con el ADN y, como consecuencia, producirse enlaces con proteínas. Por lo tanto, la glicosilación puede ser un factor involucrado en los cambios genómicos asociados al envejecimiento.32,33
- Acumulación de productos de desecho. Se ha propuesto que la acumulación de macromoléculas dañadas producidas por algunas de las reacciones químicas anteriormente propuestas pudiera ser un factor que contribuye al envejecimiento celular. Por ejemplo, se ha observado que en distintos tipos celulares en cultivo, en los lisosomas secundarios se va acumulando lipofuscina de una forma proporcional al número de divisiones de estas células. La lipofuscina es un producto de la glicosilación no enzimática de proteínas de vida media larga y del DNA. Los radicales glucosídicos se oxidan y forman enlaces masivos entre proteínas, lípidos y ácidos nucleicos.34
El daño a estas diferentes biomoléculas causada por los RL se haya implicado en la génesis o exacerbación de numerosas patologías, entre las que destacan:
- Aparato cardiovascular: aterosclerosis, infarto del miocardio, cardiopatía alcohólica.
- Sistema neurológico: enfermedad de Parkinson, Alzheimer, neuropatía alcohólica, hiperoxia, isquemia o infarto cerebral, traumatismos craneales.
- Aparato ocular: cataratas, daño degenerativo de la retina, fibroplasia retrolental.
- Aparato respiratorio: distrés respiratorio (síndrome de dificultad respiratoria del adulto), cáncer de pulmón, enfisema.
- Sistema Osteomioarticular (SOMA): artritis reumatoidea.
- Riñón: síndrome autoinmune, nefrotoxicidad por metales.35
Existen otros estudios científicos realizados en animales, los cuales contribuyen a verificar la teoría de los RL. Entre las evidencias encontradas tenemos: la acumulación de ERO en organismos de animales envejecidos, b) la acumulación de macromoléculas con alteraciones estructurales inducidas por los ERO, como peróxidos lipídicos, y el hecho de que en la Drosophila Melanogaster se contienen copias extras del gen de la superóxido dismutasa y catalasa, por lo que esta mosca de la fruta tiene una mayor vida media que las cepas sin tales mutaciones.36
El estado redox a nivel subcelular, de las células, los tejidos y los organismos es una realidad compleja que no se puede medir ni definir con un solo parámetro aislado. No hay métodos estandarizados para medir el estatus de estrés oxidativo (OSS) en humanos o sea ninguno de los llamados biomarcadores del estrés oxidativo (BOSS) consiguen de forma aislada una valoración precisa y definitiva del estrés oxidativo que pueda ser directamente aplicado a la clínica humana. A causa de lo anteriormente expuesto no puede resultar extraño que se hayan utilizado una gran diversidad de métodos en la aproximación a esta realidad del estado redox en el organismo humano. Dentro de los métodos de evaluación del estrés oxidativo más importantes tenemos: técnicas espectroscópicas; votimetría; medir las concentraciones de MDA; resonancia magnética (NMR); niveles de sustancias antioxidantes en plasma, orina o tejidos (vitaminas E, betacaroteno, coenzima Q o ubiquinol, glutatión y vitamina C); productos de oxidación de las LDL; etc.37
Lo nocivo no es que se generen radicales libres en el organismo, fenómeno que ocurre en situaciones normales, sino que exista un desequilibrio entre su producción y su eliminación, que es lo que determina que aparezca o no la enfermedad. En este proceso juegan un importante papel los mecanismos antioxidantes, encargados de la eliminación de estos RL en su gran mayoría.38
El primer nivel de esta batería múltiple de defensa consiste en evitar la reducción univalente del oxígeno mediante sistemas enzimáticos capaces de efectuar la reducción tetravalente consecutiva sin liberar los intermediarios parcialmente reducidos. Esto lo logra con gran eficiencia el sistema citocromo-oxidasa de la cadena respiratoria mitocondrial responsable de más del 90 % de la reducción del oxígeno en el organismo humano.39
El sistema antioxidante defensivo está formado en segunda instancia por sustancias que son de naturaleza enzimática. De estos mecanismos enzimáticos, algunos actúan en el interior de las células, mientras que otros parecen ser más eficaces en el medio extracelular. Formando parte de este grupo de antioxidantes tenemos a la catalasa, enzima que forma parte de los peroxisomas y que destruye el peróxido de hidrógeno (H2O2), transformándolo en H2O y O2. La principal función de la superóxido dismutasa (SOD) parece ser la de eliminar específicamente el anión superóxido, esta enzima se sintetiza principalmente en los epitelios, particularmente el alveolar, y en los endotelios vasculares. El glutatión-peroxidasa (GSH), enzima citoplasmática que contiene selenio y es el elemento central de muchos sistemas detoxificadores, contiene un grupo sulfhidrilo (-SH), que lo hace idóneo para atenuar el efecto de los radicales libres formando como producto un glutatión oxidado (GSSH) y agua. El glutatión es un antioxidante endógeno fundamental. La senescencia está asociada a un descenso del glutatión reducido y a un aumento del glutatión oxidado. El glutatión mitocondrial es crítico y se oxida en mayor medida que el citosólico, provocando así la oxidación del ADN mitocondrial. Otras enzimas a destacar son las peroxidasas, la glucosa fosfato deshidrogenasa y los mecanismos enzimáticos de reparación, que permiten restablecer la información genética de la cadena de DNA, pues los RL son capaces de provocar rupturas y mutagénesis.38
Dentro de los componentes no enzimáticos del sistema antioxidante encontramos diferentes sustancias y algunas como la vitamina A, C, el betacaroteno y los flavonoides son de fuente exógena, los cuales podemos suministrar en la dieta. Los carotenos, sustancias muy relacionadas con la vitamina A, debido a su gran liposolubilidad actúan prioritariamente en los compartimentos más hidrofóbicos, en los que penetran con gran facilidad. El licopeno (una sustancia de tipo carotenoide) es el mejor agente neutralizador del oxígeno singlete que se conoce; además, realizando esta función se encuentran los betacarotenos. La albúmina o ciertos ácidos grasos pueden actuar de manera no específica amortiguando el efecto oxidativo de los radicales libres. Los tocoferoles presentes en el suero y en las membranas de los hematíes protegen la integridad de las membranas celulares y pueden neutralizar al O2-. El ácido ascórbico (vitamina C) tiene un efecto similar al de la catalasa, desdoblando el peróxido de hidrógeno en agua y oxígeno. También funcionan como antioxidantes circulantes la nicotinamida y el ADP. El ácido úrico es otra molécula con capacidad antioxidante que neutraliza eficazmente al radical hidroxilo. Un aminoácido como la taurina, presente tanto en el medio intracelular como el extracelular, es también un buen antioxidante, siendo su concentración más elevada en aquellas células que soportan más carga oxidativa.38 La vitamina E o alfa-tocoferol, la cual neutraliza el OH· en el ciclo de Haber-Weiss y que por su hidrofobicidad se encuentra en las membranas biológicas donde su protección es particularmente importante, también actúa sobre el oxígeno singulete, neutraliza peróxidos y captura anión superóxido.40
Recientemente, se han descubierto en algunos alimentos otros antioxidantes no nutrientes, los compuestos fenólicos. Algunas fuentes son los frijoles (isoflavonas), cítricos (flavonoides), cebolla (quercetina) y polifenoles (aceitunas). También se encuentran algunos antioxidantes fenólicos en el café, vino tinto y té. Un producto con contenido importante en polifenoles es el vino, componente esencial de la dieta mediterránea y que puede ser uno de los factores responsables de la baja incidencia de enfermedad coronaria en las poblaciones mediterráneas.13 Claramente el consumo moderado y regular de vino tinto previene el daño oxidativo al ADN, inducido por una dieta rica en grasas, y confiere protección adicional una dieta rica en frutas y verduras. Estos resultados concuerdan con evidencias epidemiológicas que muestran el rol protector de frutas, verduras y vino en la reducción de ciertos tipos de cáncer producto del EO.4
Existen, por último, antioxidantes artificiales que ya se han comenzado a emplear en medicina; entre ellos cabe destacar la N-acetilcisteína, el dimetilsulfóxido (DMSO), la etildimetiltiourea y el etanol. Los tres últimos pueden neutralizar el efecto del pernicioso radical hidroxilo. Asimismo, el carvedilol y los inhibidores de la enzima convertidora de angiotensina. Un hipolipemiante con efecto antioxidante, el probucol, se ha mostrado efectivo en reducir la tasa de reestenosis tras angioplastia coronaria con balón.41,42
El envejecimiento celular surge entonces de manera natural, como característica propia de todo lo vivo, reflejando el desorden molecular ocasionado por los RL, los cuales independientemente de su origen, causan la disfuncionalidad y los trastornos estructurales propios de esta última etapa del desarrollo. Nuestro organismo cuenta con defensas contra estas especies reactivas, disminuyendo así la incidencia de estas últimas y propiciando el mantenimiento el equilibrio interno. Sin embargo, al paso del tiempo se hace inevitable la ruptura de esta homeostasia, los RL superan los mecanismos antioxidantes, aparece el estrés oxidativo agudo y crónico que condiciona, en menor o mayor medida, la muerte celular.
CONCLUSIONES
Luego de exponer los conocimientos actuales sobre los mecanismos que explican el papel del estrés oxidativo en el envejecimiento celular se concluye que el oxígeno muestra toxicidad porque da lugar a la formación de un alto porcentaje de radicales libres, constituyendo esta su fuente biológica primordial; sin embargo existen fuentes exógenas como es el caso del humo del tabaco y el ozono. El estrés oxidativo es producto del daño ocasionado por los radicales libres y las especies reactivas del oxígeno, los cuales causan modificaciones en las biomoléculas como lípidos, proteínas y en el ADN impidiendo su correcto funcionamiento y ocasionando trastornos en la permeabilidad de la membrana, aparición de placas de ateroma, fragmentación proteica, glicosilaciones, ARN inmaduros, etcétera. Estas afectaciones, principalmente del ADN, provocan a largo plazo la senescencia celular y la aparición de enfermedades cardiovasculares, neurológicas y neoplásicas. Para evitar el exceso de radicales libres existe una serie de defensas antioxidantes, unas son endógenas, como el glutatión y las enzimas antioxidantes, y otras son exógenas, como las vitaminas E, C y los carotenoides. Asimismo, la administración de antioxidantes o de precursores del glutatión es muy importante para prevenir el envejecimiento.