INTRODUCCIÓN
El Streptococcus pneumoniae o neumococo (S. pneumoniae) es reconocido como el principal patógeno bacteriano que afecta el tracto respiratorio de niños y adultos. Ocasiona infecciones de la vía aérea superior, y constituye la principal causa de neumonía adquirida en la comunidad (NAC) en los países desarrollados y en vías de desarrollo.1
La enfermedad neumocócica constituye una de las diez primeras causas de muerte en los países desarrollados. Se estima que del 15 al 30 % de todas las neumonías son debidas al neumococo.2 Se transmite por vía respiratoria, especialmente por núcleo-gotitas de aproximadamente 10μm que permanecen en suspensión. Su cápsula de polisacáridos le permite evadir la fagocitosis, facilitando la invasividad del germen, que puede también ocasionar meningitis, septicemia, fiebre sin foco y, más raramente, artritis, peritonitis y celulitis.3 El costo de la enfermedad neumocócica es una carga económica importante y significativa para los sistemas de salud y las familias.5
La colonización nasofaríngea es un tema importante en la epidemiología de las infecciones neumocócicas, ya que es el paso previo a la enfermedad y condiciona la selección de resistencias. Todas las enfermedades causadas por neumococos están precedidas de una colonización nasofaríngea asintomática de mayor o menor duración, en función de diferentes factores, pero principalmente de la invasividad de cada serotipo. El porcentaje de portadores asintomáticos varía con la edad, el entorno y la presencia de infecciones en el tracto respiratorio alto. La prevalencia de portadores puede llegar a alcanzar hasta el 60 % en los niños en edad preescolar, 35 % en los de edad escolar y hasta un 29 % en adultos jóvenes.6
En la actualidad, se describen 97 serotipos de neumococos inmunológicamente distintos, que varían según la estructura de su cápsula de polisacáridos. Cada serotipo difiere en sus propiedades biológicas, la capacidad patógena e invasora, los síndromes que producen, la capacidad para colonizar la nasofaringe y la resistencia a antibióticos.7
La introducción de la vacuna conjugada antineumocócica (PCVs) en los esquemas de inmunización, es una herramienta efectiva para la prevención y control de la enfermedad neumocócica y la colonización nasofaríngea. La nueva generación de vacunas conjugadas antineumocócicas es altamente efectiva en niños menores de dos años y se ha introducido en varios países con gran éxito, con registros de una disminución evidente en la incidencia de la enfermedad neumocócica invasiva (ENI) en menores de cinco años.8-12
Cuba no ha iniciado la vacunación antineumocócica, pero un candidato vacunal heptavalente (PCV7-TT) se encuentra actualmente en fase de evaluación clínica, y se espera poder introducirlo para el año 2019.13-15
Se realiza este estudio con el objetivo de determinar la prevalencia de colonización nasofaríngea en niños institucionalizados de 1 a 5 años de edad, del municipio de Cienfuegos durante el período 2014-2015. Este constituye parte de las evidencias de línea de base, previas a la introducción de la nueva vacuna conjugada antineumocócica cubana.
MÉTODOS
Se realizó un estudio observacional transversal en el municipio de Cienfuegos, en el período de junio de 2014 a abril de 2015.
De los 4 084 niños matriculados en los 26 círculos infantiles ubicados en las ocho áreas de salud del municipio, fueron incluidos 1 129, teniendo en cuenta los siguientes criterios: edad, consentimiento informado firmado por los padres o tutores, asistencia a la institución y tratamiento antibiótico siete días antes de que se recogieron muestras clínicas, o historia previa de vacunación contra neumococo.
Los exudados nasofaríngeos (ENF) fueron recogidos por el técnico de laboratorio del área de salud, previamente entrenado, utilizando hisopos flexibles de nylon estéril flocados (Copan, Italia). Se siguió el procedimiento establecido de insertar el hisopo en la parte posterior de la nasofaringe y girar antes de ser retirado. Este se colocó directamente en un tubo que contenía 1,0 ml del medio de cultivo leche descremada triptona-glucosa-glicerol (LTGG). Las muestras fueron transportadas al laboratorio de microbiología del Hospital Pediátrico de Cienfuegos en hielo seco, se agitaron durante 10 segundos, se congelaron y conservaron a -70 °C.
El aislamiento de S. pneumoniae y la serotipificación fueron realizadas en el Laboratorio Nacional de Referencia de Neumococo del Instituto de Medicina Tropical Pedro Kourí (LNRN-IPK). La identificación de S. pneumoniae se basó en la presencia de α-hemólisis y la inhibición por optoquina.16 Las muestras de ENF se descongelaron a temperatura ambiente (25 °C), se agitaron, y utilizando el hisopo contenido en el tubo, se inocularon en placas de agar sangre con 5 % de sangre de carnero y 5 mg/L de gentamicina. Estas se incubaron durante 18-24 h a 37 °C en atmósfera de CO2.
De los cultivos sugerentes de neumococo, en función de la presencia de α-hemólisis, se seleccionaron al menos dos colonias. Estas se cultivaron en placas de agar sangre en las que se incluyó un disco de optoquina. Los aislamientos susceptibles a optoquina se informaron como S. pneumoniae, y ante resultados dudosos se corroboró mediante la prueba de la solubilidad en bilis. Cada cultivo recuperado de una misma muestra de ENF identificado como neumococo, se conservó independientemente. Los aislamientos confirmados como S. pneumoniae se almacenaron a -70 °C en 1,0 mL del medio LTGG hasta el momento de la serotipificación.
El tipo capsular o serotipo se determinó empleando la reacción de Neufeld-Quellung o reacción de hinchamiento capsular, utilizando el juego de reactivos Pneumotest (Statens Serum Institute, Copenhage, Dinamarca).16
Los serotipos se clasificaron en: a) serotipos vacunales incluidos en el candidato vacunal cubano contra neumococo (1, 5, 6B, 14, 18C, 19F y 23F); b) relacionados con la vacuna por posible reacción cruzada (6A y 19A); c) serotipos no vacunales, o sea, no incluidos en la formulación de dicho candidato vacunal; y d) “sin serotipar”, aislamientos para los que no se podría asignar una cápsula.
Se estimó la prevalencia de la colonización NF global y por serotipos. Se describieron las proporciones de serotipos vacunales, los relacionados con la vacuna y los serotipos no vacunales.
La variable dependiente fue la colonización nasofaríngea (resultado positivo/ resultado negativo) y las independientes: edad (de 12 a 23 meses/2 a 5 años), serotipos aislados (vacunales, relacionados con la vacuna, no vacunales, no serotipados). El análisis estadístico se realizó utilizando el software R, a través del cual se estimaron las diferencias de significación estadística mediante la prueba de chi cuadrado con un nivel de significación de 0,05.
Se realizó una entrevista individual utilizando un cuestionario semiestructurado diseñado al efecto, donde se recogieron los datos de identificación del sujeto y de la muestra de exudado nasofaríngeo, los cuales se incluyeron en una base de datos utilizando Microsoft Access versión 2007.
El estudio fue revisado y aprobado por el Comité de Ética de la Investigación del IPK y de la Universidad de Ciencias Médicas de Cienfuegos, así como por el Consejo Científico Provincial.
RESULTADOS
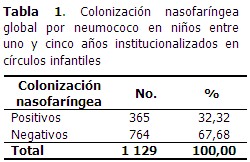
De los ENF analizados, 365 estaban colonizados, lo que representó el 32,32 %. (Tabla 1).
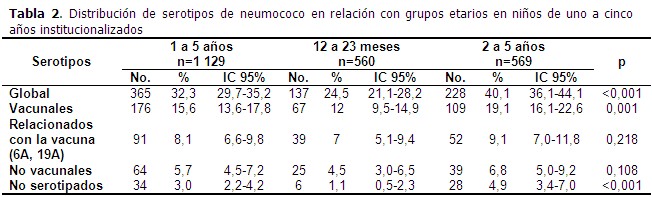
Predominaron los serotipos vacunales, con 15,6 % del total de ENF, resultado significativamente estadístico. El grupo etario de 2 a 5 años mostró mayor colonización a expensas de los serotipos vacunales. (Tabla 2).
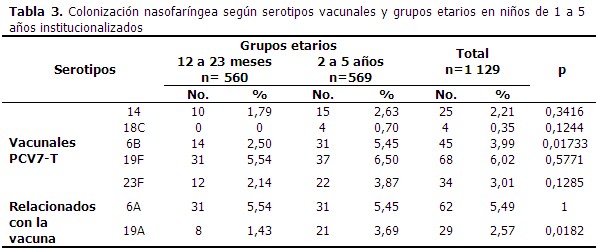
Los serotipos vacunales más frecuentes fueron el 19F (6,02 %) y el 6B (3,99 %). De los serotipos relacionados con la vacuna, el 6A fue el más frecuente con un 5,49 %. (Tabla 3).
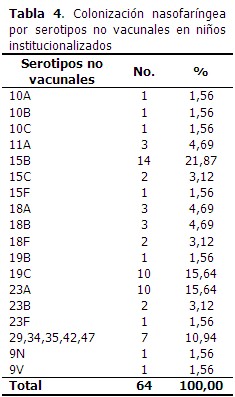
De los serotipos no vacunales, el de mayor frecuencia de aislamiento fue el 15B, encontrado en 14 muestras (21,87 %), seguido por los serotipos 19C y 23A en 10 muestras (15,64 %) cada uno, y los serotipos 29, 34, 35, 42, 47 en 7 muestras (10,94 %). (Tabla 4).
DISCUSIÓN
La ENI se considera un problema de salud pública en el mundo, que afecta tanto a niños como adultos, con un amplio espectro de manifestaciones de la enfermedad.17
Los resultados del presente artículo forman parte de los estudios previos a la introducción de la vacuna cubana antineumocócica PVC7-TT, y contribuyen a evaluar la efectividad y e impacto de esta en los niños menores de cinco años.
La colonización nasofaríngea por neumococo en la muestra estudiada se comporta de forma similar a lo registrado en la literatura.18,19 Se ha estimado que entre un 25 y 60 % de los niños menores de 4 años están afectados por esta bacteria.20 Estudios realizados en Europa plantean que del 25-60 % de los niños y un 6-29 % de los jóvenes, presentan colonización nasofaríngea por este germen, relacionada en el caso de los adultos, a la convivencia con lactantes y párvulos.21,22
La mayor proporción de serotipos aislados en esta población, correspondió a serotipos vacunales (19F, 6B, 23F, 14 y 18C); de manera que puede estimarse que al introducir la vacuna cubana en el esquema de inmunización, se debe reducir en un 40 % la carga de colonización nasofaríngea, influyendo favorablemente en la morbimortalidad de la enfermedad neumocócica.
La distribución de serotipos varía a lo largo del tiempo, así como para las diferentes zonas geográficas, dependiendo de la edad, del uso de antibióticos y de otros factores conocidos.23 En poblaciones no vacunadas contra neumococo, los serotipos que con más frecuencia colonizan la nasofaringe son el 3, 6A, 6B, 7F, 14, 18C, 19A, 19F y 23F, comportamiento muy similar al encontrado en este estudio, teniendo en cuenta tanto los serotipos vacunales como los relacionados con la vacuna.
Diversas investigaciones han puesto de manifiesto que los serotipos predominantes en el mundo son 4, 14, 6, 19, 23, 18 y 9, y que los más prevalentes en países desarrollados como Estados Unidos, Canadá y Europa, son 6, 14, 19 y 23.12,24
Varios artículos científicos25-27 avalan que, aunque la nasofaringe de los niños es colonizada en el primer año de vida y la vacunación en los primeros meses resulta muy efectiva, también es una realidad que la efectividad de la vacunación antineumocócica en niños entre 1 y 5 años como población meta, reducirá la trasmisibilidad del neumococo y la carga de enfermedad, produciéndose efecto rebaño en el lactante y convivientes adultos.
En Cuba existen pocos estudios sobre los serotipos causantes de ENI, aunque ha sido documentado que los serotipos 14, 19A, 19F, 6B, 23F y 6A fueron detectados con frecuencia en niños menores de 5 años de edad hospitalizados.28 Los serotipos 1, 5, 6A, 6B, 14, 19F y 23F, constituyen causa frecuente de enfermedad neumocócica en menores de 5 años en todo el mundo.29
Se concluye que la colonización nasofaríngea por neumococo es elevada en los niños preescolares a expensas de serotipos vacunales, lo que resulta una contribución a la generación de la nueva evidencia científica previa a la introducción de la vacuna antineumocócica en el esquema nacional de inmunización.