INTRODUCCIÓN
En las últimas décadas la incidencia de infección por el virus del dengue se ha incrementado enormemente en el mundo, el número real de casos está insuficientemente notificado; según una estimación reciente se producen de 50 a 100 millones infecciones por dengue cada año, de los cuales 250 a 500 mil se manifiestan como fiebre hemorrágica del dengue.1 En un estudio sobre la prevención del dengue se estima que 3900 millones de personas de 128 países están en riesgo de infección por el virus del dengue.2 Desde el año 2000, se ha convertido en la segunda enfermedad más común de las transmitidas por mosquitos y que afectan a los seres humanos, después de la malaria.3 Es importante destacar que existen varios factores que han contribuido a la propagación del vector como son el crecimiento de la población y la urbanización incontrolada sobre todo en países en vía de desarrollo, lo que da lugar a un deterioro de los sistemas de higiene municipales4 y la falta de control eficaz de las poblaciones de mosquito en zonas endémicas.5
Las primeras referencias del dengue en Cuba datan de 1782 en Remedios. Posteriormente se reportaron brotes en 1827, 1848, 1849 y 1897.6 En 1950 comienza la actual pandemia de dengue en el mundo,3 la cual también ha afectado a nuestro país. La epidemia de dengue de 1977 se caracterizó fundamentalmente por fiebre, con más de 500 000 casos reportados. En 1981 ocurrió la primera epidemia de fiebre hemorrágica de dengue, con más de 10 000 casos reportados de los 400 000 en general; se reportaron 158 fallecidos, de los cuales 101 eran niños. Se sucedieron otras epidemias en Cuba en los años 1997 y 2001; todas estas epidemias se caracterizaron por la circulación de un solo serotipo.7 En 2006 reaparecen los serotipos 3 y 4 y desde esa fecha en las epidemias que se han sucedido existe circulación de más de un serotipo.8
El deterioro de las condiciones higiénicas en la población influye negativamente en la situación epidemiológica, lo cual hace que favorezca la reaparición de la enfermedad. En Cuba, el número de casos se ha incrementado de forma alarmante y la enfermedad ha tenido una forma ascendente.8 Es por esta situación que se hace necesario disponer de una vacuna preventiva para esta enfermedad a fin de contribuir con su erradicación, aunque desde 1929 existen intentos de utilizar una vacuna para el dengue.9
La vacuna más avanzada, que es desarrollada por la empresa francesa Sanofi Pasteur, había sido evaluada antes con niños en otro ensayo que se hizo en cinco países de Asia. Después de una historia de 86 años de búsqueda, los primeros resultados de una vacuna en fase III en América Latina son un hito importante: tuvo un 60,8 % de eficacia global en cinco países latinoamericanos.10
Una vacuna fue prevista para finales del 2015 y superó por primera vez un ensayo clínico en fase III. No dio una protección total, pero marcó un “hito”. Es una vacuna “tetravalente” porque brinda protección contra los 4 serotipos del virus.2 El ensayo se llevó a cabo entre 2011 y 2012 en más de 20.000 niños sanos de entre 9 a 16 años de Colombia, Brasil, México, Puerto Rico y Honduras. Recibieron tres dosis.11 Sin embargo, la búsqueda de una vacuna ha transcurrido con dificultades, entre otras razones porque no existe un modelo animal ideal para evaluar los candidatos vacunales, además de que debe obtenerse una formulación tetravalente que logre protección duradera contra los cuatro serotipos.9,12 Sin embargo una de las limitantes en el desarrollo de vacunas contra el dengue es sin duda lograr un candidato que responda de manera similar ante los antígenos de los cuatros serotipos, dado a que el sistema inmune juega un papel primordial en el desarrollo de las formas graves de la enfermedad.13
Por ello se hace necesario entender cuál es la dinámica de la respuesta inmune en los pacientes con dengue como parte de la patogenia de la enfermedad. Es por ello que realizamos la presente revisión bibliográfica con el objetivo de profundizar en los mecanismos inmunopatogénicos de esta enfermedad.
MÉTODOS
Para el desarrollo de esta investigación se realizó una revisión bibliográfica usando el motor de búsqueda de Pubmed, donde se usaron los descriptores DeSC: dengue, dengue AND Immune system, dengue AND immune response. Se obtuvieron 7188 resultados. Se incluyeron aquellos artículos de menos de cinco años de publicados, de acceso abierto. La fuente original se encontraba mayoritariamente en idioma inglés por lo cual se realizó la traducción de los artículos para su posterior análisis y uso en la actual publicación. Adicionalmente se realizó una búsqueda en Infomed donde se buscó por revista y se utilizó el descriptor dengue con un total de 175 resultados.
DESARROLLO
Virus del dengue
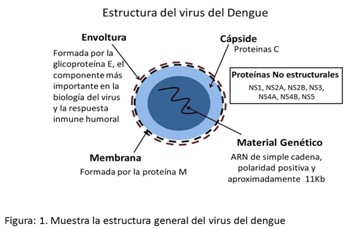
El complejo dengue lo constituyen cuatro serotipos virales serológicamente diferentes (1, 2, 3 y 4) que comparten analogías estructurales y patogénicas con una homología de secuencia de aproximadamente 70 %, que es mayor entre los serotipos 1-3 y 2-4.1 El genoma viral es una cadena de ARN simple de polaridad negativa, que codifica tres proteínas estructurales: la cápside (C), que rodea y protege al ácido nucleico, la proteína de membrana (M) y la envoltura (E).9 La glicoproteína E particularmente media la fusión de membrana, induce la formación de anticuerpos neutralizantes, inhibidores de la hemaglutinación y anticuerpos imunoamplificadores; además, en ella se localiza el receptor viral.2 (Figura 1).
Además, el genoma viral codifica siete proteínas no estructurales 5'-C-prM-E-NS1-NS2A-NS2B-NS3-NS4A-NS4B-NS5-3'; la proteína NS1 participa en la maduración viral,14 la proteína NS3 tiene función helicasa y proteasa y en la NS5 radica la función polimerasa del virus.15 La proteína prM (precursor de la proteína M) protege a la proteína E del pH ácido del medio durante la maduración viral que evita su cambio conformacional irreversible.15
Patogenia de la enfermedad
La infección por virus del dengue se transmite por la picadura de un mosquito a través de la epidermis y la dermis, donde se infectan las células inmaduras de Langerhans (células dendríticas epidermales y los queratinocitos.16
Se ha demostrado que el primer blanco de este virus en humanos son las células dendríticas de la piel, que funcionan como centinelas del sistema inmune. Durante la salivación del artrópodo, las partículas virales son liberadas en la dermis y las células dendríticas de Langerhans las interiorizan, lo que contribuye a la diseminación del virus cuando estas migran a los ganglios linfáticos.17
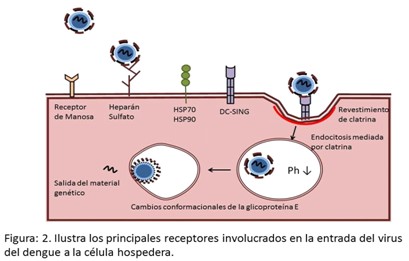
a entrada del virus a la célula está mediada por la unión del virión a receptores específicos expresados en las células como los receptores de manosa, los receptores DC-SING, CD14, receptor de Manosa, heparan sulfato, Protínas HSP70/HSP90, protína reguladora de la glucosa (GRP78), el receptor de laminina y las proteínas TIM y TAM. También existen evidencias que el virus puede entrar en las células humanas a través de la interacción con otras moléculas como los receptores de vitronectina, los receptores scavenger y los receptores KIR.18 (Figura 2).
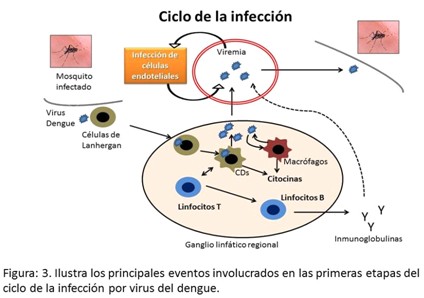
Las células infectadas migran del sitio de la infección hacia los nódulos linfáticos, se reclutan los macrófagos y los monocitos, que se convierten en células blancos de la infección, y el virus se disemina a través del sistema linfático. Como resultado de esta primera viremia la infección se extiende a las células dendríticas (CD) del resto de la economía, monocitos-macrófagos, células endoteliales y hepatocitos. Sin embargo, la viremia no guarda relación con la severidad de la enfermedad, a diferencia de otros marcadores inmunológicos como los niveles de citoquinas proinflamatorias y la población de monocitos-macrófagos.19 (Figura 3).
La transmisión del virus del enfermo al mosquito está influenciada por diversos factores, entre ellos, que los títulos de virus en la sangre del paciente, para el caso de los serotipos 1 y 2 requieren un menor número de copias de ARN virales/mL que para los serotipos 3 y 4.20 Un estrudio revela que en títulos entre 6,2 y 7,5 Log, 10 copias de ARN viral/mL son suficientes para que ocurra infección en más del 50 % de los mosquitos que pican al enfermo. El tiempo de evolución de la enfermedad es otro elemento importante en la infección del mosquito; de forma general el humano es infectante para el mosquito desde 1,5 días antes del inicio de los síntomas hasta 5 días después de iniciado el cuadro.21
Durante la infección por virus del dengue el sistema inmune responde con la producción de diversas citocinas porinflamatorias, las cuales están relacionadas con la patogenia de la enfermedad.22 La proteína viral NS1 es reconocida por los receptores tipo toll TLR2 y TLR6 los cuales contribuyen con la expresión de citocinas porinflamatorias.23 En especial los macrófagos se convierten en uno de los principales productores de citoquinas como IL-1β, IL-2, IL-6, IL-8 y TNF-α.24 Particularmente el TNF-α se relaciona con las manifestaciones hemorrágicas al favorecer la trombocitopenia y la disfunción endotelial.25
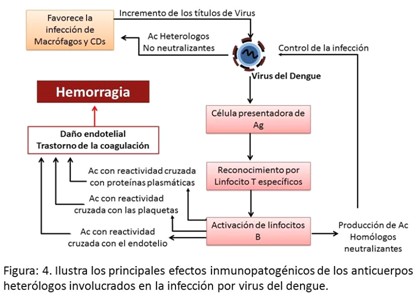
Las células dendríticas presentan los antígenos a los linfocitos TCD4 los cuales se activan y cooperan con los linfocitos B produciendo respuesta de anticuerpos. La respuesta de anticuerpos constituye un elemento crítico en la patogenia de la enfermedad.26 Está demostrado que los anticuerpos producidos contra una cepa no necesariamente son neutralizantes, esto se debe a diferencias entre los epitope del dominio III de las proteínas de la envoltura.27 Los anticuerpos no neutralizantes favorecen la entrada de los virus a las células mononucleares con lo cual se amplifica la infección.28
Adicionalmente la acción de estos anticuerpos heterólogos provoca la activación del complemento por la vía clásica con el aumento de anafilotoxinas (C3a y C5a) que constituyen un importante mediador del aumento de la permeabilidad vascular.29 Por otra parte, estos anticuerpos están implicados en la aparición de los fenómenos hemorrágicos, pues se ha descrito que existe reactividad cruzada contra las plaquetas, células endoteliales y proteínas plasmáticas relacionadas con la cascada de la coagulación.30,31 (Figura 4).
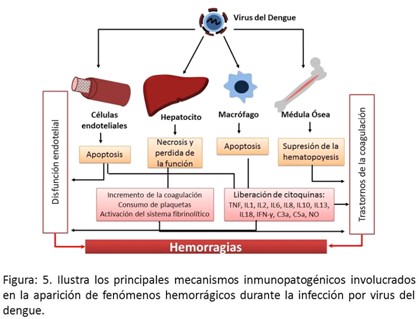
El virus del dengue puede infectar directamente las células progenitoras en la médula ósea, de esta manera suprimir la hematopoyesis; adicionalmente la formación de anticuerpos que reconocen por reacción cruzada estructuras de las plaquetas contribuye con la trombocitopenia característica de esta enfermedad;32 ambos efectos contribuyen con la aparición de hemorragias pues disminuye la producción de plaquetas y aumenta su destrucción en periferia. (Figura 5).
Adicionalmente el virus del dengue infecta provocando apoptosis y liberación de citocinas porinflamatorias.33 Estos eventos traen como consecuencia disfunción endotelial y aumento de la permeabilidad vascular lo que facilita la aparición de fenómenos hemorrágicos.34 Finalmente durante la infección por el virus del dengue ocurre necrosis de los hepatocitos secundaria a la infiltración de este órgano por células del sistema inmune como LTC y NK, las cuales destruyen los hepatocitos infectados. Como consecuencia de este hecho en los pacientes se elevan las aminotransferasas y el hígado disminuye su capacidad de producir factores de la coagulación y proteínas plasmáticas lo cual contribuye de manera decisiva a la aparición de fenómenos hemorrágicos.35 (Figura 5).
Cuadro clínico de la enfermedad
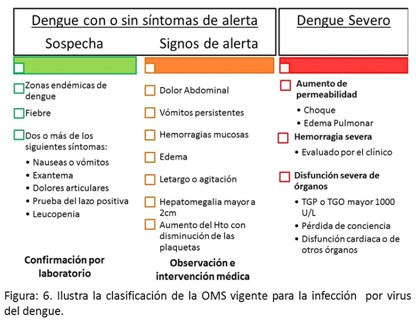
La infección por dengue puede evolucionar de forma asintomática o sintomática; dentro de esta última la fiebre indiferenciada es observada con mayor frecuencia en los niños. A mediados de los años 70 la Organización Mundial de la Salud (OMS) propuso una clasificación de la gravedad de dengue con el fin de ayudar al diagnóstico, al abordaje de los pacientes y al monitoreo de la enfermedad. Se definieron entonces los conceptos: fiebre del dengue (FD) o dengue clásico, dengue hemorrágico (FHD) y síndrome de choque por dengue (SCD).36
Esta definición fue muy cuestionada pues en la mayoría de los países donde hay casos de dengue y dengue hemorrágico los síntomas clínicos y los hallazgos de laboratorio no concuerdan con los definidos por la OMS en esa clasificación, por lo tanto, esta enfermedad se clasifica actualmente, con la aprobación de una nueva clasificación en el año 2009, de acuerdo a niveles de gravedad en: dengue con o sin presencia de signos de alarma y dengue grave (Figura 6) sobre la base de datos clínicos y de laboratorio.15
La actual clasificación en niveles de gravedad tiene un alto potencial para ayudar a los clínicos a tomar decisiones en cuanto a dónde y cuán intensamente debe ser observado y puesto en tratamiento un paciente y ha demostrado ser más efectiva que la clasificación de FD/FDH/SCD para un rápido reconocimiento de la enfermedad grave.
A modo de resumen se puede decir que en los pacientes con formas graves del dengue se ha demostrado la asociación con marcadores del sistema inmune y las manifestaciones hemorrágicas. Dentro de los elementos que con mayor frecuencia se refieren en la literatura encontramos los niveles de TNF-α, IL-10, IFN-γ. Adicionalmente las formas graves se describen con mayor frecuencia en infecciones subsecuentes lo que demuestra el papel de los anticuerpos de memorias en la inmunopatogenia de los fenómenos hemorrágicos.