INTRODUCCIÓN
Las funciones de los tendones se clasifican en dos categorías: los transmisores de fuerza tensil, y los de almacenamiento y liberación de energía elástica durante la locomoción. El tendón de Aquiles pertenece a este segundo grupo, también llamados, en su conjunto, tendones de gran estrés.1
Las rupturas del tendón de Aquiles ocupan el tercer lugar en frecuencia entre las rupturas tendinosas, después del manguito rotador y del mecanismo extensor del cuádriceps. Es una lesión reconocida desde el tiempo de Hipócrates pero es Ambrose Paré en 1575 quien realiza la primera descripción de esta entidad.2 Pueden ser parciales o totales. En ambos casos el tratamiento es el mismo, pues una rotura parcial desembocará en total. Sus mecanismos de producción incluyen la flexión plantar forzada y repentina del pie y la dorsiflexión repentina y violenta del pie en flexión plantar.3
Predomina en el sexo masculino con proporción 3:1, a partir de la tercera década de la vida, en el 75 % de los casos en personas que practican deportes que precisan de un despegue rápido como el futbol o el tenis de campo, el 15 % de los cuales presenta sintomatología previa de tendinitis.4
La etiología es multifactorial, aunque existen reportes sobre cambios histopatológicos previos en la anatomía del tendón que lo predisponen a una ruptura. Entre estos tenemos:
- Mecánicos: una contracción súbita e intensa del complejo músculo-tendinoso puede generar una tensión excesiva en el tendón y lesionarlo en presencia de un mecanismo inhibidor de la contracción alterado; y por microtraumatismos repetitivos secundarios a un sobreuso.
- Vasculares: las lesiones del tendón de Aquiles están comúnmente limitadas a un segmento hipovascular o zona crítica, comprendida entre dos y seis cm de su inserción en el calcáneo, y que se acentúa después de la tercera década de la vida.
- Tisulares: los tendones que se rompen tienen cambios degenerativos preexistentes que incluyen: degeneración hipóxica, degeneración mucoide, tendolipomatosis y calcificaciones.
- Endocrinos: enfermedades como el hiperparatiroidismo, o los depósitos de cristales de urato que ocasionan enfermedades como la gota.
- Medicamentosos: el uso de diversos factores químicos como las quinolonas (preponderantemente la pefloxacina, que actúa en la síntesis de colágeno tipo I), o los corticoides que favorecen las microrupturas, e inflamación.
El uso de terapia celular como coadyugante al tratamiento puede convertirse en una herramienta que favorece el proceso de cicatrización de la lesión. Por tales se razones se decidió la presentación de este caso en que se utilizó la terapia celular con buenos resultados.
PRESENTACIÓN DEL CASO
Paciente de color de piel blanca, femenina, de 63 años de edad, con antecedentes de salud anterior, que acudió a consulta de ortopedia del Hospital Julio Aristegui Villamil, refiriendo molestias a la marcha, de varios meses de evolución, y dolor persistente en su talón derecho, a pesar de los tratamiento previos empleados.
Este cuadro álgido se había intensificado en el último mes, después de una sensación súbita de dolor y un intenso chasquido en la parte posterior del tobillo, que la paciente relacionó con una infiltración que le realizaran con acetónido de triamcinolona a nivel retrocalcáneo.
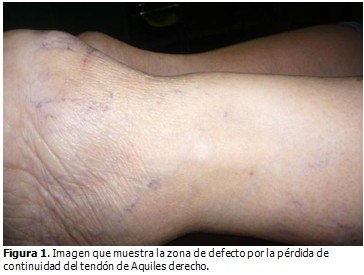
Al exámen físico se observó una marcha claudicante con imposibilidad para la flexion plantar activa y soportar carga de peso en el pie derecho. A la palpación se corroboró discreto edema local peritendinoso en dicho miembro, y un hundimiento en la superficie tendinosa (signo del hachazo), así como reblandecimiento de los extremos al no estar sometido a tensión. (Figura 1).
La realización del test de Thompson con la paciente en decúbito prono con sus piernas extendidas, a la que se le comprimieron los músculos gemelos y se produjo una contracción muscular que provocó la flexión plantar del pie sano, no así del lado lesionado, confirmó la ruptura del tendón de Aquiles.
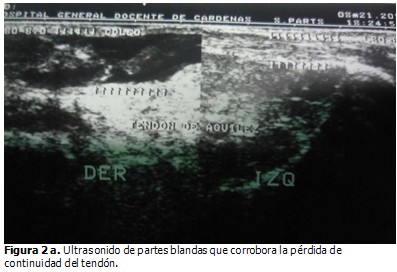
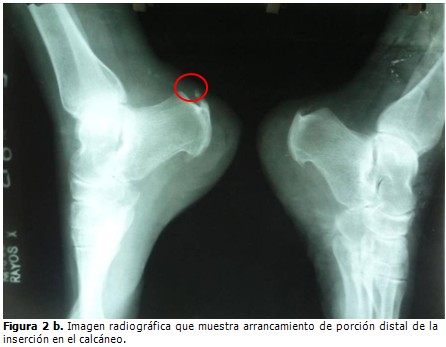
Se indicó ultrasonido de partes blandas, en el que se reconoció la pérdida de la estructura ecográfica fibrilar del tendón. En radiografía simple, vista lateral, se observó un arrancamiento de l porción distal de la inserción en el calcáneo y empastamiento de los bordes del triángulo de Kager. (Figuras 2a y 2b).
Con el diagnóstico de ruptura inveterada del tendón de Aquiles derecho se discutió en el Grupo Básico de trabajo y se decidió la intervención quirúrgica.
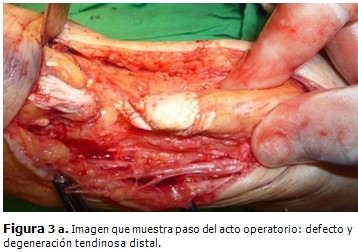
Se realizó una incisión longitudinal posteromedial de 10 cm de longitud, a un centímetro del borde medial del tendón que terminaba justo por encima de la tuberosidad del calcáneo. La piel, el tejido subcutáneo y la vaina tendinosa se abordaron en el mismo sentido; se observó un cabo tendinoso proximal deshilachado y defecto de aproximadamente dos centímetros.
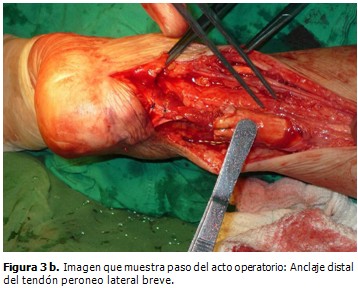
Se desbridaron los bordes desflecados, sin movilizar los cabos hasta llegar al tejido de aspecto normal y extraer injerto de peroneo lateral breve que se reinsertó en túnel realizado en tuberosidad del calcáneo al que se suturó el cabo distal y proximal del Aquiles, atravesando el muñón proximal 2,5 cm de la rotura. Se utilizó Nylon 2 y un punto modificado de Kessler.
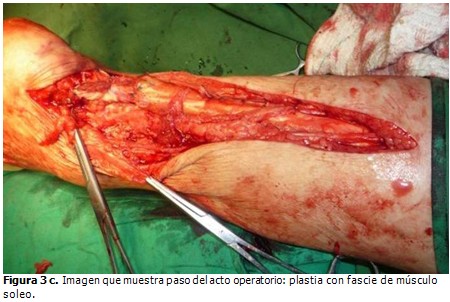
Para reforzar la sutura se realizó una técnica de Christiensen, recortando una banda de 2 cm de ancho y unos 15 cm de largo de la aponeurosis de los músculos gastrocnemios, la que, conservando su unión distal, se revierte sobre el tendón de Aquiles, y se suturó formando una funda posterior a todo el tendón. (Figuras 3a, 3b y 3c).
Se inmovilizó con yeso inguinopédico en equino 20o.
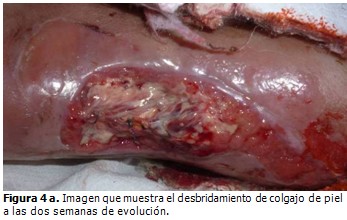
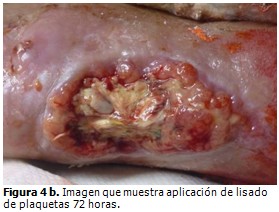
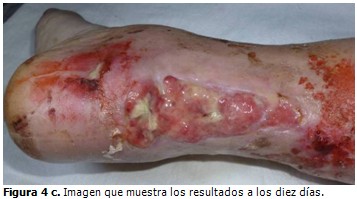
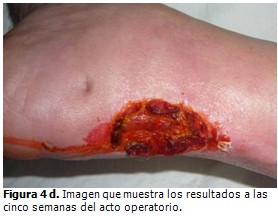
A las dos semanas de evolución se detectó necrosis del colgajo de piel que conllevó a desbridamiento conservador y exposición del injerto. Se comenzaron curas diarias con lisado de plaquetas, que luego se alternaron por la evolución satisfactoria del tejido cicatrizal hasta epitelización en la cuarta semana del posoperatorio. (Figuras 4a, 4b, 4c y 4d).
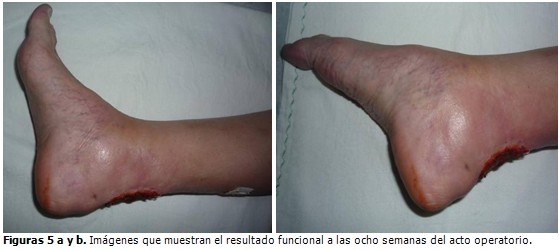
La inmovilización se mantuvo durante seis semanas, las cuatro primeras sin apoyo y las dos siguientes con la ayuda de bastones de apoyo axilar. (Figuras 5a y 5b).
Con posterioridad se inició la deambulación, colocando un tacón de 2,5 cm durante un mes en el pie afectado e iniciando ejercicios controlados de elongación muscular.
A las doce semanas de la operación la paciente comenzó a realizar su vida normal. Fue dada de alta definitiva a las 16 semanas.
DISCUSIÓN
El tendón de Aquiles es el tendón más grueso y resistente del organismo. Está constituido principalmente por colágeno tipo I. La cobertura cutánea y aporte vascular que recibe son pobres. Su inervación la proporciona el nervio tibial posterior y el safeno externo, permitiéndole tener una función de propiocepción.
El sitio más frecuente de localización de su ruptura es la zona comprendida entre los dos y seis centímetros por arriba de la inserción en el hueso calcáneo. En la mayoría de los pacientes el diagnóstico clínico es lo suficientemente claro y no precisa de otras pruebas complementarias.4 En este caso la infiltración local con acetónido de triamcinolona pude ser el factor desencadenante de la ruptura.
Delgado describe que la ruptura completa del tendón de Aquiles está asociada a cambios histopatológicos previos que demuestran una degeneración hialina previa del tendón, una degeneración mucoide y fibrilación de las fibras de colágeno, aun sin presentar sintomatología relacionada.5
Existe controversia en cuanto a su tratamiento. Lelièvre6 define que toda rotura debe ser intervenida ya que la resolución del cuadro con el uso de una inmovilización con vendaje enyesado es ilusoria. Para la mayoría de los autores el tratamiento quirúrgico y la rehabilitación temprana presentan mejores resultados, menor índice de reroturas y mejor fuerza de flexión plantar, con menor atrofia del tríceps sural.7,8
La incisión nunca deberá realizarse sobre la línea media posterior, para evitar futuros roces sobre la cicatriz y además conseguir un recubrimiento más anatómico, pues no es raro que la piel quede demasiado tirante y se describen dehiscencias de la herida o incluso necrosis cutáneas, como ocurre en el 11,8 % de los casos, lo que agrava el pronóstico y alarga el tiempo de recuperación.9,10
En lesiones inveteradas, la tensión y la dehiscencia de los extremos dificulta la sutura, por ello la tenorrafia terminoterminal no ofrece garantías, los extremos del tendón están tan degenerados que difícilmente ofrecen un buena presa para los puntos de sutura.
Múltiples procedimientos se han descrito en la literatura para la reconstrucción de las rupturas crónicas del tendón de Aquiles, utilizando como reforzamiento en todas ellos un puenteo del defecto que puede ser a base de fascie lata, aponeurosis del plantar delgado, porción proximal del tendón de Aquiles, peroneo corto, plantar delgado, flexor común de los dedos, flexor largo del dedo gordo, y materiales sintéticos como dacrón, polímeros de fibra de carbono, sutura de poliglicol, tendón protésico de colágena y malla Merlex.2,5,8-10
Davis,11 ha demostrado que colocando el retropié a 20° o 25° de flexión plantar, se elimina la tensión del tendón de Aquiles a pesar de la posición que guarde la rodilla.
Las plaquetas tienen una vida media que oscila entre 8 y 12 días. Además de su intervención en la hemostasia, estas son reconocidas como una importante fuente natural de factores de crecimiento. Los componentes de los gránulos plaquetarios que se liberan durante su activación, influyen sobre otras células.
Las plaquetas crean el ambiente local (in situ) necesario para la regeneración tisular gracias a la liberación de proteínas secretadas por la activación de los gránulos alfa, además expresan y liberan sustancias que favorecen la reparación tisular e influyen en los procesos de angiogénesis, inflamatorios y respuesta inmune.12
El tiempo de exposición a los factores de crecimiento, a pesar de que es corto, es suficiente para actuar como detonador e iniciar una cascada de reparación tisular que se genera a través de ellos. Marx13 describe en el plasma rico en plaquetas al menos tres factores de crecimiento: el factor de crecimiento derivado de la plaqueta (PDGF, del inglés platelet derived growth factor), potente agente quimiotáctico que estimula la proliferación celular, el factor de crecimiento transformante β tipo 1 y 2 que estimula el depósito de matriz extracelular, y el factor vascular endotelial. Todos han demostrado desempeñar una actividad significativa en la regeneración y reparación del tejido conectivo.14
El coágulo se compone, además, de fibrina, fibronectina, y vitronectina, que son moléculas de adhesión celular requeridas para la migración celular como la que se aprecia en la osteoconducción y la epitelización de lesiones.13
López-Gavito ha demostrado que el uso de preparados plaquetarios cuando se decide iniciar un tratamiento quirúrgico es un buen coadyuvante, que reduce el riesgo de morbilidad para el paciente y propicia su incorporación a las actividades de la vida cotidiana de manera precoz.15
En la preparación del lisado, la desintegración plaquetaria se logra mediante crioconservación de las plaquetas entre 20 ºC y 80 ºC durante más de una hora y su descongelación posterior a temperatura ambiente momentos antes de su aplicación.
Cuando se realizan varios ciclos de congelación-descongelación ocurre una mayor liberación de las sustancias. Algunos autores han repetido estos ciclos de 6-12 veces, pero esta no es una conducta general.12,13
Lo más frecuente es emplear tres ciclos, con lo que se puede conseguir el 100 % de liberación de las proteínas bioactivas. Los buenos resultados funcionales en este caso se sustentan también en los criterios de Calder que sugiere que la rehabilitación temprana del movimiento en las lesiones tendinosas también ayuda a la estructuración del nuevo tejido colágeno.16