INTRODUCCIÓN
Desde que se descubrió que el feto en el interior del útero materno no está libre de los efectos de los medicamentos ingeridos por la madre, han sido muchas las investigaciones realizadas con el fin de descubrir las posibles interacciones de determinadas sustancias con la unidad feto-placenta.
En la actualidad, con el aumento de la producción de medicamentos, se ha incrementado la terapia medicamentosa a las embarazadas y se ha comprobado que casi todos los fármacos, en mayor o menor medida, son capaces de pasar al feto a través de la placenta condicionando alteraciones del desarrollo y del crecimiento fetal. De esta manera surge el peligro de una mayor influencia farmacológica y tóxica sobre las estructuras que aún no han madurado. Este riesgo se acentúa si dichos medicamentos son administrados en el período comprendido desde la cuarta hasta la octava o novena semana del embarazo, la clásica fase crítica en que ocurren las malformaciones congénitas.
Las consecuencias de las malformaciones congénitas no sólo son motivo de angustia y desaliento para los padres afectados, sino también para el futuro del nuevo ser y para la sociedad. Por ello, la prevención de las alteraciones fetales constituye un aspecto importante de la higiene prenatal. (1)
La placenta posibilita el intercambio de sustancias a través de la membrana placentaria interpuesta entre la circulación materna y fetal, presentando una actividad metabólica elevada, lo que permite la síntesis de proteínas, ácidos grasos y ácidos nucleicos a partir de sus elementos estructurales. Es por ello que dentro de la atención perinatal, se concibe como órgano de intercambio durante la vida embrionaria y fetal, por lo que recibe especial atención. Durante la vida intrauterina, el hígado fetal no es capaz de asumir procesos de transporte y de biotransformación por lo que es la placenta la que asume una función excretora, similar a la que desempeña el sistema hepatobiliar en el adulto. (2)
En los primeros meses de embarazo, la membrana placentaria sigue siendo gruesa, por tanto, su permeabilidad es escasa. En cambio más avanzado el embarazo, la permeabilidad aumenta debido al adelgazamiento de las capas difusas de la membrana y la supefcie llega a ser enorme debido a su mayor crecimiento. La difusión de sustancias alimenticias a través de la membrana placentaria como la glucosa, ácidos grasos, etc., se realiza gracias a la acción de moléculas transportadoras y a la existencia de un gradiente de concentración. De igual forma los productos de desechos como el dióxido de carbono, la urea, creatinina, acido úrico y otros que se forman en el feto, pasan también a la madre, y seguidamente, se eliminanan junto a los productos de excresión de ella. La placenta, además, forma especialmente grandes cantidades de gonadotrofinas coriónica humana, estrógenos, progesterona y somatomamotropina coriónica humana, de las cuales las tres primeras y probablemente la cuarta también, son esenciales para que el embarazo transcurra normalmente. (3)
Los medicamentos anticonvulsivantes son drogas cuyo consumo en la actualidad es bastante elevado. Es bien conocido que pueden pasar a la leche materna y atraviesan con facilidad la barrera placentaria, e incluso que sus niveles en el feto son muy parecidos a los alcanzados en la madre.
Se ha llegado a comprobar en estudios experimentales, una mayor incidencia de malformaciones en neonatos de madres bajo tratamiento con anticonvulsivantes. El fenobarbital, junto a la hidantoína es uno de los medicamentos más utilizados dentro de este grupo. Pertenece al grupo de los barbitúricos que han tenido amplio uso como drogas hipnosedantes, los cuales deprimen reversiblemente la actividad de los tejidos excitables. Se plantea que actúa sobre mecanismos inhibitorios mediados por ácido gammaaminobutírico (GABA), sustancia que constituye el principal neurotransmisor inhibitorio del Sistema Nerviosos Central, provocando la apertura de los canales de cloruro, lo que es la base de la inhibición pre y post sináptica. El medicamento se absorve alrrededor del 80 % de una dosis oral y se alcanzan niveles plasmáticos máximos en 16 a 18 horas. Entre el 45-50 % de la droga se une a las proteínas plasmáticas. La vida media aparente varía de 50 a 120 horas. Alrrededor del 65 % se metaboliza y un 35 % se excreta por el riñón sin modificaciones. Los barbitúricos deben ser usados con prudencia en caso de alteración de la función hepática o renal. Tampoco debe ser usado en mujeres en edad fértil porque no se ha establecido que sean inocuos durante el embarazo. (4)
Una de las enzimas que participa en el transporte de iones y de nutrientes por transporte activo, es la Adenosintrifosfatasa de sodio y potasio (ATPasa NA-K) dependiente, localizada en la membrana plasmática de las células placentarias del sincitiotrofoblasto así como en el intestino, riñón y glándulas uterinas; es más eficiente con valores de PH entre 8,5 y 9 y despliega su mayor actividad catalítica a una concentración de sustrato de 30 mmoles/l. Se ha demostrado que el magnesio (Mg) constituye un activador de esta enzima, y se sugiere que el uso de la enzima purificada sirva como un modelo para el estudio del transporte de iones durante el embarazo. Es además, fuertemente inhibida por el tiopental y por la ouabaína. Algunos estudios sobre corteza renal sugieren que durante la isquemia hay un aumento de la cantidad de esta enzima, que en el transcurso del tiempo no se expresa como aumento en la actividad (5).Tiene gran valor desde el punto de vista fisiológico, pues está implicada directa o indirectamente en los requerimientos energéticos del transporte de sodio y potasio a través de las membranas, y en la placenta, interviene en el proceso de transporte activo de diferentes metabolitos. (1)
Algunos trabajos basados en mecanismos de transporte iónico sugieren que la bomba de Na tiene un importante papel en los mecanismos de regulación de las resistencias periféricas vasculares.(6)
La bomba sodio-potasio se encuentra en todas nuestras membranas celulares. Su función es el transporte de los iones inorgánicos más comunes en biología (el sodio y el potasio) del medio extracelular al citoplasma. La bomba sodio-potasio ATPasa es una proteína de membrana que actúa como un transportador de intercambio antiporte (transferencia simultánea de dos solutos en diferentes direcciones) que hidroliza ATP. Es una ATPasa de transporte tipo P, es decir, sufre fosforilaciones reversibles durante el proceso de transporte. Está formada por dos subunidades, alfa y beta, que forman un tetrámero integrado en la membrana. La subunidad alfa está compuesta por ocho segmentos transmembrana y en ella se encuentra el centro de unión del ATP que se localiza en el lado citosólico de la membrana. También posee dos centros de unión al potasio extracelulares y tres centros de unión al sodio intracelulares que se encuentran accesibles para los iones en función de la fosforilación de la proteína. La subunidad beta contiene una sola región helicoidal transmembrana y no parece ser esencial para el transporte ni para la actividad ATPasa. La enzima está glucosilada en la cara externa (como la mayoría de proteínas de membrana) y requiere del magnesio como cofactor para su funcionamiento. (7)
Hay eventos asociados con el trabajo de parto que estimulan su actividad en las células del epitelio celular lo que posiblemente contribuya a eliminar el líquido pulmonar en el feto. (8)
Teniendo en cuenta la importancia que tiene conocer las reacciones adversas que pueden provocar los medicamentos en cuanto al desarrollo normal del feto, se realiza este trabajo, con el objetivo de evaluar el efecto in vitro del fenobarbital sobre la actividad de la ATPasa Na K dependiente de placenta humana.
MÉTODOS
Se realizó un estudio experimental (in vitro), descriptivo y prospectivo, para el cual se tomaron como muestra 30 placentas de madres que tuvieron un parto normal, y que fueron atendidas en el Hospital Provincial Docente Ginecobstétrico “Mariana Grajales” de Santa Clara. Como criterio de inclusión se tomó: con respecto al neonato, apgar dentro de límites normales y un peso superior a los 2 500 gramos; con respecto a la madre, no haber presentado ninguna enfermedad durante el embarazo y haber tenido parto fisiológico y a término. Para conocer y almacenar estos datos se realizó una encuesta a las madres.
Se analizó la actividad de la enzima ATP asa Na K dependiente en 20 placentas de madres normales, en presencia y en ausencia de fenobarbital, que fue añadido en el volumen de buffer, utilizado en cada técnica enzimática para obtener una concentración final en la mezcla de incubación de 0,1 mg/ml, 0,15 mg/ml y 0,2 mg/ml, para llegar a concentraciones cercanas por encima y por debajo de las que aparecen a nivel sanguíneo, con la dosis terapéutica a la cual se usa este fármaco. De esta manera, la muestra fue subdividida en 4 grupos, incluyendo un grupo NORMAL donde se mide la actividad enzimática sin añadir el fármaco estudiado.
Para determinar el tipo de inhibición que pudiera producir el fenobarbital sobre la actividad de la enzima en cuestión, se utilizaron las 10 placentas restantes, las cuales fueron sometidas a diferentes concentraciones de sustrato, en ausencia y en presencia del fenobarbital a la mayor concentración usada de este (0,2 mg/ml), calculando la Km por el método de Lineweaver Burk. (9)
Obtención de la muestra
Las placentas fueron recogidas después de los respectivos partos y colocadas en recipientes con agua destilada. Se mantuvieron en un baño de hielo mientras se les cambió el agua varias veces para eliminar la sangre, hasta que quedaron bien lavadas. Luego se tomaron pequeños fragmentos de tejido de la zona central y periférica de forma tal que se lograra una mayor representatividad de la placenta, los que fueron introducidos en un beaker con agua destilada, que fue cambiada aproximadamente cada 20 minutos a 4°C; se eliminó el agua destilada y se centrifugó tres veces con solución salina a 3000 RPM en una centrífuga refrigerada MSE-FISONS de procedencia inglesa, durante 10 minutos a 4°C. Por último, los tejidos fueron centrifugados tres veces con sacarosa (0,25 moles/l), y secados después con papel de filtro, quedando listos para ser pesados y homogeneizados.
Preparación del homogeneizado
El tejido placentario fue pesado y por cada gramo se le añadió 2,5 ml de sacarosa a 0,25 mol/l, agregándole 0,15 ml de Tritón X-100 al 0,1 % por cada 10 ml de sacarosa utilizada. Se homogeneizó a continuación en un homogeneizador de cuchillas MIM LE-402, conservándose el tejido en un baño de hielo para evitar la inactivación enzimática. Luego se procedió a la centrifugación del homogeneizado a 3000 RPM, durante 10 minutos y a 4°C para eliminar el tejido y obtener el sobrenadante necesario, que fue vertido en diferentes tubos de ensayos en cantidades de aproximadamente 2 ml y congelados en un freezer a –20°C.
Determinación de la actividad enzimática
Se determinó la actividad enzimática entre las 24 y 48 horas posteriores a la obtención del homogeneizado.
La actividad de la ATPasa Na K se realizó por el método de Post R. y Sen A. (10), para la determinación en placenta humana, basado en la inhibición de la enzima por la ouabaína. Para ello, fue introducida en tubo de ensayo, a 37°C y durante 30 minutos, la siguiente mezcla de incubación: 0,1 ml de ATP (30 mmoles/l), 0,1 ml de cloruro de potasio (0,5 moles/l), 0,1 ml de cloruro de sodio (2,5 moles/l), 0,2 ml de agua destilada y 0,1 ml de mezcla constituida por cloruro de magnesio (1,3 mmoles/l), tetra-acetato etilendiamino (1,3 mmoles/l), imidazol (50 mmoles/l) y glicil glicina (5 moles/l) añadiendo al final 1 ml de la enzima diluida uno en diez.
La actividad ATP asa inhibida por la ouabaína se determinó en otro tubo que contenía una mezcla de reacción similar, pero sin añadir cloruro de sodio y cloruro de potasio, sino 0,1 ml de agua destilada y 0,1 ml de ouabaína. Se preparó otro tubo con el blanco enzima al que se le añadió 0,5 mls de agua destilada, 1 ml de mezcla constituida por cloruro de magnesio, tetra-acetato etilendiamino, imidazol y glicil glicina a las mismas concentraciones mencionadas anteriormente y 1 ml de la enzima disuelta.
Posteriormente se frenó la actividad con 2,5 mls de ácido tricloroacético al 10 % centrifugando por 10 minutos a 3000 RPM. Se tomó 1 ml del sobrenadante y se pasó a otro tubo que contenía 2,3 mls de agua, añadiéndosele 0,5 mls de molibdato de amonio al 2,5 % y 0,2 ml de ácido alfa amino naftol sulfónico al 0,15 %. Se esperó 15 minutos y se leyó a 660 nanómetros.
El cálculo se realizó restando a la actividad total, la actividad ATP asa inhibida por la ouabaína y el fósforo inorgánico fue cuantificado por el método de Fisker Subbarow (11).
En todas las técnicas detalladas anteriormente se preparó un blanco agua para corregir las interferencias secundarias entre reactivos y material a investigar.
Las determinaciones de la actividad de la enzima se realizaron por duplicado y fueron leídas en un espectrofotómetro ruso C 0-46 ROMO.
Los datos fueron procesados a través del paquete estadístico SPSS y los resultados se muestran en tablas y gráficos.
RESULTADOS
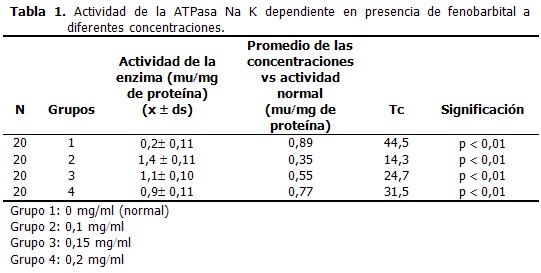
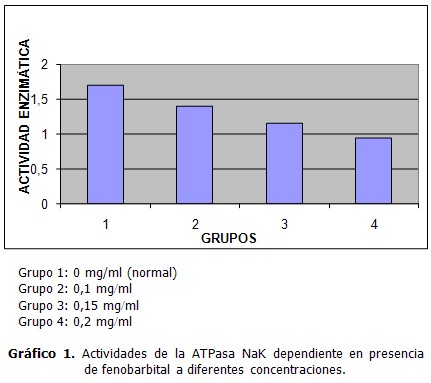
Pudo constatarse el efecto inhibitorio sobre la actividad de la enzima ATP asa Na K dependiente, expresada en MU por miligramos de proteína, cuando se puso en contacto con el fenobarbital a concentraciones de 0,1, 0,15 y 0,2 mg/ml (Grupos 1,2,3). (Tabla 1 y Gráfico 1)
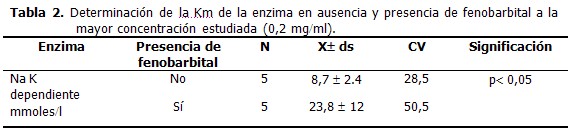
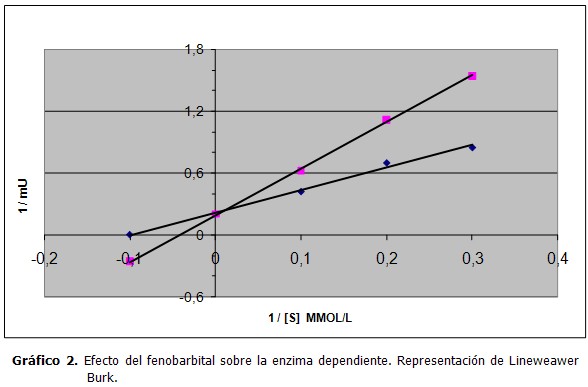
La Km en molesl en la enzima estudiada en ausencia y presencia del fenobarbital a la concentración máxima utilizada (0,2 mgml) mostró un incremento que solo fue significativo en el caso de la ATPasa Na K dependiente. (Tabla 2 y Gráfico 2)
DISCUSIÓN
La alta sensibilidad de la ATP asa Na K ante el fenobarbital, quedó evidenciada a través de la disminución de la actividad de la enzima dependiente, que con respecto a su actividad normal resultó ser una alteración significativa frente a todas la concentraciones del fármaco. El efecto inhibitorio del fenobarbital depende de su concentración, presentándose una mayor inhibición a medida que la dosis se incrementa con una ecuación de regresión (y=--3,85x 1,71 y con y=--0,99) cuya correlación es altamente significativa.
La ATP asa Na K dependiente participa en el transporte de sodio y potasio a través de las membranas, así como en el proceso de transporte activo de algunos nutrientes a través de la placenta (2). Existen evidencias de que en este órgano ocurre un transporte de aminoácidos mediado por un gradiente electroquímico de sodio. Este transporte resulta importante para las funciones metabólicas del trofoblasto y para la rápida satisfacción de los requerimientos metabólicos fetales, pues la mayoría de estos son transferidos a la circulación fetal; además, la propia placenta utiliza aminoácidos para la síntesis proteica y para sus requerimientos energéticos. En estas condiciones se ha visto que el control del PH es importante para optimizar la actividad enzimática.
Se ha comprobado la contribución del gradiente de Na para suplir las necesidades energéticas del feto y de la placenta, por la presencia en membranas vesiculares aisladas de placentas humanas a término, acúmulos de succinato asociados al transporte activo de sodio (6). Esto suscita particular interés si tenemos en cuenta que el succinato constituye un intermediario del ciclo de los ácidos tricarboxílicos, por lo que podemos plantear que el gradiente de sodio facilita intermediarios metabólicos para el consumo del feto y de la placenta.
Entre las funciones de la ATPasa Na K se plantea además ser responsable de la actividad eléctrica sugiriéndose que otros iones pueden ser transportados por este mecanismo.
Al estudiar el efecto del fenobarbital vemos que la actividad de la enzima disminuye, por lo tanto se imposibilitan las funciones de transportación de sustancias nutritivas y de iones durante el curso del embarazo, lo que puede conducir a la aparición de trastornos que interfieren en el buen desarrollo de todos los procesos biológicos que se desarrollan normalmente en esta etapa.
El efecto de la concentración de ATP en presencia y ausencia del fenobarbital, corresponde a una típica inhibición competitiva, la cual aumenta la Km de la enzima para el ATP en presencia del fármaco de forma significativa (10). La analogía estructural del ATP con este fármaco no es totalmente semejante por lo que sorprende este comportamiento y nos hace pensar que el fenobarbital es capaz de unirse al centro de la enzima, probablemente por sus grupos NH, más que por su carácter tautomérico; al estar unidos a un grupo C0 tienen gran actividad química y es posible además su inclusión en dicho grupo ya que el volumen de su molécula es mucho más pequeña que el ATP.
El uso de agentes específicos para grupos químicos en el centro activo, ha indicado que la histidina y el carboxilo son esenciales para la actividad catalítica de la enzima por lo que pudiera existir algún tipo de interacción entre los grupos NH del fármaco y el grupo carboxilo presente en este sitio.
Al realizar la búsqueda de bibliografía sobre el tema, no se encontraron reportes anteriores de estudios similares, los cuales hubieran sido útiles para la comparación de los resultados encontrados en nuestro trabajo. No obstante, los resultados de este estudio permiten afirmar que el fenobarbital produce disminución altamente significativa de la actividad ATP asa Na K dependiente, lo que afecta el transporte activo de los nutrientes a través de la placenta. Además, esta inhibición es de tipo competitiva y su mayor o menor grado dependerá de la dosis empleada del fármaco.
Por ello, sería recomendable limitar el uso del fenobarbital a situaciones críticas solamente, así como enfatizar en la divulgación de los efectos de este fármaco sobre la enzima por su repercusión en el metabolismo placentario y fetal.