INTRODUCCIÓN
Las técnicas de administración de anestesia en cirugía torácica han experimentado una evolución espectacular, son cada día más sofisticadas y con mayor fundamentación científica. En un principio se definieron y comprendieron las características generales del intercambio gaseoso a tórax abierto y sus bases fisiológicas; el problema del intercambio gaseoso se solucionó mediante el uso de ventilación controlada con presión positiva. La introducción de relajantes musculares, el desarrollo de los métodos de ventilación que permiten la separación de ambos pulmones, al mismo tiempo la mejor comprensión de las alteraciones de la distribución del flujo sanguíneo y de la ventilación, tanto en pacientes despiertos como en los anestesiados y sometidos a ventilación mecánica, en la posiciones decúbito supino y lateral han incrementado esta práctica quirúrgica con mejores resultados.
Una fuerte contribución ha sido la administración epidural de opiáceos, la crioanalgesia, que favorecen en gran medida que el periodo posoperatorio transcurra sin dolor y minimizan las complicaciones.
El propósito de este folleto es brindar los sustentos teóricos actualizados para la cirugía torácica, el cual servirá de material complementario para la docencia a residentes en formación y especialistas de Anestesiología y Reanimación.
ESTRUCTURA DEL FOLLETO
CAPÍTULO I. ELEMENTOS DE LA EVALUACIÓN PREOPERATORIA EN CIRUGÍA TORÁCICA- Valoración preoperatoria
- Pruebas prácticas de ejercicio
- Evaluación de la resección de pulmón
- Preparación preoperatoria
- Monitorización
- Posición del paciente
- Ventilación de un pulmón
- Manejo anestésico de la ventilación de un pulmón
- Efectos de los anestésicos sobre la vasoconstricción pulmonar hipóxica
- Inducción de la anestesia
- Mantenimiento de la anestesia
- Recomendaciones acerca de la inducción anestésica, agentes anestésicos y mantenimiento de la anestesia.
- Crioanalgesia
- Administración epidural de opiáceos
- Anestesia regional interpleural
- Procedimientos específicos
- Complicaciones cardiovasculares
- Complicaciones respiratorias
CAPÍTULO I. ELEMENTOS DE LA EVALUACIÓN PREOPERATORIA EN CIRUGÍA TORÁCICA
Valoración preoperatoria
La mayoría de las operaciones del tórax se relacionan con la resección de tejido pulmonar debido a afecciones diversas, muy común por la presencia de tumores. La valoración, por lo tanto, se debe de enfocar sobre la severidad de la enfermedad pulmonar y la repercusión sobre el sistema cardiovascular. Se deben considerar dos factores muy importantes cuando se valora un paciente para resección pulmonar. El primero es valorar la extensión de la resección que puede ser tolerada sin provocar insuficiencia pulmonar. El segundo es el estado de la vasculatura pulmonar después de la resección, para prevenir el desarrollo de una hipertensión pulmonar. La hipertensión pulmonar se puede exacerbar por factores que aumentan la resistencia vascular pulmonar, tales como la acidosis, hipoxia y la hipercarbia. La presión pulmonar elevada puede causar falla ventricular derecha.
La valoración de los pacientes que van a ser intervenidos no puede realizarse sin el conocimiento del riesgo específico que este tipo de cirugía conlleva. Actualmente el porcentaje de complicaciones respiratorias asociadas al periodo perioperatorio oscila entre un 15- 20 % y mortalidad entre un 3- 4 %; la posibilidad de complicaciones cardíacas, que son las segundas en frecuencia, se sitúa entre un 10- 15 %.
Para que un paciente diagnosticado de cáncer de pulmón pueda ser tratado quirúrgicamente, deben cumplirse dos requisitos en la valoración preoperatoria; el primero, que la cirugía pueda ser oncológicamente satisfactoria (criterios de resecabilidad) y el segundo, que la calidad de vida tras el tratamiento pueda ser aceptable (criterios de operabilidad).
Forman parte de criterios de resecabilidad, todas aquellas pruebas (TAC, broncoscopia, mediastinoscopia, citología de esputo) que tratan de determinar la extensión de la tumoración, la presencia de adenopatías y/o metástasis y el diagnóstico histológico. Su resultado permite determinar el estadio de la lesión y la indicación o no del tratamiento quirúrgico. Tras este proceso, solo el 35 % de los pacientes diagnosticados podrán ser candidatos a cirugía de resección pulmonar.
Los criterios de operabilidad, valoran no solo la cantidad de parénquima que queda tras la intervención propuesta y su eficacia en la realización del intercambio gaseoso, sino también si el corazón es capaz de tolerar dicho esfuerzo. La valoración se obtiene mediante la información que proporciona la anamnesis, la exploración física, la analítica, las pruebas de función pulmonar y actualmente también, las pruebas de esfuerzo. Cuando se aplica este segundo criterio, solo el 20 % de los pacientes diagnosticados de carcinoma broncopulmonar (CBP), podrán recibir tratamiento quirúrgico y por tanto, solo ese pequeño porcentaje de pacientes van a tener posibilidades de curación.
Cuando nos encontramos ante un paciente que va a ser intervenido de cirugía de resección pulmonar, debe tenerse en cuenta que:
- la extirpación de una cantidad de parénquima pulmonar más o menos amplia, afecta al intercambio gaseoso, alterando la función pulmonar con carácter irreversible y teniendo que asumir el pulmón restante la eficacia de esta función.
- la mayoría de estos pacientes presentan además, algún tipo de enfermedad pulmonar subyacente (EPOC en el 90% de los casos), por lo que la eficacia de la función respiratoria tras la cirugía va a depender de un parénquima alterado o enfermo.
- el acto quirúrgico va a provocar una agudización de su enfermedad pulmonar. Intraoperatoriamente, el decúbito lateral, la anestesia, la cirugía y la necesidad de colapso pulmonar, producen una alteración en la relación ventilación perfusión (V/Q), con tendencia a la hipoxemia, disminución de la capacidad residual funcional (CRF) y edema intersticial difuso. Durante el posoperatorio, la disminución de la CRF estará incrementada por el dolor y la aparición de posibles atelectasias, habiéndose demostrado que la disminución de los volúmenes pulmonares, se sitúa alrededor de un 50 % durante las primeras 24 h y se mantienen alterados entre una o dos semanas.
De todo ello se deduce que la atención del anestesiólogo durante la valoración preoperatoria se centra en la evaluación global del estado cardiorrespiratorio, intentando predecir su respuesta frente a la resección y la tolerancia a ella. La identificación de los pacientes con riesgo elevado y la previsión de posibles complicaciones, permitirán la instauración de un tratamiento preoperatorio que optimice el estado físico del paciente ante la cirugía y la planificación tanto de la anestesia, como de las necesidades durante el posoperatorio inmediato.
La información necesaria para la evaluación de los pacientes se extrae de los datos que proporciona la valoración clásica y de los que proporcionan las pruebas específicas de función cardiopulmonar. (Gráficos 1 y 2)
Pruebas prácticas de ejercicio
Son pruebas de fácil realización, que no requieren equipamiento y que sin embargo se relacionan muy bien con las pruebas ventilatorias, cardiovasculares y con el pronóstico de complicaciones perioperatorias (con valor igual o incluso superior al de la espirometría). Por ello, un grupo de expertos pueden tomar la decisión de operar, respaldados por estas pruebas, aun en casos con espirometría dudosa o prohibitiva (valores limítrofes, mala cooperación del paciente).
- Prueba de marcha: satisfactoria si el paciente camina más de 300 metros en 6 minutos.
- Prueba de escaleras: satisfactoria si el paciente sube a velocidad normal y sin detenerse más de 44 escalones (generalmente más de dos tramos de escaleras).
Evaluación de la resección de pulmón
Es muy importante valorar qué cantidad tejido pulmonar se puede resecar sin comprometer la fisiología del paciente, para evitar complicaciones posoperatorias como disnea, hipertensión pulmonar, cor-pulmonale e insuficiencia respiratoria. Las pruebas de función pulmonar y los gases en sangre son los principales exámenes. (Tabla 1)
Cálculo de la función ventilatoria posterior a la resección
Es importante determinar el pronóstico de la función ventilatoria posoperatoria, para precisar si la función residual será o no compatible con la vida. Esto se puede hacer por diversas fórmulas, a partir de los resultados espirométricos, en particular el valor de VEF 1 seg, que es el parámetro individual más fiable.
Existen varias fórmulas para calcular la función pos-resección pulmonar, sobre todo en lobectomías. En las neumonectomías, desde el punto de vista práctico puede considerarse que la neumonectomía derecha provoca una pérdida del 55 % respecto al VEF en 1 seg. preoperatorio y la neumonectomía izquierda un 45 %. (Cuadro 1)
Preparación preoperatoria
El propósito de la preparación preoperatoria en el paciente sometido a cirugía torácica, es la reducción de la morbilidad y la mortalidad perioperatoria. La cirugía torácica tiene mayor riesgo que la cirugía general, por dos razones, primero: las complicaciones respiratorias posoperatorias son mayores, la mayoría de los pacientes tiene historia de tabaquismo, lo que causa de cuatro a seis veces aumento en la incidencia de complicaciones pulmonares; segundo: como consecuencia de la cirugía torácica, la función pulmonar total puede estar alterada, por resección de pulmón, trauma del pulmón, atelectasia y edema. Además el dolor asociado a la toracotomía es frecuentemente severo y produce que los pacientes no respiren profundamente y no tosan en el posoperatorio; esto puede producir retención de secreciones, atelectasias y neumonía. Las complicaciones respiratorias como neumonía y atelectasia ocurren en 63 % de las operaciones torácicas o de abdomen superior versus 15 a 19 % en cirugía del abdomen bajo y 1 % en otro tipo de cirugía.
Múltiples intervenciones se han intentado para disminuir la morbimortalidad postoperatoria asociada a la cirugía torácica. Afortunadamente, las intervenciones preoperatorias para preparar al paciente han demostrado que disminuye la incidencia de complicaciones pulmonares posoperatorias. Estas incluyen dejar de fumar, terapia broncodilatadora, antibióticos, maniobras para sacar las secreciones y educación en la ventilación posoperatoria.
Maniobras de preparación pulmonar preoperatoria
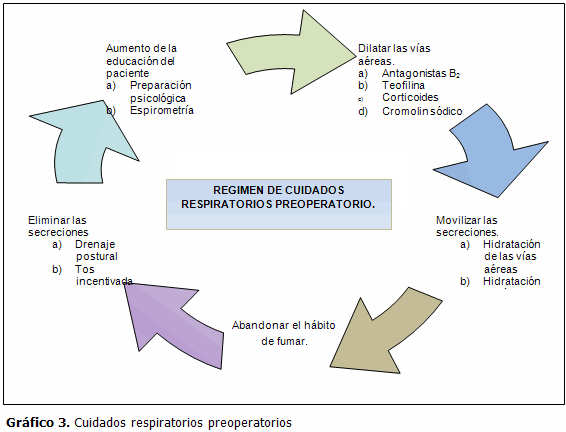
Los datos antes mencionados señalan que los pacientes sometidos a cirugía torácica son especialmente susceptibles a las complicaciones pulmonares posoperatorias y las medidas profilácticas son útiles para disminuir la incidencia de estas. (Gráfico 3)
Dejar de fumar
Aproximadamente 33 % de los pacientes adultos que se presentan para cirugía son fumadores. Los fumadores tienen de cuatro a seis veces más complicaciones.
Dejar de fumar por más de cuatro a ocho semanas antes de la cirugía se asocia a una disminución en la incidencia de complicaciones respiratorias. Desafortunadamente no se ha demostrado mejoría cuando se suspende el fumar por poco tiempo cuando se comparan con los que continúan. Cuando dejan de fumar por poco tiempo esto les puede producir aumento en la ansiedad, más secreciones y más incidencia de trombosis de venas profundas. La mayoría de los médicos recomiendan dejar de fumar por lo menos 24 horas antes de la cirugía.
Broncodilatadores
La terapia con broncodilatadores, como parte de un régimen general que incluye dejar de fumar, antibióticos, drenaje postural, fisioterapia pulmonar, puede disminuir la morbilidad posoperatoria y los días de estancia hospitalaria. Es recomendable que todos los pacientes con enfermedad de la vía aérea se preparen óptimamente antes de la anestesia y la cirugía.
Los pacientes con historia de asma con tratamiento crónico y que están asintomáticos deben de continuar su tratamiento durante el periodo perioperatorio.
Metilxantinas
Las metilxantinas son inhibidores de la fosfodiesterasa y por lo tanto producen acumulación de adenosin monofosfato cíclico (AMPc) que produce dilatación del músculo liso.
Los efectos colaterales incluyen náusea, vómito, diarrea, dolor de cabeza, taquicardia y arritmias. Algunos fármacos como la cimetidina disminuyen el metabolismo de la teofilina y pueden aumentar los niveles del fármaco en el plasma.
Agonistas beta-adrenérgicos
Los receptores adrenérgicos se encuentran en todo el cuerpo y en el músculo liso bronquial. La activación de los receptores adrenérgicos beta 2 causa la formación de AMPc que produce relajación bronquial, modulando el efecto del calcio intracelular.
Catecolaminas
Las catecolaminas como la epinefrina y los agentes sintéticos como el isoproterenol y la isoetarina son agentes que se metabolizan rápidamente por la catecol-O-metil transferasa y la monoamino oxidasa se han usado para tratar el broncoespasmo.
Corticosteroides
Los corticosteroides han probado su eficacia en el asma y se han usado en muchos procesos inflamatorios pulmonares.
CAPÍTULO II. INTRAOPERATORIO EN CIRUGÍA TORÁCICA
Monitorización
El mantenimiento de una adecuada oxigenación y ventilación es esencial en anestesiología y terapia intensiva. La vigilancia de la oxigenación con oximetría de pulso es vital; la tensión de oxígeno transcutáneo, la oximetría en la arteria pulmonar y la capnografía son importantes en la anestesia para cirugía de tórax.
Monitorización invasiva
La determinación de la presión arterial invasiva y no invasiva, la presión venosa central y la monitorización de la presión arterial pulmonar, con fracción de eyección del ventrículo derecho y la ecocardiografía transesofágica son los más frecuentemente usados
Posición del paciente
Los pacientes sometidos a cirugía torácica presentan muchos retos para el anestesiólogo. La posición del paciente en la mesa de operaciones es de vital importancia.
Posición decúbito lateral
La posición decúbito lateral es la más comúnmente usada en cirugía de tórax; deben de protegerse todos los puntos de contacto con la mesa para prevenir lesión de nervios.
Ventilación de un pulmón
El uso de los tubos modernos de doble lumen y los bloqueadores bronquiales, combinado con el broncoscopio de fibra óptica para ayudar a confirmar la posición del tubo, ha hecho que la separación funcional de los dos pulmones sea no solo segura sino relativamente fácil para los anestesiólogos.
La indicación original de separación de los pulmones fue la prevención de la diseminación de secreciones y de infecciones de un pulmón a otro. Además de la protección de la contaminación, existen otras razones clínicas para separar los pulmones, como: la fístula broncopleural, lavado broncopulmonar, drenaje de empiema, control de hemorragia bronquial, cirugía de bulas gigantes y toracoscopias asistidas por video.
El tubo univent
Recientemente, un nuevo bloqueador bronquial, el tubo univent, se ha usado para cirugía pulmonar con excelentes resultados. Consiste en un tubo convencional con un lumen que contiene un tubo delgado movible en su interior; este tubo delgado tiene un balón en la punta de baja presión y alto volumen que sirve para bloquear el bronquio cuando se infla. El bloqueador puede avanzar 8 cm más allá de la punta del tubo endotraqueal.
Tubos de doble lumen
Actualmente los tubos de doble lumen son los más usados para separar los pulmones en adultos. Los tubos modernos son seguros, fáciles de usar; no es necesario realizar la broncoscopia sistemáticamente a todos los pacientes, mientras que el bloqueador bronquial siempre necesita de un broncoscopio.
Izquierdo vs. derecho
Muchos anestesiólogos, prefieren el tubo izquierdo para ambas toracotomías, derecha o izquierda. Por otro lado, algunos anestesiólogos prefieren intubar el bronquio del pulmón que se va a operar.
Manejo anestésico de la ventilación de un pulmón
Lo más importante en la anestesia torácica es el uso de los tubos de doble lumen y la ventilación de un pulmón.
Fisiopatología de la ventilación unipulmonar
Si algo caracteriza a la cirugía torácica en general, es que en la mayoría de los procedimientos, para que la intervención pueda realizarse, debe mantenerse el pulmón del hemotórax quirúrgico colapsado. Sin embargo, dicho colapso no es el único responsable de los cambios en la fisiología respiratoria durante la cirugía, sino que las alteraciones de la relación ventilación perfusión serán consecuencia de un conjunto de factores entre los que se encuentran el decúbito lateral, la anestesia, la toracotomía y por supuesto el colapso pulmonar y la necesidad de ventilar un solo pulmón (OLV), para obtenerlo.
Factores que afectan la ventilación
Mientras que la presión alveolar (PA) se mantiene constante en todo el pulmón, la presión negativa interpleural (Ppl) que es la responsable de su expansión, está sometida a la acción de la fuerza de gravedad que actúa creando un gradiente de presión en sentido vertical, de modo que la negatividad disminuye 0,25 cm H2O/cm desde el apex a las bases. Este hecho provoca que los alveolos de los vértices estén más expandidos que los de las bases, los cuales presentan un volumen al final de la espiración que corresponde aproximadamente a 1/4 de los primeros. Sin embargo, como la PA es constante, se genera una presión transpulmonar (PA-Ppl) que es superior es las bases, por lo que los alveolos declives tienen una mayor distensibilidad o compliance.
De lo expuesto hasta ahora se concluye que en un paciente despierto, en bipedestación y ventilando espontáneamente, los alveolos apicales están más insuflados pero son poco distensibles mientras que los de las bases están más comprimidos pero son muy distensibles; por ello, el mayor volumen corriente corresponde a las zonas declives que son las que mantienen la mayor eficacia en la ventilación alveolar, para una misma presión.
El decúbito lateral (DL) no modifica lo expresado hasta ahora, simplemente el pulmón superior o proclive será el que se sitúa en la parte de la curva con menos pendiente (superior), mientras que el inferior o declive se situará en la zona de mayor pendiente y recibirá por tanto el mayor % de ventilación alveolar. Este hecho se encuentra, además, favorecido por la curvatura que adopta el diafragma en el pulmón inferior. Sin embargo, en el paciente anestesiado, relajado y ventilado mecánicamente, se produce una disminución de la capacidad residual funcional (CRF). Esta pérdida de volumen, unida a la relajación del diafragma y a la presión que sobre el pulmón declive ejercen las estructuras del mediastino y la masa abdominal, trasladan el pulmón proclive o superior a las zonas de mayor pendiente de la curva, es decir a las más favorables, produciéndose la primera alteración de la relación V/Q, ya que mientras el pulmón declive recibirá el mayor flujo sanguíneo, el superior recibe la ventilación más eficaz.
Si añadimos a estas alteraciones la apertura del tórax, se favorecerá la distensibilidad del pulmón superior, acentuándose la eficacia de la ventilación alveolar en dicho pulmón y las alteraciones de la relación V/Q.
Factores que afectan la perfusión
La perfusión pulmonar responde por completo a las leyes de la gravedad, pero también, y en segundo lugar, al fenómeno de vasoconstricción pulmonar hipóxica.
Cambios en la perfusión según la gravedad: el ventrículo derecho bombea sangre a las arterias pulmonares (Ppa), con una energía cinética que es capaz de vencer el gradiente hidrostático vertical. Sin embargo y debido a la acción de la gravedad, la presión disminuye 1,25 mmHg por cada cm. de altura. Si añadimos que la circulación pulmonar es un sistema de baja presión, la perfusión (Q) dependerá de los gradientes de presión generados entre la presión alveolar (PA), la presión arterial pulmonar (Ppa) y la presión venosa pulmonar (Ppv). Este hecho origina grandes diferencias en la perfusión del pulmón permitiendo distinguir tres zonas, que en el paciente en bipedestación corresponden al apex, la parte media y las bases respectivamente.
En los vértices o zona 1, la PA > Ppa; por lo tanto no hay perfusión, pero sí ventilación. En estas situaciones, hablamos de "espacio muerto" (VD) que en condiciones normales es mínimo,
En la zona 2, la Ppa > PA > Ppv, por lo que la perfusión dependerá de la diferencia entre la (Ppa - PA).
En la zona 3, la Ppa > Ppv> PA, esto significa que la Q es función de la diferencia (Ppa - Ppv), pero como ambas presiones sufren la misma variación en relación con la gravedad, la presión de perfusión será K. Sin embargo como la presión transmural de los vasos (Ppa-Ppl) y (Ppv-Ppl) aumenta hacia las zonas basales, el flujo también.
Alteraciones secundarias a la ventilación unipulmonar
Todas las medidas van dirigidas a optimizar la ventilación, de forma que el aumento del cortocircuito, la hipoxemia secundaria, la hipercapnia y el aumento de presión de la vía aérea no pongan en peligro al paciente durante la cirugía.
Como siempre empezamos por los procedimientos más sencillos y si la respuesta a los mismos es insuficiente, se instauran otros más complicados de forma paulatina. Las medidas según lo descrito serán:
1. Comprobar que la posición del tubo de doble luz es correcta.
2. Mantener ambos pulmones ventilados durante el máximo tiempo posible (apertura de la pleura).
3. Modificar los parámetros ventilatorios del pulmón ventilado selectivamente:
- FiO2 al 100 %.
- Mantener un volumen nidal, si es posible, entre 6-8 ml/kg.
- Conseguir una frecuencia respiratoria que mantenga una PaCO2 aceptable.
- Ventilación mecánica controlada por presión o volumen, dependiendo de las presiones de la vía aérea.
4. Si la hipoxemia se mantiene o incrementa:
- Comprobar con el fibrobroncoscopio que la posición del tubo de doble luz, o del sistema que hayamos elegido para realizar la OLV, es correcta.
- Comprobar que hemodinámicamente no hay ningún problema.
- Administrar una presión positiva continua (CPAP) de O2, o bien HFJV al pulmón no ventilado. De esta forma se consigue que parte de la sangre en ese pulmón pueda oxigenarse.
- Añadir PEEP al pulmón ventilado. En este caso aunque el aumento de la presión de las vías aéreas pueda desviar el flujo hacia el pulmón colapsado, como este recibe un aporte de O2 continuo por la CPAP o la HFJV, la sangre se oxigenará igualmente.
- Ventilar ambos pulmones (reclutamiento) hasta recuperar la PaO2.
- En los casos de neumonectomía, realizar lo antes posible el clampaje de la arteria pulmonar. Esta medida es la que elimina el cortocircuito, pero en pacientes críticos, puede ser mal tolerada por la sobrecarga que para el corazón derecho significa.
Indicaciones de la ventilación unilateral
Las indicaciones para la ventilación de un pulmón se clasifican en absolutas y relativas. Recientemente la popularidad de la toracoscopia ha aumentado considerablemente el número de procedimientos como la biopsia pulmonar, exploración pleural, resección en cuña, resección de nódulos solitarios, en la mayoría de estos casos se necesita anestesia general y tubo de doble lumen.
Cortocircuito pulmonar
Hay que tener en mente que en la posición lateral 40 % del gasto cardíaco perfunde el pulmón de arriba y 60 % perfunde el pulmón de abajo. El grado de cortocircuito depende de la vasoconstricción pulmonar hipóxica (VPH), que es un reflejo protector por medio del cual la vasoconstricción envía el flujo de sangre lejos de la parte hipóxica del pulmón, hacia el pulmón ventilado, para disminuir la mezcla venosa. Típicamente, sin inhibir la vasoconstricción pulmonar hipóxica, el cortocircuito a través del pulmón no dependiente (arriba) es aproximadamente 23 %.
Elección del fármaco y técnicas anestésicas
La elección del fármaco y de la técnica anestésica en la gran mayoría de los casos de cirugía de tórax se basa en la valoración preoperatoria de la función cardiopulmonar.
Por ejemplo: los anestésicos halogenados pueden prevenir o disminuir el broncoespasmo, pero al mismo tiempo pueden disminuir la contractilidad miocárdica, mientras que los narcóticos la pueden preservar. Los anestésicos halogenados son los más potentes fármacos anestésicos broncodilatadores usados en la actualidad y deben ser considerados de elección en pacientes con vía aérea reactiva.
El isoflurano es la mejor elección por varias razones:
- Tiene un umbral alto para las arritmias (en contra del halotano que sensibiliza al miocardio a las catecolaminas y se asocia a arritmias ventriculares).
- El isoflurano no se metaboliza tanto como el halotano.
- Mejor estabilidad hemodinámica.
- Es eficaz para tratar el broncoespasmo no severo.
La lidocaína administrada inmediatamente antes de la intubación (1-2 mg/kg iv) es un fármaco muy útil en la prevención de la broncoconstricción refleja y el laringoespasmo provocado por la instrumentación de la vía aérea; la infusión de lidocaína 1-3 mg/kg hora puede ser útil para disminuir la reactividad de la vía aérea.
La lidocaína intravenosa también disminuye significativamente la incidencia de laringoespasmo que se define como el aumento de la presión intraglótica de 45±15 mm Hg por 61±19 seg.
La neostigmina, fisostigmina y pridostigmina son inhibidores de la colinesterasa que pueden producir un aumento en la resistencia de la vía aérea.
Efectos de los anestésicos sobre la vasoconstricción pulmonar hipóxica (Tabla 2)
La vasoconstricción pulmonar hipóxica (VPH) es, después de la gravedad, el fenómeno que más modifica la perfusión. Se trata de un mecanismo de autorregulación cuyo detonante es la hipoxia alveolar y cuya respuesta es una vasoconstricción de la zona afectada que permite el desvió del flujo hacia zonas bien ventiladas, así se disminuye el cortocircuito y mejora la oxigenación arterial.
La VPH solo es efectiva para determinados porcentajes de hipoxia pulmonar (30-70 %), y si la musculatura lisa de los vasos pulmonares es capaz de responder ante la disminución de O2. Entre las causas de hipoxemia encontramos: la disminución de la FIO2, hipoventilación y las atelectasias. En relación con la respuesta vascular, su anulación puede ser debida a fármacos vasoactivos, algunos agentes anestésicos (halogenados) y las alteraciones en la hemodinámica pulmonar (PAP, RVP, PvO2).
La importancia de la VPH para corregir la hipoxemia se pone de manifiesto durante la ventilación selectiva, ya que es capaz de reducir el flujo que se dirige al pulmón superior en un 50 %, como se verá más adelante.
Inducción de la anestesia
Se preoxigena al paciente haciendo que respire espontáneamente oxígeno al 100 % mediante una mascarilla conectada a un circuito anestésico circular. Se administra luego fentanil por vía intravenosa hasta conseguir una frecuencia respiratoria de aproximadamente 8-10 min. Por lo general, ello se corresponde con una dosis de 3-10 mg/kg que suele administrarse en un plazo de varios minutos. Cuando la frecuencia respiratoria es relativamente lenta y comienza a desaparecer la capacidad del paciente para responder a las órdenes del anestesiólogo, se administra una pequeña dosis de tiopental sódico (2-3 mg/kg) o de ketamina (1,0-2,0 mg/kg), para conseguir de este modo la inconsciencia y, por lo tanto, también la apnea. Se establece entonces el control de las vías respiratorias y se inicia la ventilación administrando, con mascarilla, oxígeno a presión positiva intermitente. Con el paciente ventilado a presión positiva, se suministran luego concentraciones de isoflurano del 0,5 al 2,5 %. Inicialmente se utiliza la concentración de isoflurano más alta durante un corto periodo (hiperpresión, 1-2 min); después, a medida que el paciente demuestra signos de aumento de la profundidad de la anestesia, se va disminuyendo la concentración inspiradora de isoflurano.
Teniendo en cuenta que los anestésicos generales reducen de forma importante la respuesta ventilatoria al anhídrido carbónico (en grado mucho mayor en los pacientes con alteraciones ventilatorias mecánicas que en los pacientes normales), no se permite que respiren espontáneamente hasta el final del procedimiento; se han observado grados alarmantes de hipercapnia cuando se permitió que el paciente respirara espontáneamente en circunstancias similares.
En las primeras fases del periodo de ventilación a presión positiva con isoflurano, se induce la relajación mediante un relajante muscular no despolarizante. La aparición de una relajación completa se valora mediante un monitor del bloqueo neuromuscular. Durante el periodo de profundización de la anestesia con isoflurano y de instauración de la relajación, la presión arterial se controla mediante la infusión de aproximadamente 10 ml/kg de cristaloides y, si es necesario, de pequeñas dosis de agentes vasopresores.
Cuando el anestesiólogo juzga que el paciente está adecuadamente anestesiado (estadio quirúrgico) mediante la valoración de los cambios en la presión arterial, la frecuencia cardiaca y los signos oculares (los ojos deben estar centrados, con la mirada conjugada, fijos, quietos, sin lágrimas y con midriasis) y cuando se ha realizado una relajación muscular en la forma descrita, se procederá a la administración intravenosa de 1 mg/kg de lidocaína, se practicará la laringoscopia, se pulverizará el árbol traqueobronquial mediante un anestésico tópico laringotraqueobronquial y se intubará la tráquea del paciente con un tubo de doble luz. La lidocaína intravenosa e intratraqueal debe disminuir la respuesta cardiovascular y de las vías aéreas a la intubación endotraqueal. Acto seguido se procede a la ventilación del paciente y la administración, a dosis de mantenimiento, de isoflurano, opiáceos y relajantes musculares. El mantenimiento de la relajación muscular disminuye las necesidades de isoflurano y posiblemente, permite también un despertar más rápido de la anestesia.
Mantenimiento de la anestesia
La anestesia se mantiene con isoflurano (aproximadamente a una concentración de 0,5-1,0 CAM) y con opiáceos. El isoflurano se utiliza sobre todo si existen expectativas razonables de que podrá extubarse al paciente dentro de las dos horas posteriores al término de la operación. En cambio, los opiáceos (fentanil) se emplean si se juzga que el paciente no podrá ser extubado en el periodo posoperatorio inmediato y que requerirá durante bastante tiempo la ventilación posoperatoria. Los relajantes se administran a pequeñas dosis para mantener el bloqueo neuromuscular (lo cual se valora mediante un monitor del bloqueo) cerca de un nivel de relajación de 90 %. Si existen posibilidades razonables de que pueda extubarse al paciente antes de una hora del término de la operación, se le colocará en decúbito supino, se cambiará el tubo de doble luz por otro de una sola luz, se revertirá la relajación muscular y se permitirá la aparición de una respiración espontánea.
Mientras el paciente respira espontáneamente, el fentanil se administra a dosis crecientes muy pequeñas (0,3 mg/kg). El objetivo de la administración de fentanil es conseguir que, una vez finalizada la operación, el paciente respire con profundidad, y con una frecuencia relativamente lenta (más o menos de 10 a 12 min). La existencia de un nivel moderado de opiáceos permite que el paciente pueda ser trasladado a la sala de recuperación para efectuar allí una ventilación mecánica de breve duración (si es necesario), y poder así realizar el destete y la extubación de modo relativamente suave.
Recomendaciones acerca de la inducción anestésica, agentes anestésicos y mantenimiento de la anestesia
Anestésicos inhalatorios
La anestesia general con ventilación mecánica es el método más seguro para los pacientes. Puede utilizarse una gran variedad de técnicas de administración de anestesia general, pero se recomienda emplear los anestésicos halogenados, por varias razones:
- Tienen efecto ventajoso sobre la irritabilidad de las vías aéreas.
- Pueden bloquear formas específicas de broco-constricción.
- Efecto broncodilatador inespecífico relacionado con la profundidad anestésica.
- Deprime los reflejos de las vías respiratorias en pacientes con hiperactividad de la vía aérea.
- Permite suministrar una FiO2 alta sin perder por ello profundidad de la anestesia.
- El uso de óxido nitroso implica la necesidad de una reducción importante de la FiO2, aumenta la posibilidad de aparición de hipoxia sobre todo si se emplea la ventilación a un solo pulmón.
- Como los anestésicos halogenados volátiles pueden ser eliminados con rapidez, es posible disminuir los problemas de hipoventilación posoperatorios en los pacientes extubados.
- A la dosis clínica habitual, cerca de una concentración alveolar mínima (CAM), los anestésicos halogenados proporcionan un grado razonable de estabilidad cardiovascular.
- No produce disminuciones mayores de la PaO2 que los anestésicos inhalatorios.
Anestésicos intravenosos
Opiáceos, especialmente el fentanilo:
- No provoca efectos hemodinámicas adversos de importancia y por lo tanto es útil en los pacientes con cardiopatías.
- Permite al paciente intubado una transición suave de la situación operatoria al periodo posoperatorio.
- Disminuye la cantidad de anestésicos halogenados necesarios para alcanzar planos quirúrgicos en la anestesia.
- La dosis moderada o altas de opiáceos junto con halogenados permite el empleo de una FiO2 alta sin perder por ello la profundidad anestésica.
- No disminuye la vasoconstricción pulmonar hipóxica (VPH) regional, por lo cual deberán permitir el logro de una oxigenación óptima durante la ventilación a un solo pulmón.
En combinación con el óxido nitroso y un relajante muscular, también se ha utilizado la ketamina. Aunque habitualmente no se emplea este agente en cirugías electivas, la ketamina es útil:
- Para la inducción de la anestesia general en pacientes en estado crítico sometidos a intervención urgente de cirugía torácica.
- Tiene propiedades simpático-miméticas.
- Deprime la función cardiovascular (presión arterial y contractilidad) si el grado de hipovolemia es importante y el paciente tiene las reservas simpáticas agotadas.
- Comienzo de acción rápido, puede utilizarse con seguridad junto a la presión cricoidea, para la inducción de la anestesia en pacientes con estómago lleno.
- No altera la oxigenación arterial durante la ventilación a un solo pulmón, quizás debido a la falta de efectos sobre la VPH.
Anestesia para cirugía toracoscópica
La toracoscopia es un procedimiento que Jacobaeus introdujo en 1910 para el diagnóstico y tratamiento de los derrames pleurales secundarios a tuberculosis. En la actualidad la toracoscopia se emplea para el diagnóstico de los derrames pleurales, biopsias pulmonares y valoración preoperatoria de las lesiones malignas primarias del pulmón y de la pleura. Otras indicaciones incluyen resecciones esofágicas, ligadura del conducto arterial persistente, así como en la identificación del origen de una fístula broncopleural.
En tiempos más recientes también se usa para maniobras terapéuticas, como para remoción de cuerpos extraños intratorácicos del tipo de los trozos de catéter y gasas quirúrgicas. Otros usos terapéuticos de la toracoscopia incluyen pleurodesis química para neumotórax recurrente y tratamiento de empiemas. También se utiliza para valorar el grado de traumatismo y algunas veces para controlar vasos hemorrágicos. Jones y colaboradores publicaron que la toracoscopia de emergencia evitó una toracotomía innecesaria en 16 de 36 pacientes (44 %) con traumatismo torácico.
La toracotomía convencional se relaciona con un importante número de casos de morbilidad y mortalidad posoperatorias, sobre todo en paciente de alto riesgo con enfermedad cardiopulmonar avanzada. Los individuos inmunodeprimidos y con cáncer sometidos a quimioterapia presentan asimismo un alto riesgo. En estudios comparativos de pacientes con enfermedades crónicas del pulmón y sujetos sanos existe un aumento de 20 veces en la frecuencia de complicaciones pulmonares posoperatorias. Los pacientes con una capacidad vital o un volumen respiratorio forzado al primer minuto (VEF1) menor de 50 % son de muy alto riesgo. En una serie de 1 500 pacientes con diferentes enfermedades respiratorias, tratados en un periodo de 30 años, la frecuencia de complicaciones respiratorias fue de 63 % después de procedimientos intratorácicos. En otro grupo de 464 sujetos con enfermedad pulmonar crónica, la mayor frecuencia de complicaciones pulmonares ocurrió en aquellos sometidos a toracotomía. En pacientes con enfermedad pulmonar obstructiva crónica (EPOC) sometidos a intervención quirúrgica de tórax se encontró que tenían el doble de mortalidad comparados con quienes sufrían problemas respiratorios similares pero sometidos a operación no torácica.
La toracoscopia asistida por video se emplea en muchas instituciones para diferentes procedimientos diagnósticos y terapéuticos ya que encierra el potencial de reducir la morbilidad y la mortalidad en el transoperatorio y posoperatorio, si se compara con la toracotomía tradicional. La toracoscopia, sin embargo, tiene ciertos riesgos que pueden disminuirse con una atención preoperatoria apropiada. La toracoscopia evita esencialmente la necesidad de grandes incisiones en el tórax y reduce la morbilidad posoperatoria relacionada con la hipoxemia.
La introducción reciente de la cirugía con rayo láser a través de la toracoscopia creó una nueva modalidad de tratamiento para varias enfermedades pulmonares crónicas. Es por lo general un procedimiento seguro, aunque se han informado complicaciones como hemorragia posoperatoria intrapleural, enfisema subcutáneo y neumotórax. Es regularmente un procedimiento bien tolerado, aun en los pacientes debilitados.
Los avances en el equipo quirúrgico de toracoscopia asistida por video han causado entusiasmo debido a que disminuye el carácter invasivo de la operación; ello aumentó el interés por la toracoscopia.
Equipo básico y procedimiento
La cirugía torácica asistida por video (CTAV) requiere una sala de operaciones adecuada que permita al cirujano torácico convertir el procedimiento en una toracotomía abierta si es necesario. Los requerimientos básicos incluyen lo siguiente:
- Anestesia general.
- Intubación traqueal con tubo de doble luz.
- Instrumentos para toracotomía abierta (disponibles en el quirófano).
- Toracoscopio.
- Dos monitores de video de alta resolución.
- Dos a cinco orificios de acceso intercostales.
- Instrumentos de videoscopia.
- Aspirador y evacuador de humo.
Es muy importante que el equipo humano esté familiarizado con los procedimientos quirúrgicos torácicos tradicionales. Asimismo, el personal de anestesia debe tener experiencia en cirugía de tórax abierta y dominar los principios de la ventilación de un solo pulmón. Los procedimientos quirúrgicos de toracoscopia deben realizarse en forma secuencial y ordenada.
Valoración preoperatoria
Los objetivos de la valoración preoperatoria de los pacientes que han de someterse a toracoscopia son los siguientes:
- Valorar la extensión de la lesión primaria y los problemas médicos concomitantes.
- Mejorar el estado general.
- Comprender los problemas del cuidado perioperatorio.
La valoración preoperatoria incluye:
- Exámenes de laboratorio (los acostumbrados de rutina).
- Pruebas de coagulación.
- Electrocardiograma.
- Radiografía de tórax.
- Pruebas de función pulmonar.
La vigilancia incluye:
- Electrocardiograma con análisis del segmento ST.
- Oximetría de pulso.
- Capnografía.
- Gasto urinario.
- Temperatura.
Por su parte los procedimientos invasivos incluyen:
Atención anestésica
La mayoría de los pacientes sometidos a toracoscopia tiene función cardiopulmonar muy pobre y por lo tanto no toleran ninguna medicación preanetésica. Usualmente una sesión informativa del anestesiólogo con el paciente sirve para aliviar mucho la ansiedad. Una vez que el paciente llega a la sala de operaciones se instalan bajo anestesia local todos los procedimientos invasivos; durante este periodo puede usarse sedación ligera, según la tolerancia de la persona.
Después de una oxigenación adecuada se induce la anestesia con dosis altas de narcóticos (fentanil/sufentanil), ya que estos agentes proporcionan una estabilidad hemodinámica muy buena. La relajación muscular se logra con vecuronio y halogenados en dosis bajas.
La toracoscopia requiere la ventilación de un solo pulmón, mientras el otro está colapsado; ello se logra fácilmente con tubos endotraqueales de doble luz tipo Robert-Shaw. Se prefieren los tubos para lado izquierdo, independientemente de que la operación sea izquierda o derecha, ya que el tubo izquierdo es más fácil de colocar; el tubo derecho es difícil de instalar debido a que el origen del bronquio del lóbulo superior derecho está muy cerca de la carina. Si el orificio distal del tubo derecho no se coloca en el origen del bronquio del lóbulo superior derecho, la ventilación puede alterarse, lo cual ocasiona atelectasia e hipoxemia.
La colocación del tubo de doble luz se confirma con lo siguiente:
- Movimiento del tórax.
- Presencia de humedad en el tubo.
- Auscultación.
- Broncoscopia de fibra óptica (este método es el mejor).
Ventilación de un pulmón
La ventilación de un pulmón es obligatoria para lograr un campo quirúrgico inmóvil durante la toracoscopia. A veces se necesitan periodos de 120 a 180 min para algunos procedimientos terapéuticos. Cuando se inicia la ventilación de un pulmón se debe mantener el volumen corriente a 10 cc/kg y ajustar la frecuencia respiratoria para lograr una PaCO2 de 40 mm Hg con vigilancia constante, mediciones frecuentes de gases en sangre y vigilancia del estado cardiovascular. Dos de los problemas más frecuentes son la hipoxemia y la fuga de aire.
Hipoxemia: Cuando la PaO2 está por abajo de 70 mm Hg se considera el diagnóstico de hipoxemia y ello requiere un tratamiento agresivo.
- Verificar la posición del tubo endotraqueal.
- Valorar el estado hemodinámico.
- Aumentar la FiO2.
- Presión positiva continua en la vía respiratoria al pulmón que se está operando.
- Presión positiva al final de la espiración (10 cm H2O) al pulmón contralateral.
- Ventilación intermitente.
- Si no mejora, ventilar los dos pulmones.
Fuga de aire: después de una toracoscopia es común que se produzca fuga de aire; cuando la fuga es importante se puede requerir corrección quirúrgica.
Para corregir la fuga de aire, los ventiladores de volumen no son muy efectivos y se prefiere usar uno de control por presión como el Siemens-Servo 900-C.
Procedimientos específicos
Fístula broncopleural
En el pasado solía estar causada por la TBP pero actualmente es consecuencia del fallo de la sutura bronquial tras neumonectomía, especialmente derecha; también a causa de una bulla, absceso o PEEP. El líquido que hay en la cavidad pleural se aspira hacia el bronquio infectando o encharcando el pulmón; parte del volumen corriente (Vc) sale hacia la pleura, disminuye la ventilación y retarda la cicatrización. La variedad broncopleurocutánea es especialmente difícil de controlar.
El diagnóstico de sospecha lo da la clínica, lo reafirma el axamen de rayos X y lo confirma la broncoscopia. Si la fístula es grande, el tratamiento es la resección quirúrgica que se suele hacer inmediatamente después de una broncoscopia. Hasta ese momento se debe evitar la IPPV y colocar un drenaje basal (especialmente si hay empiema) manteniendo al paciente incorporado sobre el lado de la fístula. Deben evitarse las premedicaciones sedantes; el paciente debe transportarse al quirófano sentado y con el drenaje abierto, el cual debe conectarse inmediatamente al sello de agua. Toda manipulación de la vía aérea debe hacerse con el paciente sentado; se procede primero a la broncoscopia rígida con el paciente sentado y ventilación jet por brazo lateral del broncoscopio y posteriormente se coloca un tubo de doble luz.
Después de la operación debe conseguirse la ventilación espontánea cuanto antes para evitar la IPPV.
Las fístulas grandes, especialmente las cutáneas, se solucionan mal y tienen una alta mortalidad. En casos rebeldes se utiliza la ventilación diferencial con tubo de doble luz, que permite menores presiones en el lado de la fístula. Aun así la hipoxemia obliga muchas veces a utilizar PEEP, que agrava la fuga de V por la fístula; una solución a ello es colocar una válvula unidireccional en el drenaje que se cierra en la fase inspiratoria del ventilador. La ventilación a alta frecuencia (HFV) tiene en este campo una de sus indicaciones más claras y ha permitido mantener la ventilación y la curación en casos rebeldes.
Tumores mediastínicos
Se trata de tumoraciones grandes y es frecuente la compresión de la vía aérea, en dependencia de la postura, que se agrava con el decúbito supino y la relajación. La obstrucción de la vena cava superior da origen a hemorragias masivas, enlentece la acción de fármacos intravenosos y provoca edema e ingurgitación de la vía aérea.
Es frecuente que exista lesión nerviosa o que se produzca con la mediastinoscopia. Los efectos de la quimioterapia pueden ser importantes, como en el caso de la bleomicina que produce fibrosis pulmonar en el 10 % de los casos, en dependencia de la dosis, que se agrava considerablemente con las FiO2 altas.
Esófago
La principal causa de mortalidad posoperatoria son las complicaciones respiratorias. La toracotomía disminuye la CRF hasta en un 60 y la laparotomía alta hasta en un 35 %, lo que se suma en las técnicas de abordaje combinado abdominal y torácico. Así pues, es esencial valorar la reserva respiratoria. La enfermedad esofágica obstructiva causa episodios repetidos de broncoaspiración por regurgitación con neumonías recurrentes; esto disminuye la CRF y el volumen pulmonar total y provoca broncoconstricción. Las anomalías nutricionales van desde la obesidad en la hernia diafragmática a la caquexia en la neoplasia (deshidratación, hipopotasemia, hipomagnesemia, anemia, hipoproteinemia). En ambos casos disminuye la fuerza muscular respiratoria. Si la CV<70 %, FEV1<2 1, y VMM<50 % la tolerancia a la toracotomía será mala. Si el PEFR<70 % el paciente no toserá en el posoperatorio.
Debe considerarse la nutrición parenteral preoperatoria en las resecciones. Hay un alto riesgo de regurgitación durante la inducción y la hipoproteinemia puede exagerar la respuesta a fármacos como el tiopental. La disección del esófago se facilita colapsando el pulmón del lado de la toracotomía, que puede ser el derecho o el izquierdo. Se coloca un tubo selectivo izquierdo con independencia del lado de la toracotomía. Durante la ventilación a un solo pulmón en esta cirugía, la hipoxemia puede ser más severa que durante la cirugía pulmonar porque: 1) el pulmón colapsado no es patológico y participa eficazmente en la ventilación; 2) no se ha desarrollado desviación crónica de flujo hacia el pulmón ventilado; y 3) no se liga la circulación pulmonar del pulmón colapsado. Al final de la intervención debe expandirse bien el pulmón colapsado.
Las complicaciones intraoperatorias más graves son: lesión traqueal durante la disección, apertura de la pleura declive con paso de sangre y líquido alrededor del pulmón ventilado, hipotensión y arritmias por tracción de grandes vasos y bradicardia en las anastomosis cervicales. Las anastomosis intratorácicas deben controlarse estrictamente, para lo cual se suele dejar un drenaje próximo y sobre todo una sonda naso gástrica (SNG), que el cirujano guía hasta que queda a nivel de la sutura. La retirada accidental de la SNG puede dar al traste con la sutura. En intervenciones agresivas, especialmente las que se hacen con toracotomía y laparotomía combinadas, conviene mantener la IPPV horas y analgesia con opiáceos vía epidural.
Bullectomía
Se suele tratar de dos tipos de pacientes: los enfisematosos con una bulla gigante que produce insuficiencia respiratoria en un terreno de EPOC o el paciente joven con múltiples bullas constitucionales que presenta neumotórax espontáneos. Si hay un drenaje torácico los riesgos durante la anestesia son escasos pero en caso contrario debe tenerse en cuenta que:
- La IPPV puede aumentar rápidamente de tamaño una bulla que esté en comunicación con un bronquio.
- El N2O debe evitarse; puede producirse atrapamiento si existe un mecanismo valvular en la comunicación bronquial.
- Al abrir el tórax la mayor parte del VT puede irse hacia el pulmón operado.
- El riesgo más importante es el de rotura con neumotórax a tensión que debe diagnosticarse y tratarse con suma rapidez. El curso posoperatorio dependerá del estado previo del paciente y de la agresividad de la operación. En los casos de múltiples bullas se suele hacer abrasión pleural que causa hemorragia considerable.
Cirugía de las vías aéreas
Supone una gran dificultad para cirujano y anestesiólogo. La espirometría preoperatoria es difícil de interpretar por la obstrucción. La ventilación puede pasar por momentos críticos y se precisa una monitorización estrecha. En las estenosis traqueales altas el problema puede aparecer durante la inducción e intubación pero suele ser la interrupción de la integridad de la traquea lo más difícil de manejar ya que precisa ventilar distalmente a la sección. Existen varias soluciones: la intubación de la vía aérea distal (puede ser un bronquio principal) por el cirujano a través del campo quirúrgico, combinando la ventilación de la traquea proximal con la endobronquial con dos circuitos anestésicos, e incluso en resecciones próximas a la carina que son difíciles, en ocasiones es necesario utilizar circulación extracorpórea (CEC). La HFV tiene muchas ventajas en esta cirugía:
- No interfiere con las maniobras de resección y sutura.
- No hay que interrumpir la ventilación en ningún momento.
- El gran flujo de salida previene la entrada de sangre y restos a la vía aérea distal.
- Produce mínimos movimientos de las estructuras torácicas.
- La CPAP que provoca evita el colapso pulmonar.
Broncoscopia fibróptica
Puede realizarse sin intubación y es bien tolerada; produce ligera hipoxemia y aumento de las resistencias de las vías aéreas que debe prevenirse con atropina o glicopirrolato.
Broncoscopia rígida
Irrita mucho las vías respiratorias y su manejo es difícil porque causa interferencia entre cirujano y anestesiólogo, precisa un plano anestésico profundo pero rápidamente reversible con periodos alternativos de apnea y ventilación. Debe prevenirse la hipersecreción y la bradicardia (por estimulación o por dosis repetidas de succinilcolina) con atropina. Existen métodos para asegurar la oxigenación:
a) Broncoscopio con brazo lateral que se conecta al circuito anestésico y se ventila intermitentemente.
b) Oxigenación apneica mediante un catéter en carina que insufla 6 l/min de 02 oxigenando por difusión de masa, pero aumenta la PaCO2 1-6 mm Hg/min; y
c) Inyectando 02 a través de una aguja en el broncoscopio de Sanders, que por efecto Venturi, arrastra un flujo de aire ambiente. Deben monitorizarse los transtornos del ritmo, la pulsioximetría, durante este procedimiento se reporta la ocurrencia de recuerdo intraoperatorio en el 4 % de los casos.
Mediastinoscopia.
La enfermedad que indica esta exploración ocasiona con frecuencia obstrucción mecánica respiratoria y de la vena cava superior, que no contraindican la mediastinoscopia pero que la hacen muy peligrosa. Debe tenerse en cuenta que:
- Puede producirse hemorragia masiva difícil de controlar para lograr la hemostasia, por lo que debe haber reserva de sangre y una vía venosa gruesa (en miembro inferior si hay compresión de la cava).
- Deben evitarse la tos o los movimientos durante el procedimiento.
- La tensión arterial (TA) debe tomarse en el brazo izquierdo pero debe tomarse también el pulso radial de derecho para detectar una compresión de la arteria innominada.
- Hay riesgo de embolia aérea por desgarro venoso por ello es recomendable colocar al paciente incorporado y realizar IPPV.
Toracoscopia
Se realiza para exploración pleural o para pleurodesis. Es especialmente difícil cuando hay una fístula broncopleural. Se facilita mucho mediante intubación selectiva.
Broncografía
Se suele instilar contraste oleoso, generalmente para el diagnóstico de bronquiectasias. Preoperatoriamente debe valorarse el volumen de esputo producido y la posición de drenaje, así como aplicar fisioterapia respiratoria enérgica. Durante la inyección debe haber apnea. Puede realizarse con IPPV e intubación traqueal o con ventilación espontánea y un catéter colocado a través de un broncoscopio.
Posoperatorio inmediato
Después de la toracoscopia los tubos de doble luz se deben cambiar en la sala de operaciones por uno de luz simple y buen tamaño; se ventilan los dos pulmones con ventilador de control por presión con un volumen minuto adecuado. No se debe usar presión positiva al final de la espiración ya que ello puede aumentar la fuga de aire.
Ventilación artificial
Aunque desde el punto de vista teórico, y debido a las severas alteraciones de la mecánica respiratoria que produce la cirugía pulmonar, sería una de las indicaciones de IPPV durante unas horas, la mayoría de los anestesiólogos y cirujanos limitan su aplicación. Esta práctica se debe al temor de someter la sutura bronquial a presiones altas y a la invasión prolongada del árbol traqueobronquial.
En los centros donde se realiza una adecuada analgesia disminuye mucho la necesidad de IPPV posoperatoria. Sin embargo, en los pacientes sometidos a operaciones largas, resecciones amplias, o cuya función respiratoria era limitada preoperatoriamente, no debe tenerse prisa en extubar y realizar un destete prudente en dos-tres horas.
Fisioterapia respiratoria
El drenaje postural, las percusiones y sobre todo la espirometría incentivada con inspiraciones forzadas deben comenzar preoperatoriamente y realizarse muy precozmente en el posoperatorio coincidiendo con los momentos de máxima analgesia.
Complicaciones cardiovasculares
Hemorragia
Debe alarmar cuando es >100 ml/h, aunque en los primeros momentos puede ser mayor por la sangre acumulada. Debe descartase el secuestro de sangre mediante rayos X de tórax realizados con fecuencia. Cuando se decide reintervenir por hemotórax posoperatorio debe tenerse en cuenta la hipotensión brusca que aparece al colocar al paciente en decúbito lateral y no hacerlo hasta que los cirujanos estén lavados.
Hipotensión
Puede ser por hemorragia o por vasodilatación durante el calentamiento posoperatorio.
Herniación del pericardio
Tras neumonectomías con abordaje intrapericárdico. En las neumonectomías derechas, el defecto pericárdico permite la rotación cardíaca con eje en cava, lo cual provoca obstrucción aguda y completa de cava llevando a la muerte.
Arritmias
La fibrilación auricular es frecuente a los dos-tres días de la neumonectomía, especialmente izquierda, por tracción de la aurícula. La herniación pericárdica puede comenzar con arritmias ventriculares.
Insuficiencia cardíaca derecha
Puede aparecer en pacientes con amplias resecciones de territorio vascular pulmonar. Aunque se valora preoperatoriamente esta posibilidad, algunos pacientes en estado límite se descompensan por infecciones y sobrecarga hídrica fundamentalmente.
Complicaciones respiratorias
Hipoxemia e hipercapnia
Son constantes en el posoperatorio inmediato de cualquier toracotomía. Se mitigan con aporte de 02 suplementario, analgesia y estimulando la ventilación. La hipoxemia persistente puede deberse a múltiples causas pero la presencia de hipercapnia debe hacer que se sospeche una atelectasia.
Fugas
Es inevitable que se produzcan en las resecciones pulmonares, pero debe vigilarse su magnitud. En las neumonectomías no puede haber ninguna fuga y si se produce debe sospecharse rotura del muñón bronquial que producirá una fístula broncopleural. Esta es una complicación que suele acompañar a la IPPV con presiones altas. Si no hay un drenaje torácico abierto aparecerá neumotórax a tensión, desplazamiento mediastínico y graves alteraciones hemodinámicas. El tratamiento debe ser el drenaje inmediato y la intubación y ventilación selectiva.
Retención de esputo
Es el principal factor que debe gobernar los cuidados posoperatorios. Depende en gran manera del estado respiratorio preoperatorio, de la calidad de la fisioterapia y de la analgesia. Las atelectasias son frecuentes y obligan a la extracción de tapones de mocos por fibrobroncoscopio. Esta complicación puede desembocar en una infección respiratoria que descompensa a muchos de estos pacientes. Cuando se prevea dificultad posoperatoria para eliminar el esputo debe realizarse una minitraqueostomía cricotiroidea, introduciendo por técnica de Seldinger un fino tubo traqueal que permite la aspiración de secreciones.
CAPÍTULO III. TRATAMIENTO DEL DOLOR POSOPERATORIO EN CIRUGÍA TORÁCICA
Tratamiento del dolor posoperatorio
Después de la toracotomía, el tratamiento del dolor es importante no sólo para asegurar el bienestar del paciente, sino también para reducir las posibles complicaciones pulmonares y permitir que pueda respirar normalmente (sin espiración activa y/o respiración limitada por el dolor), con profundidad (para que pueda toser) y para que sea capaz de caminar. Una respiración normal y profunda pone en tensión la herida quirúrgica, causando dolor. Después de la operación, los pacientes suelen intentar evitar la tensión en la incisión quirúrgica; para ello, contraen los músculos espiratorios (respiración contenida o limitada), con lo que limitan el grado de tensión en la herida durante la inspiración; después espiran activamente disminuyendo así con rapidez cualquier posible tensión ocurrida durante la inspiración. Si el paciente no inspira con profundidad antes de realizar una espiración forzada, la tos es ineficaz. La respiración contenida, la espiración activa y la incapacidad para toser favorecen en conjunto la retención de las secreciones, el cierre de las vías respiratorias y la aparición de atelectasias.
Recientemente ha aumentado la aplicación de dos métodos muy eficaces para tratar el dolor posterior a una toracotomía, considerados hoy día electivos en este sentido: la crioanalgesia y la administración epidural de opiáceos. También se ha introducido hace poco otro método alternativo para el tratamiento del dolor después de la toracotomía: la analgesia regional intrapleural.
Crioanalgesia
La aplicación de frío a un nervio intercostal (crioanalgesia) puede conseguir un bloqueo nervioso a este nivel, de larga duración. La aplicación directa de una bolita de hielo en el nervio produce una degeneración de los axones nerviosos, pero sin lesionar sus estructuras de sostén (el neurolema), con lo cual se consigue interrumpir la actividad nerviosa de forma reversible. De este modo no se afecta el tejido conjuntivo intraneural y perineural, que sirve como trama para la regeneración de los capilares, los axones y las células de Schwann. El área de anestesia es la correspondiente a los dermatomas tratados. Durante las dos o tres semanas siguientes a la aplicación del frío se restauran plenamente la estructura y la función nerviosas. Por lo general, al cabo de uno-tres meses de la aplicación del frío se observa una completa restauración de la estructura y la función nerviosas, sin aparición de secuelas indeseables (neuritis o formación de neuromas). Durante este periodo persiste cierto grado de entumecimiento, por otra parte nada preocupante. Sin embargo, si se aplica el frío en el quinto nervio intercostal y en otros nervios intercostales más altos de mujeres jóvenes, algunas afirman presentar cierto grado de malestar (pérdida de la sensación en la zona del pezón) durante el periodo de regeneración axonal.
Administración epidural de opiáceos
El tratamiento del dolor después de la cirugía torácica mediante la administración epidural de opiáceos tiene varias ventajas importantes. En primer lugar, no existe bloqueo simpático ni pérdida sensoriomotora; en segundo término, por lo general es posible predecir la eficacia de la analgesia y, por último, la duración de la analgesia conseguida suele ser mucho mayor, y su calidad mucho mejor, que la obtenida mediante la administración parenteral de opiáceos.
La utilización de opiáceos epidurales en el tratamiento del dolor posterior a toracotomía ha sido bastante estudiada. El catéter epidural debe colocarse antes de la inducción de la anestesia general, y su posición correcta debe también comprobarse inyectando una pequeña dosis de un anestésico local. Una alternativa menos preferible consiste en colocar el catéter después de la operación y antes de que el paciente despierte de la anestesia y esté aún en decúbito lateral. La primera inyección puede realizarse en el quirófano (lo más habitual), en la sala de recuperación o en la unidad de cuidados intensivos. La experiencia con la administración epidural de opiáceos después de la toracotomía ha definido varios puntos clínicos importantes.
En primer lugar, aun cuando se ha utilizado la vía epidural torácica, el procedimiento tiene sus riesgos (fundamentalmente punción dural y lesión medular), y se ha comprobado que el área lumbar es igualmente adecuada para introducir el catéter y conseguir la analgesia, siempre que se utilicen una dosis de morfina y unos volúmenes del diluyente adecuado más altos. La razón que explica el uso de esta sustancia en inyección epidural lumbar para la analgesia del dolor torácico radica en que tiene baja liposolubilidad y, por lo tanto, permanece y tiene más tiempo para difundir por los espacios epidural e intradural. Así, para la analgesia del dolor torácico se ha utilizado con éxito la inyección de 6 mg de morfina en 10-15 ml de diluyente (suero fisiológico normal sin preservantes) en la región epidural lumbar. Aunque se han estudiado mucho menos, también pueden utilizarse, tanto por vía epidural lumbar como torácica, el fentanil, la metadona, la hidromorfona y la nalbufina. No debe sorprender que la vía lumbar exija el uso de un mayor volumen de diluyente para conseguir que el opiáceo alcance mecánicamente una distribución más amplia, puesto que estas sustancias lipófilas se fijan con excesiva rapidez a la médula y, también, a unos cuantos dermatomas por encima y por debajo del nivel segmentario en que se han introducido. Dado que la vía lumbar es más segura que la torácica y que el uso de fentanil no se ha asociado a depresión respiratoria, muchos autores coinciden en que la administración epidural lumbar de este anestésico es la técnica electiva en el tratamiento del dolor posterior a una toracotomía.
Se debe señalar que la inyección torácica baja de fentanil puede ser más segura que la administración de un mayor volumen de morfina a nivel lumbar, por lo que también esta técnica es muy utilizada. Pese a todo, son muchos los fármacos (y las dosis) que pueden emplearse tanto para la administración lumbar como epidural.
Anestesia regional interpleural
Recientemente se ha introducido la analgesia regional interpleural en el tratamiento del dolor causado por diversos procesos, como las fracturas costales, la pancreatitis y el dolor posoperatorio en casos de mastectomía, colecistectomía y operaciones renales. Esta técnica se ha valorado también en los pacientes sometidos a intervenciones torácicas.
La analgesia regional interpleural consiste en la introducción percutánea de un catéter (por lo general, un catéter epidural) en el interior de la caja torácica, entre la pleura visceral y la parietal. Dado que el extremo del catéter se localiza entre las dos capas pleurales, lugar donde se deposita un anestésico local, el término más apropiado para designar esta técnica es el de analgesia regional “interpleural” y no “intrapleural”.
El anestésico estudiado con mayor frecuencia ha sido la bupivacaína, a concentraciones del orden de 0,25-0,5 % y, por lo general con adición de adrenalina. Al parecer la analgesia es el resultado de los siguientes mecanismos: a) la difusión del anestésico local a través de la pleura parietal y los músculos intercostales más internos, hasta alcanzar los nervios intercostales y producir a este nivel un bloqueo; b) el bloqueo de la cadena simpática intratorácica, y c) la acción directa del anestésico local sobre las terminaciones nerviosas intrapleurales.
En los pacientes sometidos a cirugía torácica, por lo general el catéter se coloca en el curso de la intervención en el espacio intercostal situado por debajo al correspondiente al nivel de la incisión quirúrgica. Una alternativa menos frecuente consiste en utilizar el tubo de drenaje torácico para inyectar el anestésico local. En un estudio se siguió el curso posoperatorio de 14 pacientes adultos durante siete días, los cuales recibieron 20 ml de bupivacaína al 0,25 o 0,5 %, junto con adrenalina, hasta cuatro veces al día, se observó que en once pacientes con incisión quirúrgica posterior o lateral se consiguió una analgesia moderada o excelente; en cambio, no se obtuvo analgesia en tres pacientes con incisiones quirúrgicas anteriores. En un segundo estudio se colocaron catéteres intraoperatoriamente a 14 pacientes adultos, se les administró un bolo de 15-20 ml de bupivacaína al 0, 5 % y después se practicó una perfusión continua de bupivacaína al 0,25 % a un ritmo de 5-10 ml/h. La perfusión se continuó hasta más de 45 horas después de la operación. Según dicho estudio, ninguno de los 14 pacientes consiguió una analgesia satisfactoria ni con la inyección en bolo ni con la posterior perfusión del anestésico; por el contrario, fue necesario en todos ellos administrar un tratamiento suplementario con opiáceos y, en dos de ellos, también un bloqueo nervioso intercostal convencional. Además, en varios pacientes se alcanzaron niveles plasmáticos de bupivacaína potencialmente tóxicos y en uno de ellos el catéter se rompió dentro del tórax al intentar sacarlo. Por consiguiente, los autores recomendaron no utilizar la analgesia regional interpleural en el tratamiento del dolor de los pacientes sometidos a toracotomía.