INTRODUCCIÓN
Los procedimientos técnicos parasitológicos son de gran utilidad en el diagnóstico e identificación de las parasitosis humana, las que constituyen un problema de salud a nivel mundial y se encuentran entre las principales causas de morbilidad y mortalidad en países de África, Asia, América Central y América del Sur. (1)
En el mundo, millones de personas están afectadas por estos organismos, los cuales están asociados a la pobreza y a las malas condiciones higiénico-sanitarias, y han sido los sectores sociales más desamparados, los más vulnerables. En el mundo existen aproximadamente 3,5 mil millones de infectados por parasitismo intestinal con un estimado de muerte por Entamoeba histolytica de 70 000 personas. (1)
En Cuba, la prevalencia de parasitismo intestinal por protozoarios entre ellos la Giardia lamblia se encuentra a un 7,2 % y en la Entamoeba histolytica a un 8,3 %, (1) por lo que se hace necesario que nuestros estudiantes, técnicos, y profesionales se actualicen en cada una de las técnicas parasitológicas existentes, lo cual facilita una mejor calidad en las investigaciones realizadas y ampliación de los procedimientos de investigación, de ahí la importancia de contar con un folleto que incluya todas las técnicas parasitológicas actualizadas para que sirvan de guía para la preparación del personal que labora en cada uno de los laboratorios de microbiología, con el objetivo de un mejor diagnóstico e informe de las enfermedades parasitarias y que a su vez sirva de soporte a la bibliografía básica existente.
DESARROLLO
Capítulo I. Parasitología general
La división de la biología en diferentes ciencias responde a los diversos aspectos de estudio que ofrece la vida de los seres organizados: forma, estructura, actividades, relaciones mutuas, origen, y desarrollo. Dada la amplitud considerable de las ciencias biológicas y el sentido evolutivo que caracteriza sus investigaciones, se han ido separando de su tronco principal, y han formando ramas especializadas entre las que se puede mencionar la parasitología, cuyo objeto principal es la explicación de los fenómenos relativos a la forma, estructura y evolución de los parásitos.
La parasitología médica se encarga del estudio de los parásitos del hombre, los cuales tienen carácter patógeno.
Parásito. Concepto.
Organismo que vive la totalidad o parte de su existencia en el interior o exterior de otro organismo (hospedero), generalmente más complejo y potente que él, a expensas del cual se nutre y produce o no, lesiones aparentes o inaparentes. (1)
Hospedero. Concepto.
Organismo que alberga al parásito. (1)
Este hospedero según la fase de vida que albergue del parásito, se va a clasificar en: (1)
Hospedero intermediario: organismo que alberga la fase larvaria del parásito
Hospedero definitivo: organismo que alberga la fase adulta del parásito. Para ingresar al hospedero, los parásitos pueden elegir algunas de las vías siguientes:
1. Digestiva: la transmisión de las enfermedades parasitarias a menudo se deben a la contaminación del agua y de los alimentos con materia fecal, donde están presentes las fases infectantes de los parásitos, o al control inadecuado de las heces. Esta generalización es aplicable a las enfermedades transmitidas por vía fecal-oral a través de la boca.
2. Respiratoria: inhalación de huevos de parásitos (Enterobius vermiculares) a través del aire hacia la faringe posterior.
3. Cutánea y mucosa: penetración de los parásitos que se encuentran en el suelo hacia el interior del organismo a través de la piel. Por ejemplo: Strongyloides stercoralis y Ancylostomidios.
4. Orificios de cavidades naturales: transmamaria (leche) con especies de Strongyloides y Ancylostomidios.
5. Transplacentaria (congénitas): a través de la placenta ejemplo: Toxoplasma gondii, Plasmodium spp.
6. Contacto sexual: la Trichomona vaginalis.
7. Vectorial: requiere de la presencia de artrópodos chupadores de sangre y los parásitos son introducidos con la picadura del vector. La transmisión por artrópodos depende de medidas sanitarias inadecuadas, por ejemplo: la Filarias y Tripanosomas.
Fuentes de infección:
La exposición a la infección puede tener lugar por una o varias de las fuentes siguientes:
1. Agua y suelo contaminados.
2. Alimentos contaminados que contengan estadios inmaduros infectantes del parásito.
3. Insectos hematófagos.
4. Animales domésticos o silvestres que alberguen el parásito.
5. Otras personas, sus vestidos o el medio ambiente inmediato que los parásitos han contaminado.
6. Auto-infecciones repetidas.
Protozoarios intestinales de importancia médica
Entamoeba histolytica / E dispar, Entamoeba coli, Endolimax nana, Iodo ameba butschilii, Blastocystis hominis, Giardia lamblia, Trichomona hominis, Trichomona tenax, Chilomastix mesnilii, Balantidium coli, Cryptosporidium, Isospora belli, Cyclospora cayetanensis, Sarcocystis bovihominis. (1,2)
Vía de transmisión de las enfermedades parasitarias por protozoarios intestinales
La transmisión de las enfermedades parasitarias por estos agentes a menudo se debe a la contaminación del agua y de los alimentos con materia fecal, que se produce en la fase infectante de los parásitos, o se debe al control inadecuado de las heces. Esta generalización es aplicable a las enfermedades transmitidas por vía fecal-oral a través de la boca. (vía digestiva). Estas fases infectantes de los parásitos son adquiridas con la ingestión del agua y los alimentos, y se desarrolla un ciclo de vida dentro del hospedero, hasta que alcanzan su madurez y causan diferentes manifestaciones clínicas y trastornos de la salud que pueden ir desde dolores abdominales hasta: vómitos, diarreas, erupción cutánea, y puede provocar la muerte del individuo, por lo que se hace necesario un diagnóstico certero de las parasitosis humanas. (1)
Capítulo II. Diagnóstico de las enfermedades parasitarias
En la práctica tiene gran importancia la identificación de los parásitos en el hombre, puesto que el diagnóstico de las enfermedades parasitarias se fundamenta en una correcta identificación de estos organismos a través de los diferentes métodos de diagnósticos. Los métodos de diagnóstico se reducen a:
Diagnóstico clínico: está basado en las reacciones fisiopatologías del hospedero, que dan lugar a los síntomas propios de cada parasitismo, es decir, a un cuadro clínico que puede tener características más o menos típicas y que a pesar de su utilidad, carece de la solidez suficiente para afirmar un diagnóstico.
Diagnóstico del laboratorio: puede realizarse por dos mecanismos distintos:
1.- Métodos directos: considerados como un diagnóstico de certeza que permite determinar o precisar el agente causal por hallazgo del parásito o de sus elementos morfológicos a través del examen macroscópico que permite identificar el parásito en su estado adulto o fragmentos de ellos y que comprende el examen a simple vista o con lupa. Otros de los exámenes utilizados es la observación microscópica de las diferentes fases evolutivas del parásito (quistes, trofozoitos, huevos, larvas,).Se realiza a través del examen directo y examen concentrado. (1)
2.- Métodos indirectos: permiten establecer un diagnóstico de probabilidad y se basan en la interpretación de las reacciones del hospedero, por ejemplo: (1)
a) Citodiagnóstico: hemograma con diferencial.
b) Histodiagnóstico: reacción granulomatosa, metaplasia e inflamación.
c) Inmunodiagnóstico: determinación de inmunoglobulinas, fijación del complemento, hemaglutinación indirecta, látex, técnicas de inmunofluorescencia e inmunoelectroforesis, ELISA. (Enzyme Linked Immunosorbent Assay) (por sus siglas en inglés) (3)
d) Química sanguínea.
e) Electrocardiograma (ECG), ultrasonido, radiología y tomografía axial computarizada (TAC).
Para estas determinaciones es importante tener en cuenta el tipo de muestra a tomar, además de saber, cuándo y cómo hay que obtener la muestra y qué precauciones deben tomarse para que sea satisfactoria en el momento de su análisis e investigación. (1)
Diagnóstico de parasitismo intestinal y otros parásitos de cavidades
Existen diferentes métodos de examen en los laboratorios que permiten la investigación y observación de los diferentes parásitos que afectan al hombre.
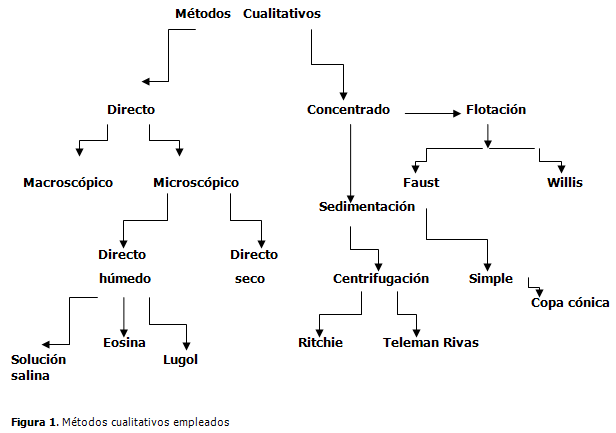
1. Cualitativos: pueden ser directo (macroscópico o microscópico), por concentración (por flotación, que incluye el Faust y el Willis) o por sedimentación (técnicas de Ritchie, Teleman, o copa cónica). (4) (Figura 1).
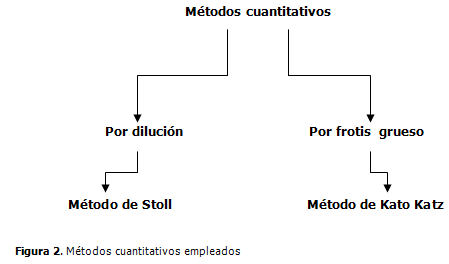
2. Cuantitativos pueden ser: por dilución (Stoll) o por frotis (Kato-Katz). (4) (Figura 2).
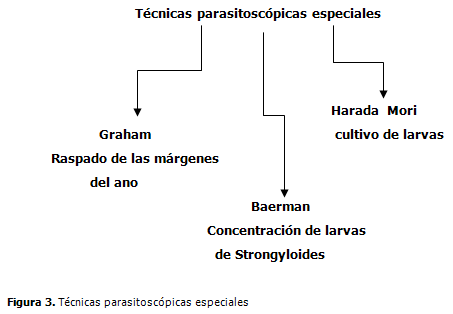
Existen varias técnicas parasitoscópicas especiales entre las que se pueden mencionar: raspado perianal (Graham), por termotropismo (Baerman), coprocultivo (Harada-Mori), Zielh-Neelsen modificado y tamizado de heces. (4) (Figura 3).
Capítulo III. Técnicas de los exámenes parasitológicos
En revisiones realizadas se constata que en general no existe una técnica que sea completamente eficaz para el diagnóstico de todas las parasitosis intestinales y la técnica que se elija dependerá de cual sea el objetivo a diagnosticar. Por otra parte en ocasiones es tan o más importante la destreza del que realiza el diagnóstico que el tipo de técnica seleccionada. (4)
Otro aspecto significativo es la adecuada recogida de la muestra y la correcta identificación del frasco donde se trasportará al laboratorio. Como la excreción de los quistes y huevos de los parásitos tiene un ritmo cambiante resulta apropiada la indicación de exámenes seriados (al menos 3) en diferentes días para su búsqueda. (4,5)
Las muestras de heces deben ser transportadas inmediatamente al laboratorio después de recogidas, pero si van a estar más de dos horas, se tienen que conservar en refrigeración a 4 °C y en caso de que se observen después de las 4 o 6 horas de recogida, sería conveniente el uso de persevantes como la formalina al 5 o al 10 %, los que se deben mezclar con las heces, en proporción de tres partes del líquido preservante por una de heces. (4)
Principales métodos de diagnóstico coproparasitológicos
- Método de examen directo con eosina roja al 1 % o solución de lugol
Es la más antigua de todas las técnicas y es utilizada para el diagnóstico de todas las parasitosis intestinales, aunque puede ser especialmente útil para la observación de las formas móviles de trofozoitos. (4-6)
Procedimiento
1. Se coloca en el centro de un portaobjetos una gota de una solución de Lugol.
2. Se toma un pequeño fragmento de heces de la superficie y se diluye en la gota de lugol sobre el portaobjetos.
3. Si existen partículas groseras se apartan y se coloca un cubreobjetos (es importante tomar partes mucosas o muco sanguinolentas, en el caso de que existan).
4. Se observa al microscopio con lente ocular 10 X. Primero con un objetivo 10 X y después con 40 X.
5. Se observa toda la lámina con ocular 10 X y con objetivo 10 X para el diagnóstico de larvas y huevos de helmintos. Los trofozoitos y quistes de protozoos se destacarán como elementos nacarados translúcidos sobre el fondo lugol, que impregnarán todos los elementos, excepto los protozoos cuando son viables. Con la solución eosina se observarán quistes incoloros en un fondo rosado, y trofozoitos y larvas con movimientos
6. Cuando estos elementos translúcidos y claros se localicen con el objetivo 10 X en formas de pequeñas masas redondeadas se pasará al objetivo 40 X para identificarlos.
En la preparación tratada con solución Lugol, la sustancia cromatínica se destaca sobre el citoplasma pardo–amarillento, y es posible distinguir la estructura nuclear. (6) Esta solución de Lugol para uso parasitológico puede venir preparada comercialmente, pero en caso contrario se podrá elaborar de la siguiente forma:
Solución de Lugol parasitológico. (4)
- Iodo cristaloide: 2 gr.
- Ioduro de potasio: 4 gr.
- Agua destilada: 100 ml.
- Técnica de Willis y Malloy (Modificada por Basnuevo)
Constituye un método de enriquecimiento de huevos a través del uso de un medio con una densidad de 1200, lo que permite concentrar los huevos de los helmintos más frecuentes en Cuba (Trichuris trichiura, Ascaris lumbricoides y Necator americanus). Este método fue creado por Willis en 1921 y es especialmente útil para los huevos de Ancylostomidios. El método original usa solo sal, pero en Cuba fue introducida hace más de 50 años una modificación que emplea azúcar y formol, y disminuye la cantidad de cloruro de sodio, y es en esa forma que se utiliza actualmente en la red nacional de laboratorios. (4,5)
1. Preparar una solución de alta densidad a base de sal, azúcar y una pequeña cantidad de formol, en las siguientes proporciones:
- Cloruro de sodio..........................................180 g.
- Azúcar........................................................500 g.
- Formol al 40 %.............................................20 ml
- Agua corriente...........................................1200 ml
Esta solución debe dar una densidad de 1200.
2. En un vasito plástico o de cristal de no más de 30 ml de capacidad, preferentemente cilíndrico o cónico con el extremo inferior más estrecho, se vierten de 10 a 15 ml de la solución anterior y en ella se disuelven aproximadamente 2 gramos de las heces que se investigan. Esta debe hacerse con un aplicador desechable de madera o plástico, se deben extraer las grandes partículas no disueltas que resulten de la solución de las heces.
3. Se procede a llenar el vasito con la misma solución hasta el borde sin que rebose.
4. Se coloca un portaobjetos sobre el vasito, de manera que el líquido contacte con la superficie del portaobjetos y se mantiene así de 15 a 20 minutos.
5. Pasado ese tiempo, se toma el portaobjetos con un movimiento de volteo rápido de manera que el líquido no se escurra de la lámina y se lleva al microscopio para su observación.
6. Observar con ocular 10 X y objetivo 10 X, debe recorrer toda la lámina con ese aumento, antes de que la preparación comience a secarse.
- Concentración de formol-éter/ etil acetato de Ritchie
Esta técnica es utilizada para concentrar quistes de protozoos y huevos de helmintos. Sin embargo, no es adecuada para la observación de trofozoitos. (4,5)
1. Si la materia fecal es dura se agrega solución salina y se mezcla hasta que quede líquida en cantidad aproximada de 10 ml.
2. Se pasará por una gasa doble y húmeda, una cantidad aproximada de 10 ml de la materia fecal líquida a un tubo de centrífuga de 15 ml.
3. Se centrifugará a 1500-2000 r.p.m. por dos minutos, y se decantará el sobrenadante.
4. Se diluirá el sedimento en solución salina, se centrifugará como antes y se decantará. Este paso se puede repetir tantas veces como sea necesario hasta que el sobrenadante salga claro.
5. Se agregará al sedimento aproximadamente 10 ml de formol al 10 % y se mezclará bien, se dejará reposar por cinco minutos.
6. Se agregará 3 ml de éter o de acetato de etilo, se tapará el tubo con un tapón de goma y se agitará de manera fuerte durante treinta segundos. Se destapará cuidadosamente.
7. Se centrifugará a 1500 r.p.m. por cinco minutos más. Se formarán cuatro capas distribuidas así: una de sedimento pequeño que contiene los huevos, quistes y otros elementos una capa de formol, un anillo con restos de materiales fecales y el éter en la superficie.
8. Con un palillo se aflojará el anillo con restos de materia fecal de las paredes del tubo, para decantarlo cuidadosamente con las tres capas superiores. Se tratará de que el sedimento no se contamine, para ese fin si es necesario se podrá limpiar con un algodón las paredes del tubo para evitar que el sedimento se contamine con los restos del anillo de residuos.
9. Se mezclará el sedimento con la pequeña cantidad de líquido que baje por las paredes del tubo y se harán preparaciones en fresco con lugol para ser observadas en el microscopio.
- Coloración de Ziehl Neelsen modificada
Este procedimiento utiliza 4 soluciones en pasos continuos de la tinción. Se emplea para el diagnóstico de certeza de los coccidios intestinales: en especial: Cryptosporidium y Cyclospora cayetanensis. (4,5)
1. Se realizará una extensión de la materia fecal.
2. Se fijará en metanol el extendido durante 5 minutos y se secará al aire.
3. Se colocaran las láminas durante una hora en una solución de fucsina fenicada.
4. Se lavará con agua de la pila (grifo).
5. Se diferenciará por la inmersión de la lámina en solución de H2SO4 al 2 % durante 20 segundos con agitación constante de la lámina.
6. Se lavará con agua de la pila.
7. Se coloreará con una solución de verde malaquita al 5 % durante 5 minutos.
8. Se lavará con agua de la pila.
9. Se añadirá aceite de inmersión y se le colocará un cubreobjetos.
10. Se examinará al microscopio con objetivo 40 X.
Preparación de la solución de Ziehl Neelsen modificada
Solución A
Fucsina fenicada_______________________ 150 gr.
Alcohol (etanol L 95 %) _________________ 1000 ml
Solución B
Solución A _____________________________ 10 ml
Agua fenicada al 5 % _____________________ 90 ml
- Técnica de Kato-Katz
Es una técnica que consiste en una modificación volumétrica del método gravimétrico original y es utilizada para el diagnóstico cuali-cuantitativo de las helmintiasis intestinales. (4,5)
1. Embeber las tiras de acetato humectable en una solución al 50 % de glicerina verde malaquita por no menos de 24 horas antes de usarse.
2. Transferir una pequeña porción de heces sobre un pedazo de papel de deshecho (el papel de un periódico viejo puede ser ideal).
3. Colocar una malla de nylon sobre las heces y presionar se debe ayudar con un aplicador plástico.
4. Tomar con la espátula la materia fecal colada y colocarla en el orificio de la placa plástica previamente situada sobre un portaobjetos limpio.
5. Levantar con mucho cuidado el plástico de manera que la materia fecal quede sobre el portaobjetos según la forma y volumen del orificio.
6. Cubrir la muestra fecal con el cuadrado de celofán embebido con la solución de glicerina-verde malaquita.
7. Invertir la preparación y presionar sobre una superficie dura y lisa para extender la muestra de forma pareja de manera que llegue a cubrir un área de 20 a 25 mm de diámetro.
8. Se deja reposar la muestra durante una hora a temperatura ambiente antes de su examen microscópico. La lámina puede ser leída mucho antes si se coloca en una incubadora a 40 °C o debajo de una lámpara incandescente o de una fluorescencia intensa.
9. El número de huevos multiplicado por 24 nos dará el número de huevos por gramo de heces. Esto es debido a que la capacidad del orificio donde se midió el volumen de heces, es equivalente a 41,7 mg.
Recomendaciones adicionales para la lectura:
1-Las láminas en el caso de huevos de Trichuris trichiura pueden ser leídas inmediatamente después de haberse montado.
2-En el caso de Ascaris lumbricoides la lectura puede efectuarse en cualquier momento.
3- Los huevos de Ancylostomidios (Necátor americanus y Ancylostoma duodenale) no son visibles hasta después de 30 minutos como mínimo y deben leerse antes de las 6 horas de montada la lámina.
4-Los huevos de Hymenolepis nana también deben leerse antes de las 6 horas de montada la lámina.
Preparación de la solución de glicerina-verde malaquita se prepara de la siguiente forma:
- 100 ml de agua destilada.
- 100 ml de glicerina.
- 1 ml de verde malaquita al 3 % (azul de metileno al 3 % en su defecto).
Materiales empleados para la técnica de Kato-Katz.
Mallas de 105 perforaciones por mm2, espátulas, acetatos humectable la solución de glicerina verde malaquita, y las plaquitas plásticas o de aluminio con los orificios de 6 mm de diámetro.
- Método de coprocultivo de Harada - Mori
Es útil para diferenciar las larvas de Necator americanus y Ancylostoma duodenale entre sí, porque las características morfológicas de los huevos no permiten la diferenciación concluyente. (4,5)
El método consiste en obtener a partir de los huevos de Ancylostomidios las larvas que podrían ser rabditoide o filariforme según el tiempo de evolución. Las características morfológicas de las larvas hacen posible su diferenciación.
Los cultivos deben mantenerse durante un mínimo de 8 días a temperatura de 24 a 29 °C para tener la seguridad de que todas las larvas tienen tiempo suficiente para llegar a la fase infectante. Si los cultivos se han conservado a temperaturas inferiores el examen debe demorarse dos o más días.
Procedimiento para el cultivo
1- Se realiza una extensión fina (1 a 2 mm) de heces fecales en una cara del tercio medio de tiras de papel de filtro de 13 x 120 mm, el tamaño varía según el largo y ancho del tubo que se utilice
2- Colocar las tiras de papel de filtro en tubos cónicos de centrífuga o tubos de ensayo con rosca que contengan aproximadamente 3 ml de agua destilada sin que toquen las heces, se contacta la parte limpia del papel con las paredes del tubo.
3- Guardar el cultivo a temperatura ambiente (24 a 28 ºC) por 7 días, se debe revisar diariamente el nivel de agua y añadir esta delicadamente por la pared del tubo, siempre que sea necesario para mantener el nivel adecuado.
Obtención de larvas de los cultivos
1- Con una pipeta de Pasteur se extrae previamente agua del fondo del tubo y se vierte en un tubo de cónico de centrífuga.
2- Añadir agua destilada hasta cubrir totalmente la tira de papel de filtro.
3- Reposar 2 horas o más.
4- Retirar con una pinza el papel de filtro y desecharlo en un recipiente con desinfectante.
5- Pasar esta agua que contiene el tubo, a uno o más tubos de centrífuga adicionales.
6- Centrifugar y decantar.
Se debe examinar cada tubo por separado.
Examen de larvas
1-Se coloca una o dos gotas de sedimento que contiene las larvas muertas sobre una lámina portaobjeto, colocar un cubreobjetos de tamaño adecuado.
2- La lámina se debe examinar con un aumento bajo de 100 x en el microscopio compuesto, con luz reducida y diafragma cerrado para poder observar las larvas refringentes, posteriormente pasar a mayor aumento para poder observar las características diferenciales de las larvas observadas.
3- Utilizar microscopio con escala ocular y previamente calibrado para determinar las características de las larvas.
Nota: Si se detectan larvas vivas en el sedimento, el fondo del tubo debe ser sumergido en agua caliente a 50 ºC a 60 ºC o añadir unos ml de ácido acético (20 ml de ácido acético glacial en 80 ml de agua destilada) a la suspensión, cuando se utiliza ácido acético hay que volver a concentrar las larvas por centrifugación. (4,5)
Clave para la diferenciación de las larvas filariformes de Nemátodos en coprocultivos humanos. Strongyloides (S.stercoralis o S. fuelleborni)
El esófago tiene un tamaño aproximado que corresponde a la mitad de la longitud del cuerpo y es delgado (14 – 17 µm) y está desprovisto de vaina cuticular, el extremo de la cola no es puntiaguda y tiene un aspecto dentado. (4,5)
Necátor americanus:
El cuerpo (sin incluir la vaina) presenta una longitud de 500-600 µm. Tiene notables procesos dentarios paralelos de 15 µm de longitud. El intestino en la unión esófago-intestinal es tan ancho como el bulbo esofágico. La cola (con el ano en la punta) tiene menos de 72 µm (50 - 72 µm). Se observan estriaciones transversas notables sobre la vaina en la región de la cola. (4,5)
Ancylostoma duodenale:
El cuerpo (sin incluir la vaina) presenta una longitud de 600-700 µm. Tiene unos procesos dentarios no muy notables, de aproximadamente de 10 µm de largo. El intestino en la unión esófago intestinal es más angosto que en el bulbo esofágico. La cola tiene más de 73 µm de largo (75- 94 µm). Las estriaciones transversas sobre la vaina en la región de la cola son poco notables. (4,5)
- Método de Baermann
Este método sirve especialmente para la concentración de larvas de helmintos y puede ser utilizado para concentrar otros parásitos como los trofozoitos de Balantidium coli. Se basa en las propiedades del higrotropismo y termo-tropismo positivo. Es decir, que las larvas de helmintos y trofozoitos de protozoos que tengan estas propiedades emigrarán hasta la parte inferior del embudo donde estará el agua a una temperatura más alta. (4,5)
Procedimiento:
1-Colocar un embudo sobre el soporte, con las pinzas cerradas y sobre la parte ancha del embudo se pone la tela de alambre sobre la cual se colocarán algunas bandas de gasas. El tallo del embudo recibirá un trozo de caucho provisto de una pinza.
2- Colocar de 8 a 10 gramos de heces fecales sobre la gasa.
3- Llenar el embudo con agua, a temperatura de 37 a 39 ºC de manera que las heces queden en contacto con el agua a través de la gasa.
4- Reposar durante 1 hora, tiempo en el cual las larvas que se encuentran en las heces pasaran al agua tibia, para acumularse en el tubo de hule.
5- Pasado éste tiempo, abrir las pinzas y recoger el agua en el vaso o en los tubos para ser precipitado.
6- Centrifugar 1 minuto a 1500 rpm.
7- Aspirar el sedimento con una pipeta de Pasteur.
8- Se coloca una gota del sedimento en una lámina portaobjetos, agregar una gota de solución lugol y cubrir la preparación con un cubreobjetos.
9- Observar al microscopio con objetivo 10 x, pasar a 40 x para detallar las estructuras.
- Método de la Copa Cónica
Este método sirve especialmente para huevos pesados de trematodos como los de Fasciola hepática. (4,5)
Procedimiento:
1-Se toma una muestra de 5 o 6 gr. de heces, y se mezcla con 200 ml de agua.
2. Se filtra la suspensión y se recoge en una copa cónica graduada entre 250 y 500 ml.
3. Se deja reposar 1 hora, se decanta el sobrenadante y se le agrega agua cuidadosamente, de nuevo se debe mezclar con el aplicador. Se deja reposar 1 hora más.
4. Se repite el lavado hasta que el líquido sobrenadante quede claro.
5. Decantar cuidadosamente de nuevo el sobrenadante y se analiza el sedimento con objetivo de 10 x.
6. Si desea se puede centrifugar la muestra y hacer mas fácil la observación.
- Método de Graham
Este método debe su nombre a Graham quien introduce la cinta adhesiva de celofán para el diagnóstico de Enterobius vermicularis. Comúnmente se observan los huevos del parásito, pero en ocasiones pueden observarse hembras grávidas de Enterobius con el útero repleto de huevos. (4,5)
Procedimiento:
1- Se le orienta al paciente que previamente a la toma de la muestra no debe lavarse ni defecar, para evitar el arrastre mecánico de los huevos de Enterobius vermicularis.
2- Se coloca una cinta adhesiva transparente en uno de los extremos de un depresor con la parte adherente, se debe sujetar hacia fuera, de manera fuerte entre el pulgar y el índice
3- Se debe inclinar al paciente de forma que quede expuesta la región anal, se presiona la cinta adhesiva contra dicha región, hacia la izquierda y derecha, se debe tener cuidado de cubrir toda el área entre la porción seca y húmeda.
4- Pegar la cinta sobre el portaobjeto, e identificar la lámina con los datos del paciente.
5- Observar al microscopio con lente ocular 10 X.
Capítulo IV. Protozoarios
Los protozoarios son organismos generalmente microscópicos, formados por una sola célula, lo que le permite diferenciarlos de los metazoarios, o animales superiores, integrados por un conjunto de células. Su forma es variada y frecuentemente muy sencilla: esférica, o esferoidal, ovoide, piriforme, etc.
Su talla varía desde 2 µm hasta 1 a 2 mm. pero los que parasitan al hombre son de dimensiones microscópicas.
El cuerpo de un protozoario está formado por los elementos que constituyen fundamentalmente a las células en general: citoplasma, núcleo, y membrana. La membrana puede ser tan fina que logra ser casi imperceptible, o por el contrario, puede tener un espesor notable y hasta mostrar un doble contorno. El citoplasma es una masa coloidal a veces de aspecto granuloso o bien homogéneo, que en algunas especies se divide en una porción externa, hialina, llamada ectoplasma, y una porción central, granulosa y translúcida, llamada endoplasma. El núcleo es redondo, esférico u ovoide, a veces reniforme, macizo o vesiculoso. (6)
A pesar de su sencillez estructural, los protozoarios suelen tener estructuras particulares destinadas a realizar funciones específicas, que reciben el nombre de organoides, los cuales permiten al protozoario realizar funciones similares a los de los metazoarios. En los rizópodos consisten en prolongaciones del ectoplasma llamadas seudópodos en las que fluye el endoplasma, que originan la forma de movilidad denominada movimiento ameboideo; en los mastigóforos, son filamentos largos y delgados, llamados flagelos; en los ciliados son filamentos aciculares, cortos y finos, que comúnmente cubren toda la superficie de la célula; se originan en el ectoplasma y se denominan cilios. (6)
La respuesta a los estímulos mecánicos está bien marcada en muchos protozoarios y los quimiotropismo son posiblemente de importancia vital en la economía y ciclo evolutivo de muchos de estos organismos.
La respiración es aerobia en los protozoos de vida libre, y las especies parásitas poseen probablemente un tipo de respiración anaerobia. La obtención de sustancias nutritivas se produce de diferentes maneras: (1)
1. Holofítica (utilización de la luz solar).
2. Holozoica (captura de partículas por englobamiento mediante los órganos de locomoción).
3. Saprozoica (osmótica, absorción de nutrientes a través de la membrana citoplasmática).
4. Secretan enzimas digestivas, toxinas, pigmentos y hemolisinas, entre otras sustancias.
Rizópodos de importancia médica
Amebas de vida Libre. (Acanthamoeba y Naegleria)
Entre las numerosas amebas de vida libre con hábitat en la tierra y en el agua, se encuentran ciertas especies pertenecientes a dos géneros (Acanthamoeba y Naegleria) son parásitos que afectan al hombre, estos ameboflagelados están caracterizados por trofozoitos que miden 18 µm, con seudópodos redondeados o estrellados y pared delgada.
Las amebas de vida libre están ampliamente distribuidas en continuo contacto con el hombre y los animales, sus formas quísticas son capaces de sobrevivir en el suelo, aire y agua. Las infecciones causadas por estas han tomado en los últimos treinta años notable importancia médica ya que muchos casos fatales no fueron diagnosticados clínicamente ni por el laboratorio, debido al desconocimiento de la potencial capacidad patogénica de estas amebas. Hoy se sabe que la meningoencefalitis amebiana primaria causada por Naegleria fowleri y la encefalitis amebiana granulomatosa originada por especies de Acanthamoeba spp., se ha incrementado en el mundo tanto en sujetos sanos como en inmunocomprometido, que incluyen a muchos individuos con Sida. (7)
Las amebas del género Naegleria se conocen también como ameboflagelados, mastigamebas y amebas limax. Según las condiciones del medio pueden diferenciarse en formas flageladas o enquistarse. (1) Especie de Naegleria de mayor patogenicidad: las amebas del género Naegleria se conocen también como ameboflagelados, mastigamebas y amebas limax. Según las condiciones del medio pueden diferenciarse en formas flageladas o enquistarse. (1) Especie de Naegleria de mayor patogenicidad:
- Naegleria fowleri
- Naegleria australiensis
Diagnóstico del laboratorio
Muestra:
El líquido cefalorraquídeo (LCR): se observa purulento, aumento celular de polimorfo nucleares y albúmina elevada.
Examen directo:se hace entre el cubreobjeto y el portaobjetos, o en cámara cuenta glóbulos, en busca de trofozoitos, aunque su ausencia no descarta el diagnóstico.
Es muy importante que el LCR no se refrigere o se congele, porque se inmovilizarían o se destruirían los parásitos.
Los extendidos pueden ser teñidos: con Wright o preferiblemente con Giemsa
Se observan los trofozoitos con citoplasma azul y los núcleos con tinte rosado.
Coloración tricrómica: se tiñen los quistes de verde, el citoplasma púrpura y el cariosoma rojo.
Cultivo:
Tanto Naegleria como Acanthamoeba son fáciles de cultivar en medios artificiales, el más empleado es un agar simple y se cultiva con Escherichia coli.
Otros métodos de diagnóstico:
- Inmunofluorescencia indirecta.
- Inmunoperoxidasa.
- Caco flúor blanco.
- Pruebas serológicas e inoculación de ratones.
Entamoeba histolytica / E dispar
Es un protozoario parásito del aparato digestivo del hombre, específicamente del intestino grueso, considerado como la única especie patógena, dentro de las amebas parásitas que afectan este sistema. La infección del hombre por Entamoeba histolytica se define como amebiasis intestinal con independencia de que esta provoque o no enfermedad, es sintomática en la mayoría de los casos, y se adquiere por la ingestión de quistes tetranucleados, la presencia de lo eritrocitos entre lo elementos fagocitados es característica de la Entamoeba histolytica (E. histolytica). Contiene de 1 a 4 núcleos, contornos bien definidos y presenta cuatro estadios en su ciclo de vida: quiste, prequiete, metaquiste y trofozoito. La fase trofozoitica tiene prolongaciones digitiformes del ectoplasma denominadas seudópodos que constituyen el mecanismo de locomoción.
El quiste se caracteriza por ser células inmóviles de formas ovaladas o redondas y miden entre 10 y 16 milimicras (µm ) de diámetros. (1)
Entamoeba coli
La Entamoeba coli (E coli) es la ameba más grande, puede tener de 4 a 16 núcleos y hasta 32, presenta cuatro estadios en su ciclo de vida: quiste, prequiste, metaquiste y trofozoito. En las heces fecales líquidas y semilíquidas se pueden encontrar trofozoitos y prequistes, en las heces formadas y semiformadas se presentan los quistes. La fase trofozoitica es semejante a la de la E histolytica, aunque presentan algunas características peculiares. Tamaño de 20 a 40 µm, vacuolas que pueden contener bacterias, cristales u otros materiales, casi nunca eritrocitos.
La fase quística son cuerpos esféricos o ligeramente ovalados, con doble contorno y miden de 10 a 30 µm. (1)
Diagnóstico del laboratorio de ambas amebas:
El diagnóstico de la infección con Entamoeba histolytica y Entamoeba coli se basa en la demostración del parásito en las heces fecales, se tienen en cuenta las diferencias morfológicas y tintoriales entre ambas especies. (6) (Tablas 1 y 2).
Muestra: heces fecales recién emitidas.
Examen directo: se hace extensión fina entre cubre y portaobjetos con solución salina, lugol o eosina roja al 1 %.
Es la más pequeña de las amebas, presenta de 1-4 núcleos, contorno bien definido, es común en el intestino humano, y presenta cuatro estadios en su ciclo de vida, trofozoito, prequistes, quiste y metaquiste. Los trofozoitos son pequeños, miden de 6 a 15 µm, seudópodos cortos, anchos, e hialino y núcleo poco visible. Los quistes son ovoides, miden de 5 a 15 µm, citoplasma finamente granuloso. (1,6)
Diagnóstico del laboratorio
Muestra: en heces fecales
Examen directo:
Se realiza una extensión fina, añadir solución salina, lugol o eosina roja al 1 % y observar al microscopio entre cubre y porta objeto.
Iodameba butschilii.
Iodameba butschilii: debe su nombre a la gran vacuola de glucógeno que poseen sus quistes, iodes (yodo), ameba.
El trofozoito de la Iodameba butschilii se caracteriza por tener un núcleo con gran cariosoma, el endoplasma presenta una masa de glucógeno, y los quistes de forma irregular.
Se desconoce la porción exacta del intestino donde habita esta especie. (1,6)
Blastocystis hominis.
Este es un parásito pleomórfico del cual se han descrito muchas formas con diferentes tamaños, lo que complica más su estudio.
Son varias las formas morfológicas descritas dentro de las que se destacan: la vacuolar, la multivacuolar, la granular, la ameboide, la prequística y la quística.
La forma quística resultante posiblemente es la forma infectiva. El soporte preliminar para esta hipótesis lo sustenta un estudio que indica que esta forma es infectiva para las ratas. (1,6)
Diagnóstico del laboratorio.
Muestra: heces fecales
Examen directo:
Se hace extensión fina que se debe cubrir con solución salina, lugol o eosina roja al 1 %, observar al microscopio entre cubre y porta objeto.
Se observa como un anillo con bordes definidos (simula un anillo de compromiso) con varios núcleos dentro de los bordes. (1,6)
Protozoarios flagelados (intestinales) de importancia médica.
Giardia lamblia
Los quistes presentan forma esférica u ovalada y miden de 8 a 14 µm por 7 a 10 µm de diámetro cada uno presenta cuatro núcleos y contiene estructuras como axonemas y cuerpos medianos.
Los flagelos, al igual que los axonemas, están enrollados.
Los trofozoitos tienen simetría bilateral, miden de 10 a 20 µm de largo por 5 a 15 µm de ancho, y tienen la forma de una gota lagrimal, son convexos en sentido dorsal y presentan un disco suctorial cóncavo en su porción ventral. (1, 6, 8,9)
Trichomona hominis.
La mayoría de los trofozoitos presentan cinco flagelos anteriores. Su tamaño es de 8 a 20 µm de largo por 3 a 4 µm de ancho, presenta cinco flagelos libres en su parte anterior y un sexto, localizado a lo largo de la membrana ondulante. El trofozoito constituye la fase infectante. (1,6)
Trichomona tenax.
Es un flagelado de aspecto piriforme, mide de 5 a 16 µm de longitud y de 2 a 15 µm de ancho, presenta cuatro flagelos libres en su parte anterior y un quinto flagelo sobre la membrana ondulante, la cual no alcanza el extremo posterior del cuerpo. Presenta citostoma, un grueso axostilo, un núcleo ovoide con escasos gránulos de cromatina, cariosoma excéntrico y citoplasma finamente granuloso. (1,6)
Chilomastix mesnilii.
Este flagelado pasa por los estados vegetativo (trofozoito) y quístico, con morfología bastante variable en ambos.
Los trofozoitos de esta especie tienen aspecto piriforme con el extremo anterior ancho y redondo, y el posterior largo y aguzado. Su longitud varía entre 6 y 30 µm y su anchura máxima entre 3 y 10 µm.
El cuerpo celular esta revestido por una fina membrana. En la cara ventral del extremo anterior comienza la boca o citostoma que se extiende hacia atrás, casi en la mitad de la longitud del cuerpo, en su interior se encuentra un corto flagelo libre, el flagelo labial. El núcleo esta situado en la extremidad anterior, cerca del citostoma y su forma es ovoide o redonda, cariosoma pequeño y finos granos de cromatina, presenta un blefaroplasto de los que emergen tres flagelos libres.
Los quistes son de forma esferoidal, con un abultamiento en uno de sus polos, miden de 6 a 9 µm de diámetro. El citoplasma es granuloso y homogéneo, núcleo esférico. (1,6)
Protozoarios ciliados
Balantidium coli
Es el mayor protozoario parásito del hombre.
El trofozoito es un cuerpo ovoide relativamente grande, cubierto de cilios cortos de longitud bastante uniforme, su talla varía entre 30 y 200 µm de largo por 20 a 70 µm de ancho. Su membrana está surcada por estrías paralelas donde se implantan los cilios, presenta un micronúcleo y un macronúcleo y una sola vacuola contráctil
Los quistes se forman fuera del hospedero, aunque se pueden recuperar también en las heces, son formas de resistencia y no de reproducción. Estos tienen una gruesa pared quística de doble contorno, son redondeados y miden de 45 a 65 µm de diámetro. (1,6)
Protozoos Coccidios
Cryptosporidium
Lejos de ser una infección inusual, la criptosporidiosis es relativamente común, con tasas de seroprevalencia que alcanzan el 25–35 % en EE.UU, o el 20 % en el Reino Unido. Además aproximadamente un 6,1 % de los casos de diarrea en pacientes inmunocompetentes podrían ser debido al Cryptosporidium spp. (10)
La criptosporidiosis es la infección del hombre y de otros animales causada por protozoarios coccidios pertenecientes al genero Cryptosporidium, agente causal de diarreas en individuos inmunodeprimidos. Dentro de este género encontramos especies tales como: Cryptosporidium parvum, Cryptosporidium muris, Cryptosporidium baileyi y Cryptosporidium meleagridis.
El Cryptosporidium parvum es la especie hallada en todos los casos de criptosporidiosis humana. Los parásitos son esféricos intracelulares, miden de 2 a 5 µm. La fase infectante es el Ooquistes esporulados. (1)
Diagnostico del laboratorio:
Muestra: heces fecales
Identificación de los Otocistos en heces recién emitidas.
Para la identificación presuntiva puede llevarse a cabo técnicas de tinción (Kinyoun, etc), para identificar género se puede utilizar técnicas de detección de antígeno como inmunofluoresencia o inmunoensayos, sin embargo, la identificación de especie requiere del uso de técnicas moleculares de amplificación por PCR (reacción en cadena de la polimerasa).Esto es debido a las pequeñas diferencias morfométricas de los Ooquistes y a la baja especificidad del hospedero. (10)
Isospora belli
La isosporosis humana es la infección del hombre por Isospora belli. En individuos inmunodeprimidos, la infección puede ser asintomática o dar lugar a diarreas de corta duración. En individuos inmunodeficientes, la infección puede ser causa de manifestaciones clínicas más graves, principalmente diarreas profusas y prolongadas. El Oocisto mide de 25 a 33 por 12 a 16 µm de diámetro.
Fase infestante, Ooquiste esporulados. (1)
Diagnóstico del laboratorio
Muestra: heces fecales
El diagnostico se basa completamente en la identificación de Oocistos en las muestras de heces fecales recién emitidas por examen directo. (1)
Cyclospora y Sarcocystis
Actualmente estos coccidios intestinales están considerados como patógenos emergentes o re-emergentes con gran trascendencia en la salud pública, estas infecciones causadas por estos agentes son más frecuentes en pacientes inmunocomprometidos y en otros grupos de riesgo como en niños menores de 5 años.
Estos parásitos transitan por una fase asexuada y otra sexuada. Se reproducen en las células epiteliales del intestino delgado y su estadio de resistencia y propagación son los Ooquistes presentes en la heces fecales, los cuales microscópicamente se observan como cuerpos esféricos que contienen racimos de glóbulos refráctiles, junto a la superficie interna de la membrana exterior. Miden, 8 a 10 µm de diámetro
Diagnóstico del laboratorio:
Muestra: heces fecales
El diagnóstico se basa completamente en la identificación de los Ooquistes no esporulados en las muestras de heces fecales recién emitidas por examen directo. (1, 10)
CONCLUSIONES
El diagnóstico de las enfermedades parasitarias y la identificación correcta de los agentes etiológicos que las causan es fundamental para la calidad de vida del paciente, lo que implica una correcta preparación y sistematización de los conocimientos de los estudiantes y profesionales de los laboratorios de microbiología. La actualización en las diferentes técnicas parasitológicas permite brindar un mejor servicio y un desarrollo óptimo de estas investigaciones. Por ello es de gran utilidad este folleto como material bibliográfico en la práctica de investigaciones parasitológicas.