INTRODUCCIÓN
La eritropoyetina (EPO) es una hormona producida primariamente en el riñón en respuesta a la hipoxia y de forma constitutiva en hígado, células del tejido cerebral y retina. (1) Los efectos de la EPO en la médula ósea están mediados a través de su receptor transmembrana (R-EPO) el cual es expresado primariamente en células progenitoras hematopoyéticas. Subsecuentemente la dimerización del receptor lleva a la activación de numerosas vías intracelulares como proteína quinasa activada por mitogenos (PI3K/Akt - MAPK) y el factor nuclear STAT–5, los cuales están ligados con la supervivencia celular. (2,3) La EPO inhibe la apoptosis de los progenitores hematopoyéticos y por ende incrementa la supervivencia hemática. Por otro lado, actúa sinérgicamente con otros factores de crecimiento hematopoyético promoviendo la proliferación y maduración de las células progenitoras hematopoyéticas. (4)
La síntesis de varias formas de eritropoyetina humana recombinante (EPOhr) representó un punto de partida en el tratamiento de las anemias causadas por su deficiencia en la insuficiencia renal crónica. Hasta el presente la EPO ha sido aprobada además para el tratamiento de la anemia asociada al cáncer y a sus variantes de tratamiento por quimio y radioterapia, síndromes mielodisplásicos y en la cirugía mayor electiva con el objetivo de reducir las transfusiones. (5)
Aunque la EPO es vista tradicionalmente como una hormona hematopoyética, se ha producido el hallazgo de receptores de esta en tejidos no hematopoyéticos (células endoteliales, neuronas, retina, células trofoblásticas) por lo que el estudio de sus efectos no hematológicos se ha convertido en un campo de intensa investigación. Estudios experimentales han demostrado el efecto protector que ejerce esta hormona cuando se administra de forma exógena. La administración sistémica de EPO en modelos animales con isquemia focal cerebral demostró una reducción del volumen del infarto en un 50 a 75 %. En el riñón, el tratamiento con EPO reduce el daño por isquemia - reperfusión en cuanto a disfunción, en modelos de ratones. Muchos otros reportes documentan el beneficio de la administración de esta hormona en modelos de hipoxia retinal, gastrointestinal y a nivel del sistema cardiovascular. (6,7)
El mecanismo molecular por el cual se estimula su producción es a través de los factores inducibles por la hipoxia. Estos se activan a partir de sensores de la membrana celular y disparan señales moleculares, que activan la replicación de genes que intervienen en la síntesis de la molécula.
Este trabajo tiene como propósito analizar las nuevas funciones no hematopoyéticas de esta proteína, que han abierto nuevas esperanzas en la terapéutica de las enfermedades con componente isquémico.
DESARROLLO
LA EPO Y EL R-EPO EN EL SISTEMA CARDIOVASCULAR
La expresión del receptor de la EPO ha sido hallada en múltiples líneas celulares del sistema cardiovascular en cultivo. In vitro el R - EPO es sintetizado y expresado en la superficie de células endoteliales humanas y la administración de la hormona previene de la muerte por apoptosis de estas células cuando son expuestas a la hipoxia a través de una vía metabólica dependiente de la modulación directa por fosforilación de la PI3K/Akt. (7) La expresión de este receptor también pudo ser comprobada en miocitos cardiacos de ratas adultas y neonatos. De igual forma, en los mencionados animales la administración exógena de EPO pudo prevenir la apoptosis de los miocitos cardiacos por igual vía metabólica. (8,9)
In vivo, el R-EPO ha podido ser demostrado en tejido cardiaco de ratas normales. Técnicas de inmunohistoquímica demostraron que el R-EPO está presente en células intersticiales, incluyendo células endoteliales y fibroblastos, con débil expresión en los miocitos cardiacos.(10) Recientemente también pudo ser comprobada la expresión de este receptor en células del tejido cardiaco de humanos. Ambos tejidos, miocárdico y células endoteliales humanas, resultaron positivos. Por otro lado no se ha podido comprobar si estas células por sí mismas son capaces de producir la EPO, como ya ha sido demostrado en hígado, sistema nervioso central (SNC) y retina. (11,12)
Un nuevo concepto de protección por parte de la EPO fue introducido por Leist y sus colaboradores en modelos animales en los cuales se generaron mutantes negativos para el receptor en células hematopoyéticas y donde se pudo demostrar su efecto protector en modelos de isquemia animal a nivel de diferentes tejidos. Esto pudo demostrar la diversidad de receptores para células no hematopoyéticas. Recientemente fue encontrado un receptor de la EPO que media su efecto protector en la isquemia y se demostró un análogo con dominio Beta en tejido miocárdico. (13,14)
EFECTOS CARDIOPROTECTORES DE LA EPO EN EVENTOS CARDIOVASCULARES ISQUÉMICOS AGUDOS
En tejidos hematopoyéticos y no hematopoyéticos, por igual, la EPO es capaz de mediar y activar diferentes vías metabólicas que llevan consigo a la inhibición de la apoptosis. La apoptosis es una de las mayores vías a través de la cual ocurre la muerte programada y ha sido implicada en múltiples enfermedades cardiovasculares como infarto miocárdico agudo (IMA), insuficiencia cardiaca congestiva (ICC), miocarditis aguda, etc. En el infarto miocárdico agudo, la apoptosis es un determinante final de su tamaño y de su extensión dependiente de la reperfusión. (15,16)
Recientemente números estudios en vivo, en ratones y conejos, han demostrado el efecto cardioprotector de EPO en el daño, mediado por los efectos isquemia / reperfusión (I/R) en el corazón. (17,18)
El pretratamiento de ratas adultas con dosis de 5000 UI/kg precediendo a la isquemia demostró una mejor recuperación funcional del corazón después del efecto I/R. Esta protección estuvo mediada por su efecto antiapoptótico como pudo ser demostrado por marcaje de la caspasa 3, que es una enzima encargada de disparar el proceso de apoptosis en conjunto con otras caspasas. El mecanismo protector estuvo mediado por la propiedad inhibitoria intrínseca de la EPO sobre la vía de la PI3K/Akt. El compromiso en la inhibición de estas vías metabólicas pudo ser descrito en modelos de aislamiento de corazón de conejo en el cual el efecto cardioprotector de la EPO pudo ser anulado por 2 inhibidores de la MAPK (p 38 y p 42/44). En algunos estudios los inhibidores de los canales del potasio también mostraron similar actividad inhibitoria, al parecer por su propiedad de limitar la entrada de calcio al espacio intracelular. Otros autores como Hanlon y sus colaboradores encontraron que otra proteína quinasa, en este caso la C, también intervenía en la cardioprotección. Estos autores demostraron que la activación de la proteina quinasa C (PKC) es requerida por la EPO antes, durante y después de la isquemia y que la protección posterior a la isquemia depende de la vía de la PI3K/Akt y la MAPK . (19,20,21)
La eritropoyetina también tiene la propiedad de reducir el daño celular a través del flujo de purinas y de esta forma reduce el número de células que entran en la apoptosis.
Aunque la inhibición de la apoptosis es el mecanismo ampliamente aceptado como cardioprotector contra la isquemia aguda, otras vías han sido demostradas. (22) El pretratamiento de los miocitos con EPO inhibe el daño isquemia-reperfusión inducido por la respuesta inflamatoria miocárdica; este evento es posible por la prevención de esta proteína en el cambio al fenotipo proinflamatorio de los miocitos y el incremento de la síntesis de óxido nítrico (ON). (23) Recientes evidencias también han podido demostrar el efecto positivo sobre la función cardiovascular por modulación directa de la bomba sodio – potasio o por estimulación directa del péptido natriurético en el atrio. (24)
En el primer estudio in vivo de los efectos cardioprotectores de la EPOhr en modelos de ratas, se pudo comprobar que la administración de 5000 UI /kg/día durante 7 días disminuyó hasta en un 50 % la pérdida de miocitos cardiacos. Por otro lado, en experimentos de IMA en conejos se pudo verificar que la administración de EPOhr antes o inmediatamente después de ejecutada la ligadura de las coronarias reduce el tamaño de la talla del infarto. Además de esto el efecto inotrópico de reserva a la acción de los agonistas beta adrenérgicos, estuvo favorecido, en el grupo tratado con EPOhr. (25,26)
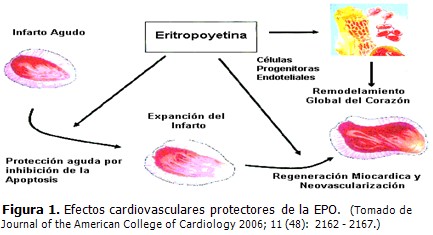
De los anteriores experimentos se deducen dos conclusiones clínicas importantes: primero, el momento más efectivo para prevenir la isquemia es antes o inmediatamente después de producido el daño y segundo, las dosis no suelen ser determinantes pues se encontraron iguales efectos a bajas y altas dosis de EPO, pero sí quedó comprobado que los receptores no hematopoyéticos son de baja afinidad. (Figura 1).
EFECTOS DE LA EPO A LARGO PLAZO EN EL CORAZÓN
Las terapias actuales en el infarto miocárdico están dirigidas a evitar o prevenir el remodelado cardiovascular y la insuficiencia cardiaca a largo plazo. La regeneración miocárdica puede ofrecer posibilidades que mejoran la función cardiovascular de estos pacientes. Aunque la regeneración y diferenciación de los miocitos cardiacos es limitada, la formación de nuevos vasos en las áreas no infartadas del corazón, a la larga, puede mejorar la función ventricular de los pacientes afectados.(27)
Dos procesos contribuyen a la formación posnatal de vasos sanguíneos: las angiogénesis o formación de nuevos vasos a partir de vasos viejos, y la vasculogénesis o formación de vasos a partir de las células progenitoras endoteliales (CPE). Estas células son células indiferenciadas que, una vez en los tejidos, son capaces de diferenciarse en células endoteliales maduras que forman los nuevos vasos sanguíneos. (27)
Recientes evidencias han podido demostrar que las CPE son movilizadas en pacientes con isquemia miocárdica aguda y que el incremento de los progenitores de este tipo se relaciona con un mejor pronóstico y sobrevida a largo plazo. (28)
La liberación de EPO es un potente estímulo para la movilización hacia la sangre periférica de las CPE las cuales están asociadas con neovascularización en tejidos isquémicos. Los efectos neovascularizantes de esta proteína también han sido hallados en modelos de isquemia cerebral. (29,30)
En recientes evidencias en las que se ha empleado la EPO de liberación sostenida se ha logrado la mejoría de la función ventricular a largo plazo en pacientes con infarto miocárdico previo. Su uso por largos periodos se debe limitar a las bajas dosis dados sus efectos adversos como son: la hipertensión arterial y la trombosis. (30)
EPO Y SISTEMA NERVIOSO CENTRAL
Experimentos recientes han podido demostrar que la EPO es capaz de atravesar la barrera hematoencefálica cuando es administrada por la vía sistémica. Por otro lado, en estudios experimentales con cultivos neuronales se ha podido comprobar que la EPO y el EPOhr son expresados tempranamente en el desarrollo fetal. También ha sido corroborada su producción en células accesorias del cerebro como los astrocitos; sus efectos funcionales sobre estas dos líneas celulares también han sido corroborados. (31,32)
La importancia neuroprotectora de las síntesis de EPO en el tejido neural ha sido demostrada por el bloqueo de sus receptores y vías metabólicas con la consecuente pérdida de la actividad neuroprotectora. (33)
En modelos experimentales de isquemia cerebral ha sido observada una fuerte regulación positiva de la EPO y sus receptores en el cerebro que ha sufrido dicha isquemia, lo cual pone de relieve su potencial efecto neuroprotector. (34)
EPO EN EL ACCIDENTE CEREBROVASCULAR ISQUÉMICO
Modelos de experimentación animal han podido verificar la actividad neuroprotectora de la EPO en modelos experimentales de isquemia cerebral. Una reducción del área de infarto cerebral pudo ser demostrada en modelos de hipoxia cerebral en ratones. En adición a esto también se pudo corroborar que se produce una reducción del infiltrado inflamatorio y la síntesis de citocinas en el tejido dañado por la isquemia. Por otra parte nuevas evidencias han mostrado una conservación de las funciones cognitivas de los animales sometidos a estos experimentos después de provocada la isquemia y administrada la EPO. (35,36)
Por otra parte, en modelos de hemorragia subaracnoidea inducida, la administración sistémica de EPO se vio correlacionada con una normalización rápida del flujo sanguíneo cerebral y una reducción del número de neuronas necróticas. Las ratas a las cuales se les indujo un daño espinal hipóxico o traumático tuvieron una recuperación motora superior cuando se les administró EPO.
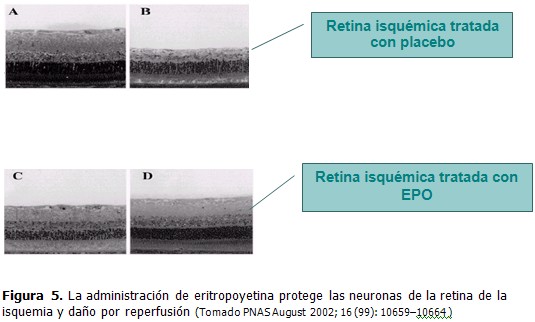
La retina parece ser otra diana importante para la EPO, se ha podido comprobar una alta síntesis de la proteína en la enfermedad venoclusiva de la retina y en las oclusiones arteriales a este nivel. No queda clara aún su responsabilidad en la génesis de la neovascularización de la retina y su papel en la neuropatía diabética y otros desordenes isquémicos de este tejido. (37)
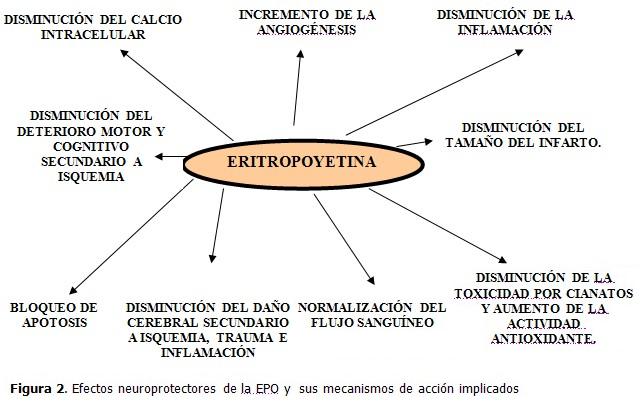
Un reciente ensayo clínico en humanos con accidente cerebro vascular isquémico pudo corroborar, que la recuperación neurológica fue más rápida en los pacientes a los cuales se les administró EPO y el tamaño del infarto también se vio reducido, en las tomografías evolutivas, en relación con el grupo control. (38,39)(Figura 2).
IMPLICACIONES TERAPÉUTICAS PARA EL USO CLÍNICO
La EPO ha sido empleada en la práctica clínica de forma satisfactoria por más de dos décadas en el tratamiento de la anemia asociada a la insuficiencia renal crónica y en la anemia asociada al paciente con cáncer. En estos pacientes la anemia es un factor de riesgo para el desarrollo de eventos cardiovasculares. Numerosos y pequeños estudios han sido realizados en estos pacientes en los cuales se han podido comprobar los beneficios cardiovasculares del tratamiento con EPO. Sin embargo, no existen grandes estudios aleatorios controlados que puedan establecer beneficios claros del tratamiento de la anemia en estos pacientes y su repercusión sobre la función miocárdica.
La anemia es un denominador común en muchos pacientes con insuficiencia cardiaca y su magnitud se ha asociado con una mayor severidad de la insuficiencia. Aunque la causa de la anemia en estos pacientes es multifactorial se ha podido comprobar un compromiso en la producción de EPO y una pobre respuesta medular a esta. Un número reducido de estudios han podido corroborar que la administración de EPO se correlacionó con una significativa mejoría de la función ventricular y una mayor capacidad para el ejercicio. (40)
Las propiedades protectoras no hematopoyéticas de la EPO también pueden ser beneficiosas en pacientes con síndromes coronarios agudos. De manera interesante , niveles elevados de EPO en pacientes con IMA reciente se correlacionan con un mejor pronóstico a largo plazo. (41)
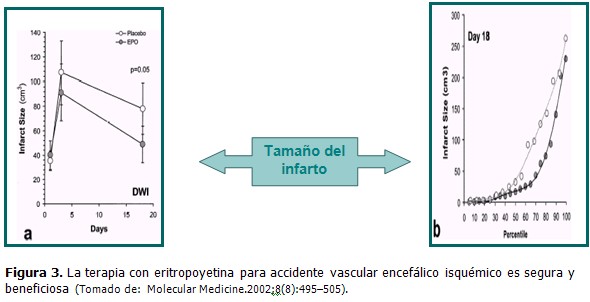
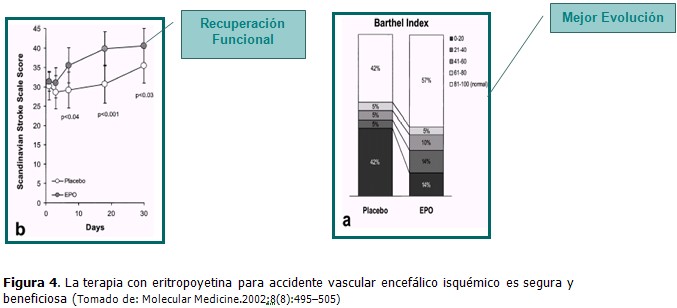
Por otra parte en ensayos clínicos de accidentes cerebro vasculares isquémicos ha sido corroborado el efecto beneficioso del empleo de EPO sobre la dimensión del infarto, la recuperación neurológica y la función cognitiva. (Figuras 3 y 4).
La retina parece otro sitio atrayente como blanco terapéutico ante la isquemia, se ha podido corroborar su efecto beneficioso en las fases tempranas de la oclusión venosa y arterial central de la retina.(Figura 5).
Resulta además tentadora su posible aplicación en los eventos isquémicos del recién nacido donde los efectos adversos de la EPO son mucho menos importantes. Su eficacia ya ha sido comprobada en el tratamiento de la anemia de la prematuridad. (42)
CONCLUSIONES
De los estudios experimentales se desprenden conclusiones importantes, la EPO es capaz de ejercer una influencia crucial en los eventos isquémicos agudos a través de la reducción del tamaño del infarto y la inhibición de la apoptosis y un segundo mecanismo: la formación de nuevos vasos.
En la clínica estos resultados de la experimentación deberán ser extrapolados a humanos en ensayos clínicos aleatorios y controlados para incorporar una nueva y eficaz arma en el tratamiento de los eventos isquémicos agudos.