INTRODUCCIÓN
La utilización de la bencilpenicilina, en los años 40 del pasado siglo, marcó el inicio del uso terapéutico de los antibióticos. A finales de esa misma década fue aislada de cepas del hongo Cephalosporium acremonium la primera cefalosporina. En lo adelante, esta familia de compuestos ha estado en constante crecimiento hasta nuestros días. (1-5)
La base estructural de las cefalosporinas lo constituye el ácido 7-aminocefalosporánico, resultado de la fusión de los anillos betalactámico y dihidrotiacínico, con sustituyentes en las posiciones 3 y 7. Su actividad antibiótica se asocia directamente al anillo betalactámico, específicamente a la reactividad a través del carbono carbonílico. El grupo carboxilo, las insaturaciones en el anillo dihidrotiacínico y la presencia de radicales amino en la posición 7, también constituyen elementos estructurales importantes en su accionar antibacteriano. La conjunción de todos ellos se refleja en las conformaciones que definen estas moléculas en el espacio tridimensional. Las modificaciones en el radical amino del carbono 7 y la existencia de sustituyentes en el carbono 3, condicionan las propiedades moleculares y dan lugar a una gran variedad de cefalosporinas. (1)
Las cefalosporinas, al igual que el resto de los antibióticos betalactámicos, actúan a nivel de la pared celular de las bacterias. Mediante una inhibición competitiva se unen a las proteínas ligadoras de penicilinas (PBPs, por las siglas en inglés de Penicillin Binding Proteins), imposibilitando que estas ejerzan su acción catalítica en la unión y entrecruzamiento de las cadenas de péptido glucan, sustancia que le confiere la forma, rigidez y estabilidad a la membrana celular de muchas bacterias de importancia médica. (6, 7) Con el paso del tiempo y en respuesta al uso indiscriminado de los antibióticos, las bacterias han reaccionado desarrollando mecanismos de resistencia que neutralizan su acción. (7-13) En el caso de las cefalosporinas el principal mecanismo está asociado a la ruptura del anillo betalactámico por la acción de enzimas betalactamasas, comúnmente denominadas cefalosporinasas. Otro mecanismo importante es la síntesis de nuevas PBPs con menor afinidad por los agentes antibacterianos. (1, 7, 8)
La resistencia a los antibióticos es un fenómeno que continúa en ascenso, convirtiéndose en un problema de salud a escala mundial. (2-6, 9) Ello ha motivado la búsqueda continua de nuevas fórmulas más potentes y generales. (14-19) Consecuentemente, se siguen incorporado a la práctica médica nuevos antibióticos activos frente a agentes patógenos muy resistentes. Según la literatura científica, uno de los más prometedores es el ceftobiprole (inicialmente BAL9141), cefalosporina de quinta generación que en los ensayos clínicos en fase III mostró ser reactiva frente a cepas de Staphylococcus aureus meticilino resistentes (MRSA, por las siglas en inglés de methicillin-resistant Staphylococcus aureus). Además, tiene una elevada afinidad por algunos tipos de proteínas ligadoras de penicilinas que son responsables de la resistencia en estafilococos y neumococos. La efectividad de este compuesto continúa siendo investigada en varios ensayos clínicos, aunque en países como Canadá y Suiza ya han aprobado su uso clínico. (2, 3, 20, 21)
Los estudios de relación estructura - actividad biológica y las investigaciones a nivel molecular, incluyendo la modelación en computadoras de estructuras moleculares, propiedades electrónicas y mecanismos de reacción, constituyen herramientas muy utilizadas en la búsqueda de nuevos conocimientos acerca de los mecanismos de acción y resistencia que involucran a los antibióticos, así como en el diseño y síntesis de nuevos compuestos de este tipo. (13-15, 22-34)
En el presente trabajo se realiza la modelación molecular de una selección de cinco cefalosporinas: cefradina, cefalexina, cefadroxilo, cefprozilo y ceftobiprole, comparando sus propiedades estructurales, densidades de cargas atómicas y características de los orbitales de frontera, lo cual puede ser de mucha utilidad en la descripción de sus propiedades químicas y en consecuencia, de su comportamiento farmacológico.
MÉTODOS
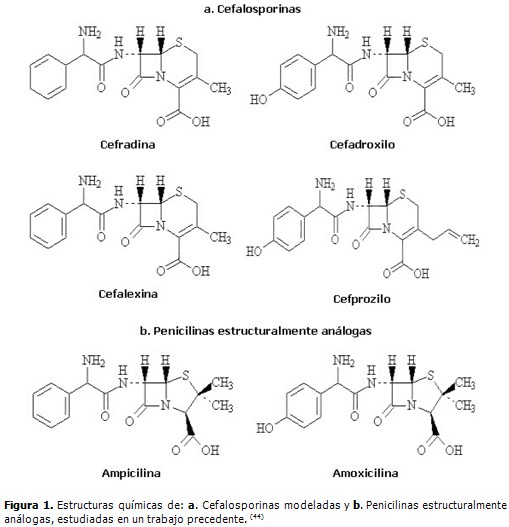
Se realizó la modelación molecular de 5 cefalosporinas, utilizando computadoras personales IBM compatibles pertenecientes a la Universidad de Ciencias Médicas de Las Tunas, desde noviembre de 2009 a marzo de 2010. Inicialmente se estudiaron 4 cefalosporinas de primera y segunda generación: cefradina, cefalexina, cefadroxilo y cefprozilo (Figura 1a), escogidas por poseer un número relativamente reducido de átomos, lo que posibilitó que se realizara la modelación molecular a un menor costo computacional; además, por tener estructuras químicas análogas o muy similares a la de compuestos pertenecientes a la familia de las penicilinas (Figura 1b). En esta selección de cefalosporinas existen diferencias que pueden afectar el radical amino en la cadena lateral unida a la posición C7 del anillo betalactámico y/o el carbono C3 del anillo dihidrotiacínico, en la estructura básica de este tipo de compuestos; aspectos relevantes para sus características farmacocinéticas. En una segunda etapa de la modelación se incluyó el ceftobiprole, cefalosporina de quinta generación alrededor de la cual se han creado numerosas expectativas por su reactividad frente a agentes patógenos muy resistentes.
Las estructuras tridimensionales se obtuvieron mediante la optimización de las geometrías moleculares aplicando cálculos semiempíricos basados en la modificación de la negación a la superposición diatómica, específicamente el modelo parametrizado 3 (PM3, Parametric Model 3); (35) empleando para ello el paquete de programas MOPAC, versión 7.01.3 para Linux. (36) Una vez obtenidas las geometrías de equilibrio se calcularon las densidades de cargas naturales y los orbitales moleculares, mediante el análisis de los orbitales naturales de enlace según la teoría del funcional de la densidad (DFT, por las siglas en inglés de Density Functional Theory) a un nivel DFT / B3LYP/6-31G(d) // HF/PM3. (37) Se utilizó la teoría de los orbitales de frontera de Fukui para analizar la reactividad. (38, 39) Estos cálculos se realizaron con el paquete de programas Gaussian 98 versión A.7 para Linux. (40) En la confección de las estructuras moleculares iniciales y la visualización de resultados se utilizaron los programas HyperChem 5.02 (versión de prueba) (41) y MOLDEN versión 3.6. (42, 43)
RESULTADOS
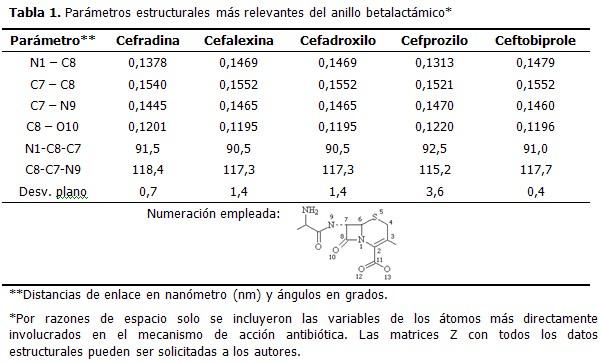
Los parámetros geométricos del anillo betalactámico no tienen variaciones significativas cuando se modifica la cadena lateral unida al carbono C7. Solo existen pequeños cambios en el cefprozilo. Este compuesto es muy similar estructuralmente al cefadroxilo, pero con un grupo –CH2CH=CH2 en lugar del radical metilo (–CH3) de la posición C3 (Figura 1a). Comparando el anillo betalactámico en ambas estructuras, es perceptible que en el cefprozilo las distancias de enlaces son ligeramente más cortas; específicamente, el enlace N1 – C8 es menor en 0,0156 nm y el C7 – C8 en 0,0031 nm. Por el contrario, existe un pequeño aumento de 2 grados en el ángulo de enlace con vértice en C8 y de 2,2 grados en la desviación del plano del anillo. Fuera del mismo, el ángulo de enlace que define la posición de la cadena radical en C7 se cierra 2,1 grados respecto al carbono carbonílico.
Descontando las pequeñas variaciones descritas para el cefprozilo, el resto de los parámetros estructurales del anillo betalactámico es muy similar entre todas las cefalosporinas modeladas. Este resultado se mantiene aunque se extienda la comparación a una cefalosporina patrón, modelada en otro trabajo precedente, con un grupo –NHCH3.como radical amino en C7 e hidrógeno en lugar de –CH3.en C3. (45) En resumen, las modificaciones en las cadenas laterales no afectan significativamente la estructura del anillo betalactámico. (Tabla 1).
Las estructuras tridimensionales obtenidas de las cuatro cefalosporinas de primera y segunda generación muestran como el oxígeno (en rojo) del grupo carbonilo en el radical amino (nitrógeno en azul) unido a C7, se orienta ligeramente en dirección del anillo betalactámico, pero en un plano por encima de este. Ello se refleja en las distancias atómicas entre el mencionado oxígeno y el carbono carbonílico del anillo (C8), átomo que define la futura unión del antibiótico al materializar su acción antibacteriana. Las referidas distancias se acercan hasta: 0,292 nm en cefadroxilo y cefalexina; 0,273 nm en cefradina y 0,232 nm en cefprozilo. No ocurre así con la cefalosporina de quinta generación. (Figura 2).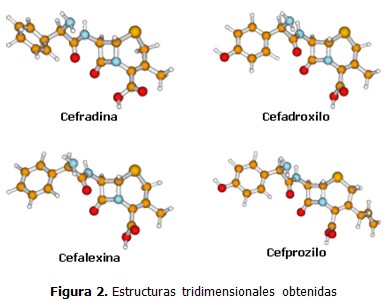
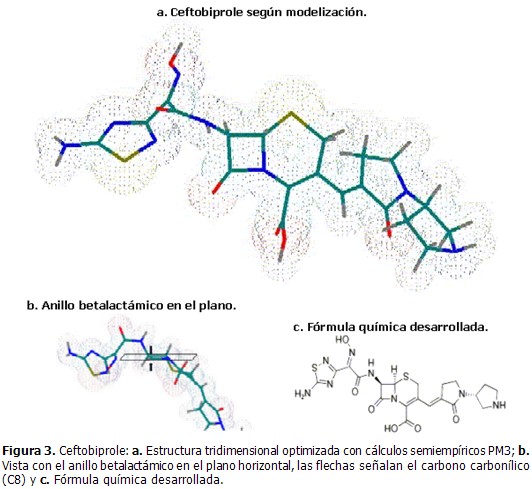
El ceftobiprole, optimizado según el modelo empleado, se muestra en la siguiente figura. En la parte superior (a) es posible ver la estructura de forma desplegada con el anillo betalactámico hacia el centro. En el extremo inferior izquierdo (b) se observa la molécula rotada, con el anillo betalactámico en el plano horizontal; es visible como el oxígeno (en rojo) del radical amino se alejó considerablemente del carbono C8 (a 0,443 nm). (Figura 3)
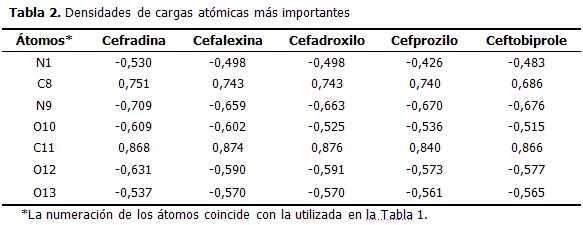
En el anillo betalactámico de todos los compuestos las mayores densidades de cargas negativas recaen sobre los heteroátomos, nitrógeno (N1) y oxígeno (O10), mientras que el carbono carbonílico (C8) tiene la mayor densidad de carga positiva. Fuera de este anillo, el grupo carboxilo del anillo dihidrotiacínico representa otra zona importante por sus densidades de cargas. En general, los valores se corresponden con el entorno electrónico de los átomos en sus respectivas moléculas. Las variaciones en las cadenas laterales no afectan apreciablemente las densidades de cargas en la base estructural de las cefalosporinas. Las mayores diferencias se localizan en N1 al comparar la cefradina con el cefprozilo; este último es 0,104 unidades menos negativo; mientras que el O10 es 0,094 unidades menos negativo en el ceftobiprole, también al compararlo con la cefradina. (Tabla 2).
El análisis de los orbitales moleculares mostró diferencias energéticas LUMO – HOMO muy similares entre todas las cefalosporinas modeladas. Los valores fueron menores a 0,2 eV, característicos de moléculas susceptibles a las transiciones electrónicas, fenómeno estrechamente relacionado con una alta reactividad química.
DISCUSIÓN
Estos resultados se enmarcan en la búsqueda de conocimientos acerca de las características moleculares de los antibióticos betalactámicos que resultan clave en la definición de sus capacidades para reaccionar, tanto al ejercer su acción antibacteriana como al ser inactivados por los agentes patógenos resistentes. Se utilizó la modelación molecular, convertida en una herramienta de elección en investigaciones de interés biomédico. (46-48) En este sentido, es reconocida la calidad de los métodos de la química cuántica (semiempíricos, ab initio y DFT) en el modelaje de propiedades moleculares. (49, 50)
En la parte metodológica se describió cómo se combinaron cálculos semiempíricos PM3 para optimizar las geometrías moleculares y DFT para las propiedades electrónicas. Esta forma de proceder fue empleada en nuestros estudios precedentes, donde se modelaron: una representación genérica de diferentes betalactámicos y una selección de penicilinas. En ambos casos se concluyó que el anillo betalactámico es muy estable geométrica y electrónicamente ante el efecto de las cadenas laterales. Sin embargo, se detectó que las diferencias en las conformaciones espaciales que implicaban una mayor o menor exposición del anillo betalactámico provocaban algunas variaciones en sus propiedades moleculares. (44, 45)
Es conocido que los antibióticos betalactámicos realizan su acción a nivel de la pared celular. El grupo –OH de la serina, presente en las proteínas ligadoras de penicilinas (PBPs) de las bacterias, ataca el carbono carbonílico del anillo betalactámico (C8). Se forma un complejo estable acil-enzima que imposibilita a las PBPs ejercer su acción catalítica en la unión y entrecruzamiento de las cadenas de péptido glucan, debilitando sustancialmente la pared celular de las bacterias. Las características estructurales y electrostáticas del antibiótico resultan fundamentales en la formación del mencionado complejo. La planaridad del anillo betalactámico, la fortaleza de los enlaces que lo conforman, la magnitud de la carga positiva en el carbono carbonílico y la disposición espacial en las vecindades de ese carbono, son algunas de las características más relevantes.
Atendiendo a ello, el análisis de los resultados obtenidos enfatiza que la geometría del anillo betalactámico no se modifica significativamente por la acción del radical amino unido a C7, coincidiendo con los trabajos anteriores. (44, 45) Esta afirmación no es posible extenderla a las cadenas unidas a C3, pues solo dos de las cefalosporinas estudiadas tienen sustituyentes diferentes al grupo –CH3.en esa posición, el cefprozilo y el ceftobiprole. En el primero existen pequeñas variaciones geométricas descritas en los resultados, mientras que en el segundo los parámetros estructurales del anillo tienen características muy similares al resto de las cefalosporinas.
En el análisis estructural, el hecho más relevante es la conformación espacial apreciablemente diferente del ceftobiprole. La molécula se dispone de una forma más alargada, sobre todo por la cadena lateral en C7, dejando que el orbital atómico p desocupado del carbono carbonílico C8 (con hibridación sp2) quede fácilmente accesible por ambas caras del plano del anillo. (Figura 3b). Otro aspecto importante en este compuesto es la cantidad de átomos de elevada electronegatividad que está presente en la estructura de las cadenas laterales. En el radical amino de C7, además de los –NH y –C=O característicos, de los otros 9 átomos diferentes de hidrógeno que conforman esa cadena, 6 son muy electronegativos: 1 oxígeno, 4 nitrógenos y 1 azufre. Por su parte, la cadena unida a C3 tiene 2 nitrógenos y 1 oxígeno. En la estructura tridimensional optimizada se observa que estos átomos quedan en posiciones muy expuestas, facilitando las interacciones electrostáticas a través de ellos. (Figura 3). Este aspecto es muy importante en el proceso de reconocimiento molecular por las PBPs y la preparación de la molécula del antibiótico para formar el complejo acil-enzima. (51, 52) Uniendo a ello la antes mencionada facilidad espacial para el acceso hasta el carbono carbonílico (C8), sitio a través del cual ocurren las transformaciones químicas asociadas a la acción antibacteriana, el ceftobiprole tiene una estructura molecular que potencia su reactividad. Existen varios trabajos donde se reportan reacciones de este fármaco frente a PBPs menos reactivas elaboradas por algunos agentes patógenos como mecanismo de resistencia; por ejemplo, las PBP1a, PBP2a, PBP2b, PBP2x y PBP3 de estafilococos y neumococos. (2, 3, 20, 21, 53-55)
Por otra parte, los resultados de las densidades de cargas atómicas y las diferencias energéticas entre los orbitales de frontera confirman lo discutido en el análisis estructural, las modificaciones en las cadenas laterales no afectan significativamente la estructura base de las cefalosporinas estudiadas. Al parecer, en las cadenas laterales están las causas directas de las diferencias farmacológicas existentes, en detrimento de la idea que son causas indirectas al inducir modificaciones en la base estructural del compuesto.
En el análisis de la reactividad no se consideró la forma espacial de los orbitales de frontera por ser poco concluyente, caracterizadas por una elevada deslocalización sobre varios átomos.
El descubrimiento en este siglo de tres nuevas clases de antibióticos, oxazolidinonas, lipopéptidos y mutilinas, puso fin a un largo período de casi 40 años sin cambios estructurales trascendentales en estos fármacos. Sin embargo, esto no ha resuelto el fenómeno de la resistencia bacteriana. Nuevas expectativas vienen acompañadas de derivados de antibacterianos clásicos como las cefalosporinas y carbapenemas. (2-6) Para enfrentar agentes patógenos resistentes pueden ser muy útiles antibióticos betalactámicos que establezcan interacciones fuertes con las PBPs en la etapa de reconocimiento molecular. Esto es posible lograrlo incorporando en las cadenas laterales sustituyentes donde existan varios átomos muy electronegativos e hidrógenos muy reactivos.
La prescripción adecuada de antibióticos, el control de su uso y la educación de la población para evitar la automedicación y el abuso en el consumo de estos medicamentos, constituyen elementos importantes que deben estar presentes en cualquier estrategia para enfrentar la resistencia bacteriana. Simultáneamente, es necesario continuar en la búsqueda y desarrollo de nuevos antibacterianos. En este sentido, la modelación molecular puede realizar aportes. En el presente trabajo, partiendo de las propiedades estructurales y electrónicas calculadas de la muestra de cefalosporinas objeto de estudio, se han llegado a conclusiones que aportan elementos a tener presente en la estructura química más idónea para este tipo de fármacos.