INTRODUCCIÓN
Las enfermedades bucodentales constituyen una de las principales afectaciones para la salud, ellas imponen graves y prolongadas secuelas. La carga mundial de enfermedad en el año 2015 estimó que las diversas infecciones orales en los individuos, son la caries en la dentición permanente, la más prevalente, que contribuye a casi la mitad de la tasa de infección mundial.(1) Los abscesos de la pulpa dental, la pulpitis irreversible, la periodontitis apical asintomática y avanzada no se detectan en alrededor del 45 al 50 % de los individuos de una población. Los avances biotecnológicos en medicina regenerativa han transformado la odontología traslacional para enfatizar a largo plazo y el pronóstico a través de varios hallazgos científicos en materiales biomiméticos, como son las nuevas células madre postnatales, son eficientes en la ingeniería de tejidos con andamios, sembrados con factores de crecimiento, miméticos de señalización intracelular en los factores de transcripción.(2,3)
Según Choudhury y cols.(4) la recuperación eficiente de los tejidos, la reparación de estructuras dentales basadas en tejidos duros puede ser un reto, ya que el esmalte es incompetente para regenerarse y la dentina con el cemento está parcialmente restringida como autoregeneradores. La infección pulpar prolongada acaba provocando una caries secundaria, por el limitado suministro de sangre al tejido pulpar de la dentina, dificultando así la reparación de la dentina. Debido a los límites anatómicos únicos del diente, y a las deficiencias de la pulpectomía parcial y los procedimientos endodónticos, la ingeniería es un microambiente adecuado que media entre la angio/vasculogénesis y la inervación que es un requisito clave. Los intentos clínicos de regenerar la pulpa han cobrado sentido con la llegada de los modernos sistemas de ingeniería tisular que exploran las células madre dentales.
En los últimos años, el tamaño del mercado mundial basado en la terapia celular aumentó exponencialmente hasta alcanzar los 7,800 millones de dólares en 2020, con una tasa de crecimiento anual compuesto de un 15 %, lo que representa la odontología regenerativa como la disciplina más rápida y práctica.(5) Las células madre derivadas de la pulpa dental, el ligamento periodontal gingival, quistes periapicales y otros tejidos orales tienen un importante potencial terapéutico y de diferenciación. La capacidad de reparar y equilibrar la inflamación local es muy prometedora para la odontología regenerativa. La matriz intrínseca y el potencial de secreción de citoquinas pueden formar construcciones análogas a un tejido más grande y exclusivo con construcciones similares, desprovistas de biomateriales como: estrategias sin andamios.(6)
A pesar de mostrar mecanismos específicos de los tejidos, los enfoques basados en células pueden experimentar una localización y retención celular deficiente y bajas tasas de supervivencia en el lugar de la herida tras el trasplante. Varios estudios han revelado que las tasas de supervivencia del inóculo de las células inyectadas son pobres en el lugar de la inyección tras el trasplante.(6)
Para superar estos obstáculos Cunniffe y cols.(7) detallan que: los andamios combinados con células madre, dan señales, e incorporan polímeros biodegradables mecánicamente estables para producir análogos funcionales de tejidos tridimensionales (3D). Los andamios 3D evitan el daño celular por factores externos y facilitan un microambiente celular amigable para la liberación de factores de crecimiento formadores de tejidos. Varios andamios como hidrogeles, esponjas, fibras, películas, emulsiones, etc., han sido desarrollados con demostración de seguridad, eficacia preclínica y medio de administración de células, pero apenas unos pocos están aprobados a nivel federal específicamente para la odontología regenerativa.
Las restricciones en la experimentación científica, los costos asociados a la escalabilidad y la tecnología, denominada de la mesa de laboratorio al sillón dental, requieren una alternativa significativamente competente y un resultado clínico reproducible, que cumpla con los marcos normativos vigentes, estrategias que van desde la llegada del hueso a los andamios biomiméticos, matrices electrospun a medida hasta sistemas más precisos, de nueva generación y multifuncionales.(8)
Motivados por las múltiples evidencias acerca del tema, se realizó la presente revisión que tuvo como objetivo profundizar sobre los avances en las estrategias de ingeniería tisular modular neotérica en odontología regenerativa.
DESARROLLO
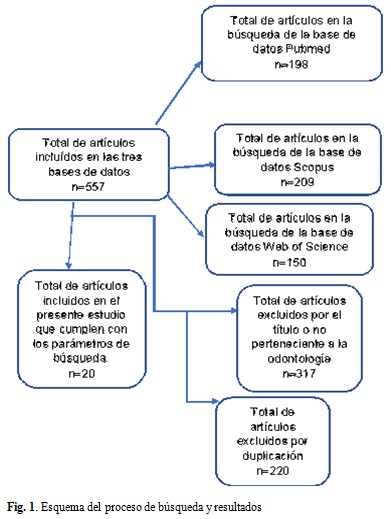
Se realizó una revisión bibliográfica utilizando las bases de datos: Scopus, Pubmed y Web of Science. Se determinaron los criterios de búsqueda según los descriptores de salud. Se estableció un rango de 5 años (del 2018 hasta el 2022) para la selección de la literatura y cuyo tema central fuera los avances de la ingeniería tisular modular en odontología regenerativa. Se obtuvieron 557 artículos en las bases de datos referidas. (Fig. 1).
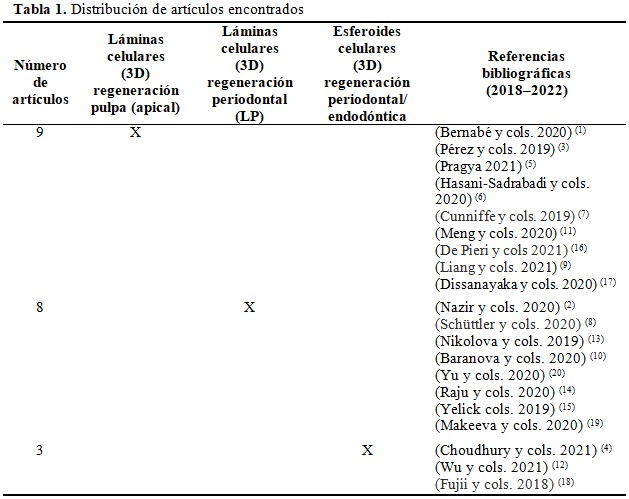
Los resultados del análisis de los 557 artículos de investigaciones realizadas en diferentes países y bases de datos, publicados en el período 2018 a 2022 se muestran a continuación. (Tabla 1).
El desarrollo de los dientes comienza con la embriogénesis y alcanza maduración a través de una serie de procesos celulares y tisulares. La constante interrelación epitelio-mesénquima, gobernada de la señalización de los reguladores morfogenéticos, facilitan al tejido y contribuye a la morfología del diente. El ligamento periodontal es un intrincado tejido accesorio que oculta las células madre odontogénicas y conecta el diente y el hueso alveolar.(9)
Baranova y cols.(10) detallan que, las terapias para la recuperación del diente se enfrentan a un importante enigma, a pesar de los avances tecnológicos y las investigaciones existentes. Se han conceptualizado varios métodos para su regeneración, pero se encuentran en una fase experimental incipiente. El esmalte acelular mineralizado con alta resistencia mecánica, flexibilidad, resistencia a la fractura y compatibilidad con los tejidos, compuesto por alargadas y paralelos prismas de hidroxiapatita, es extremadamente complejo de regenerar anatómicamente. Aunque una barrera mucosa imparte una fuerte defensa inmunológica al diente, su susceptibilidad a nivel microbiano y patológico es la formación de caries dental.
La infección cariogénica prolongada puede afectar al conducto radicular, el tejido pulpar-dentinario y, finalmente, el hueso maxilar, al alterar la función fisiológica de la dentina. En la enfermedad periodontal, los patógenos orales y una respuesta inflamatoria inmunológica desregulada pueden causar un deterioro del tejido gingival periodontal, el cemento y el hueso alveolar. Puede producir anquilosis, la dentinogénesis imperfecta, la agenesia dental pueden influir negativamente en la odontogénesis, la erupción dental y la calcificación.(10)
La variación de las estructuras morfológicas de la superficie oclusal corona y la raíz del diente en diferentes tipos de dientes es una preocupación cuando se diseña un diente. Para mantener un diente vital se requiere una inervación para su supervivencia. El diente posee estructuras contínuas asociadas, a la pulpa y el ligamento periodontal. Extraer el diente del alveolo puede causar resequedad e interrumpir la continuidad celular de los vasos sanguíneos y el nervio-hueso pierde la continuidad del nervio, dañando así la pulpa y el ligamento periodontal de forma permanente. El grado de regeneración del ligamento periodontal depende del tiempo de reimplantación del diente en el alveolo.(9)
Mientras que la reimplantación inmediata en el alveolo puede permitir la recuperación parcial del ligamento periodontal, un retraso puede afectar a la viabilidad y provocar varios problemas como la anquilosis después del reimplante, tras la reabsorción de la raíz del diente a nivel del hueso. La pulpa dental está inervada por axones nerviosos simpáticos que sobresalen del foramen apical en la pulpa radicular con una intrincada red de nervios y vasos sanguíneos que actúan en la constricción de los vasos en el interior de la pulpa. Una brecha inusual en el foramen apical afecta a la capacidad de recuperación del suministro de sangre/nervio que conduce a la necrosis, además, la extracción del diente también puede cortar el suministro de los tejidos pulpares.(12)
El paradigma de las láminas celulares es beneficioso en aplicaciones endodónticas y periodontales. Recientemente, los dispositivos implantables, basados en células humanas han demostrado su eficacia en términos de seguridad y accesibilidad a una diversa gama de resultados clínicos, como el uso de células madre de la pulpa dental humana para curar defectos óseos a nivel experimental en ratones. Las células madre cultivadas con un derivado osteogénico de la helioxantina en placas a una temperatura adecuada mostraron que la diferenciación celular indujo en comparación con las placas de control después de 8 semanas. Se utilizaron células madre derivadas de la porción apical para desarrollar láminas celulares en 3D para la renovación del complejo dental-pulpar/dentina la renovación de complejos dental/dentina que mostraron una alta secreción y un potencial odontogénico como lo demuestran la fosfatasa alcalina, las sialoproteínas óseas y los niveles de expresión del ARNm del gen relacionado con Runt-Related Transcription Factor 2, conocido por Runt o RUNX2, (por sus siglas en inglés). Tras el trasplante, in vivo, los gránulos combinados con fragmentos de matriz de la dentina mostraron una formación de tejido vascular.(13)
Las láminas celulares según Raju y cols.(14) muestran una reparación sustancial del tejido periodontal al trasplante en el lugar de destino. Láminas celulares derivadas de tejido del ligamento periodontal humano cultivadas en placas termorresistentes con un medio sustituido por suero autólogo mostraron una mayor adhesión celular, aumento de la altura ósea radiográfica, y una disminución de la profundidad de sondeo periodontal en pacientes afectados tras el trasplante. Se fabricaron láminas celulares multicelulares complejas en 3D, de capas de células originadas del ligamento periodontal y células similares a los osteoblastos, para formar estructuras de tejido óseo-ligamentoso en tejidos ectópicos.
Como la densidad celular inicial es considerablemente baja en los sistemas sin andamio, la proliferación y la migración celular no son factores limitantes, mientras que la formación de tejido se logra en un plazo corto. La regeneración tisular mediante enfoques sin andamios permite la interacción celular directa sin ninguna intrusión exógena, creando así el microambiente necesario y eficaz. En la ingeniería de tejidos con láminas celulares, además de poseer un enorme potencial medicinal y curativo, las células tienen características bioquímicas superiores específicas de los tejidos y características mecánicas. Al emplear una variedad de células terapéuticamente competentes como las células madre mesenquimales, las células adultas y las células madre pluripotentes inducidas exploradas para el trasplante celular preclínico y clínico han mostrado resultados prometedores.(13)
Liang y cols.(9) expresan, que el éxito del trasplante de células depende de la eficacia de las células, una buena tasa de supervivencia y una integración celular apreciable con un efecto adverso menor o nulo en el huésped. Las técnicas de trasplante, que se utilizan en infusión intravenosa/intraarterial o la inyección directa en el tejido, tienen limitaciones. El desarrollo y la regeneración de los tejidos orales mediante procesos biocelulares han llevado a la aparición de nuevos enfoques regenerativos basados en la respuesta hipóxica, como el preacondicionamiento y la estimulación hipóxica farmacológica.
El éxito de estas técnicas ha mostrado diversas vías para que los sensores de oxígeno celulares ayuden a la subsistencia de las células y al equilibrio de los tejidos, así lo señalan varios estudios. La investigación clínica sobre las respuestas curativas basadas en la hipoxia para la odontología regenerativa ha sido muy frecuente en la última década.(16)
Dissanayaka y cols.(17) afirman que los esferoides celulares son posiblemente los bloques de construcción más utilizados en la ingeniería de tejidos sin andamios debido a su alta accesibilidad y facilidad de manejo, su autoensamblaje espontáneo y la agregación celular. Fabricados por medio de cultivo de gotas, cultivo de gránulos y giros, superposición de líquidos, microfluídica de levitación magnética, centrifugación, superficies celulares no adhesivas, etc. La difusión en gradiente del medio de crecimiento celular determina el tamaño de los esferoides en los cultivos. Los esferoides muestran una prominente angio/vasculogénesis y capacidad de regeneración, lo que se acredita a las células y se asemeja a la configuración biológica de la estructura tisular 3D. En esta investigación se enfatiza en los esferoides celulares, los más utilizados en la regeneración tisular modular. En el futuro se proyecta su utilización con los sistemas robóticos automatizados para mejorar la capacidad de renovación celular.
Los exosomas son vesículas extracelulares unidas a la membrana y encerradas dentro de la capa de fosfolípidos del lumen endosomal de las células que comprende, ADN, ARN y proteínas. Vitalmente, los exosomas regulan las funciones paracrinas que muestran la interacción célula/célula-ECM que afecta a la funcionalidad de la célula receptora. En los tejidos orales y dentales, los exosomas actúan como una diferenciación odonto/osteogénica e influyen en las respuestas inmunitarias innatas y adquiridas.(17,18)
Los exosomas derivados de células madre pueden activar varias vías de reparación endógena para mantener el equilibrio homeostático, la inmunomodulación dentro de las células receptoras e iniciar la reparación del tejido. La última inclusión de bloques de construcción sin andamios es el tejido. Las células se aclimatan para autoagregarse y formar minibloques de tejido sin andamios que se acumulan en múltiples construcciones celulares para la formación de tejidos y órganos complejos. Los hilos de tejidos han sido hasta ahora los candidatos más prometedores para la fabricación rápida de tejidos construidos biomiméticamente. Las hebras de tejido imitables a gran escala derivadas únicamente de tejidos u órganos y cultivados en un medio líquido o casi sólido para formar parches de tejido se han utilizado para la ingeniería de tejidos y como modelos de tejidos para el diseño de fármacos.(18,19,20)
CONCLUSIONES
La ingeniería tisular modular ha surgido como una estrategia de fabricación prometedora para la regeneración de tejidos cohesivos multifacéticos. Los enfoques sin andamios combinan diferentes células para formar la compleja arquitectura de los tejidos mediante el ensamblaje de bloques de construcción moleculares heterogéneos.
Los enfoques sin andamios, como los basados en andamios complementarios en puntos variables, estabilizan la pulpa/periodonto, la inflamación pulpar/periodontal y su regeneración junto con la maduración del esmalte. Si bien se han producido avances sustanciales en los tejidos, su ámbito de comercialización aún no se ha alcanzado y aún no es utilizado en la práctica clínica.
Conflicto de intereses:
Los autores declaran la no existencia de conflictos de intereses relacionados con el estudio.
Los roles de autoría:
1. Conceptualización: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
2. Curación de datos: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
3. Análisis formal: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
4. Adquisición de fondos: Esta investigación no contó con la adquisición de fondos.
5. Investigación: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
6. Metodología: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
7. Administración del proyecto: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
8. Recursos: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
9. Software: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
10. Supervisión: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
11. Validación: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
12. Visualización: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
13. Redacción del borrador original: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
14. Redacción, revisión y edición: Nathalie Steffy Ponce Reyes, Myrian Margarita Grijalva Palacios, Carlos Mauricio Saeteros Cárdenas, Adriana Katherine Quezada Quiñonez.
REFERENCIAS BIBLIOGRÁFICAS
1. Bernabé E, Marcenes W, Hernández C, Bailey J, Abreu L, Alipour V, et al. Global, regional, and national levels and trends in burden of oral conditions from 1990 to 2017: a systematic analysis for the global burden of disease study. J Dent Res. 2020;99(4):362-73.
2. Nazir M, Al-Ansari A, Al-Khalifa K, Alhareky M, Gaffar B, Almas K, et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020;20(2):2-8.
3. Peres M, Macpherson L, Weyant R, Daly B, Venturelli R, Mathur M, et al. Oral diseases: a global public health challenge. Lancet. 2019;394(10194):249-60.
4. Choudhury G, Panda S, Garahnayak M. Possible pathways of disease communication of the endo-perio lesions and their management. Indian J Foren Med Toxicol. 2021;4(14):8416-9.
5. Pragya A. Effect of Different Root Canal Filling Materials in Endo-Perio Lesions: Design and Computational Analysis. Design for Tomorrow. 2021;223(10):485-94.
6. Hasani M, Sarrion P, Pouraghaei S, Chau Y, Ansari S, Li S, et al. An engineered cell-laden adhesive hidrogel promotes craniofacial bone tissue regeneration in rats. Sci Transl Med. 2020;12(534):1-13.
7. Cunniffe G, Díaz P, Sheehy E, Critchley S, Almeida H, Pitacco P, et al. Tissue-specific extracellular matrix scaffolds for the regeneration of spatially complex musculoskeletal tissues, Biomaterials. 2019;188(2):63-73.
8. Schüttler K, Bauhofer M, Ketter V, Giese K, Eschbach D, Yenigün M, et al. Direct incorporation of mesenchymal stem cells into a Nanofiber scaffold-in vitro and in vivo analysis. Sci Rep. 2020;10(9557):1-15.
9. Liang C, Liao L, Tian W. Stem cell-based dental pulp regeneration: insights from signaling pathways. Stem Cell Rev Rep. 2021;17(4):1251-63.
10. Baranova J, Büchner D, Götz W, Schulze M, Tobiasch E. Tooth formation: are the hardest tissues of human body hard to regenerate? Int J Mol Sci. 2020;21(11):4031.
11. Meng H, Hu K, Zhou Y, Ge Z, Wang H, Wu C, et al. A sandwich structure of human dental pulp stem cell sheet, treated dentin matrix, and matrigel for tooth root regeneration. Stem Cell Dev. 2020;29(10):521-32.
12. Wu M, Liu X, Li Z, Huang X, Guo H, Guo X, et al. SHED aggregate exosomes shuttled miR-26a promote angiogenesis in Pulp regeneration via TGF-b/SMAD2/3 signaling. Cell Prolif. 2021;54(7):1-20.
13. Nikolova M, Chavali M. Recent advances in biomaterials for 3D scaffolds: a review. Bioact Mater. 2019;4(7):271-92.
14. Raju R, Oshima M, Inoue M, Morita T, Huijiao Y, Waskitho A, et al. Three-dimensional periodontal tissue regeneration using a bone-ligament complex cell sheet. Sci Rep. 2020 10(1):1656.
15. Yelick P, Sharpe P. Tooth bioengineering and regenerative dentistry. J Dent Res. 2019;98(11):1173-82.
16. De Pieri A, Rochev Y, Zeugolis D. Scaffold-free cell-based tissue engineering therapies: advances, shortfalls and forecast. Npj Regen Med. 2021;18(21):1-15.
17. Dissanayaka W, Zhang C. Scaffold-based and scaffold-free strategies in dental pulp Regeneration. Journal Endod. 2020;46(9):81-9.
18. Fujii Y, Kawase Y, Hojo H, Yano F, Sato M, Il Chung U, et al. Bone regeneration by human dental pulp stem cells using a helioxanthin derivative and cell-sheet technology. Stem Cell Res Ther. 2018;9(1):24.
19. Makeeva M, Daurova F, Byakova S, Turkina A. Treatment of an endo-perio lesion with ozone gas in a patient with aggressive periodontitis: a clinical case report and literature review. Clin Cosmet Invest Dent. 2020;12(3):447-64.
20. Yu T, Klein O. Molecular and cellular mechanisms of tooth development, homeostasis and repair. Development. 2020;147(2):12.