INTRODUCCIÓN
Streptococcus pneumoniae (S. Pneumoniae) es causa importante de morbilidad y mortalidad a nivel mundial, es el agente causal más común de neumonía bacteriana en niños. La Organización Mundial de la Salud (OMS) publicó que el 15 % de muertes en menores de 5 años en 2017 fueron causadas por infecciones neumocócicas.(1) Actualmente, están disponibles dos tipos de vacunas antineumocócicas: las conjugadas de uso en la población pediátrica y las de polisacáridos que son más eficaces en adultos. La OMS recomienda la inclusión de las vacunas antineumocócicas conjugadas (PCV) en los programas de inmunización infantil a nivel global.(2) En 2000 se otorgó la autorización oficial a una vacuna para niños que protege contra siete serotipos de S. Pneumoniae (4, 6B, 9V, 14, 18C, 19F y 23F), llamada PCV7. Esta vacuna es conjugada y se expandió en 2010 para proteger contra 13 serotipos (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F y 23F), y cambió su nombre a PCV13.
En China, la enfermedad neumocócica también es una causa importante de morbilidad y mortalidad en el niño.(3) Entre los años 2010 a 2015, cada año murieron 350,000 niños menores de 5 años por neumonía.(4) La PCV7 fue autorizada en 2008 para su uso en China continental. Debido a su alto precio de importación, esta vacuna no se incluye en el programa de vacunación infantil (PVI). En general, las tasas de cobertura de esta vacuna es baja, alcanzando en 2016 el 10 % de los niños.(5) La PCV13 fue autorizada para su uso en China continental desde noviembre de 2016, pero tampoco se ha incluido en el PVI por el elevado precio en el mercado.
La resistencia de S. pneumoniae a los medicamentos antimicrobianos ha escalado dramáticamente a nivel mundial con el uso generalizado de los antibióticos en las últimas tres décadas.(6) Sin embargo, las cepas resistentes se han reducido debido a la introducción de las vacunas antineumocócicas. Se ha demostrado que las PCV son herramientas poderosas para reducir no solo la morbilidad por S. pneumoniae sino también la resistencia antimicrobiana.(7) En muchos países, la resistencia sigue siendo muy grave por el abuso de antibióticos y la aplicación limitada de las vacunas. En China no se ha establecido un sistema nacional para la vigilancia de las enfermedades neumocócicas. Este trabajo se centra en explorar la distribución de serotipos y la resistencia antimicrobiana de neumococos en la población pediátrica de China a partir de literatura publicada en los últimos seis años. Se ofrecen conclusiones en forma de resumen y recomendaciones para la realización de futuros estudios.
MÉTODOS
Se utilizó la revisión de alcance (scoping review), consistente en un proceso de “mapeo” de la literatura y de la evidencia científica, con el objetivo de resumir resultados de investigaciones sobre el tema concreto. Esta estrategia metodológica ha sido utilizada en varios estudios del ámbito de la salud pública.(8) Se redactó el manuscrito según el estándar PRISMA-ScR.(9)
Fuentes de información
La búsqueda se realizó durante los meses de enero y febrero de 2022, a partir de PubMed (MedLine) y las bases de datos de China: China National Knowledge Infrastructure (CNKI), WanFang Data. Se consideraron los informes de la OMS y la Red de Vigilancia Antimicrobiana de China (CHINET).
Búsqueda y selección de los estudios
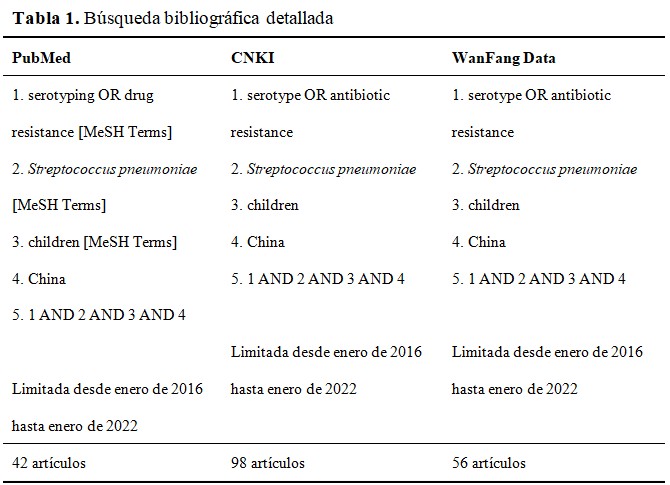
En las bases de datos en lengua inglesa se introdujo la siguiente cadena de búsqueda: (serotype OR drug resistance [MeSH Terms]) AND (streptococcus pneumoniae [MeSH Terms]) AND (children [MeSH Terms]) AND (China). En las que aceptan el chino, el algoritmo fue (serotype OR antibiotic resistance) AND (streptococcus pneumoniae) AND (children) AND (China). En total se extrajeron 196 referencias. (Tabla 1).
Criterios de inclusión y exclusión:
Se incluyeron los artículos que cumplen los siguientes criterios:
1. Los artículos que analizan distribución de los serotipos o resistencia antimicrobianas de S. Pneumoniae.
2. Los sujetos de estudio son niños menores de 18 años en China o son cepas de S. Pneumoniae aisladas de niños menores de 18 años en China.
3. Los artículos publicados desde enero de 2016 hasta enero de 2022.
4. Los artículos redactados en inglés o en chino.
Se excluyeron los artículos que tienen por lo menos uno de los siguientes criterios:
1. Los artículos de revisión
2. Los artículos que contienen los datos de adultos y no se puede extraer los datos de niños.
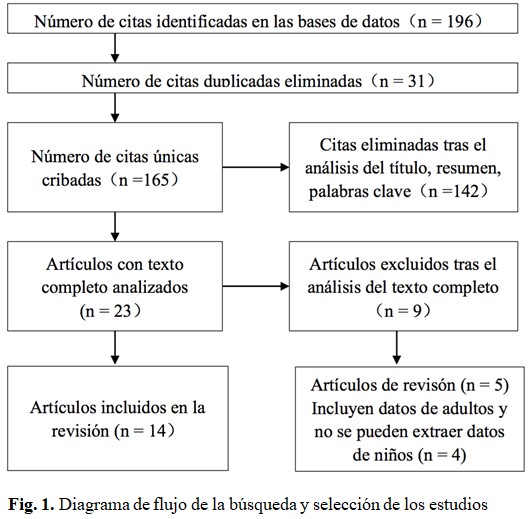
Dos autores revisaron los artículos de forma independiente, de acuerdo con los criterios de inclusión y exclusión. Como se expone en la figura 1, de 196 artículos recogidos en las bases de datos, se retiraron las publicaciones duplicadas y se incluyeron 23 trabajos mediante el análisis del título, el resumen y palabras clave. A los artículos que superaron este filtro se les sometió a un nuevo proceso de cribado con la lectura completa de los textos. Se realizó un análisis en común de los participantes y mediante discusión y consenso, se solventaron las diferencias, finalmente se incluyeron 14 artículos en esta revisión.(10,11,12,13,14,15,16,17,18,19,20,21,22,23) (Fig. 1).
Recopilación, resumen e informe de los resultados.
Tras la discusión entre los participantes, finalmente se extrajeron las siguientes informaciones de los estudios incluidos: nombre del primer autor y año de publicación, revista, tipo de estudio, periodo de estudio, localización geográfica, técnica de serotipificación, pruebas de susceptibilidad antimicrobiana y los resultados obtenidos de distribución de serotipos y resistencia antimicrobiana de S. pneumoniae. Se realizó una síntesis cualitativa descriptiva de los logros de los estudios incluidos.
Rigor científico
La búsqueda en las tres bases de datos referidas, condujo a un mapeo exhaustivo, pero las revisiones de alcance no priorizan el establecimiento de filtros en función del diseño o de la calidad de los estudios encontrados.(24, 25)
Ética y diseminación
Dado que la metodología de scoping review consiste en revisar los artículos publicados, no se requiere aprobación por ningún comité de ética.
DESARROLLO
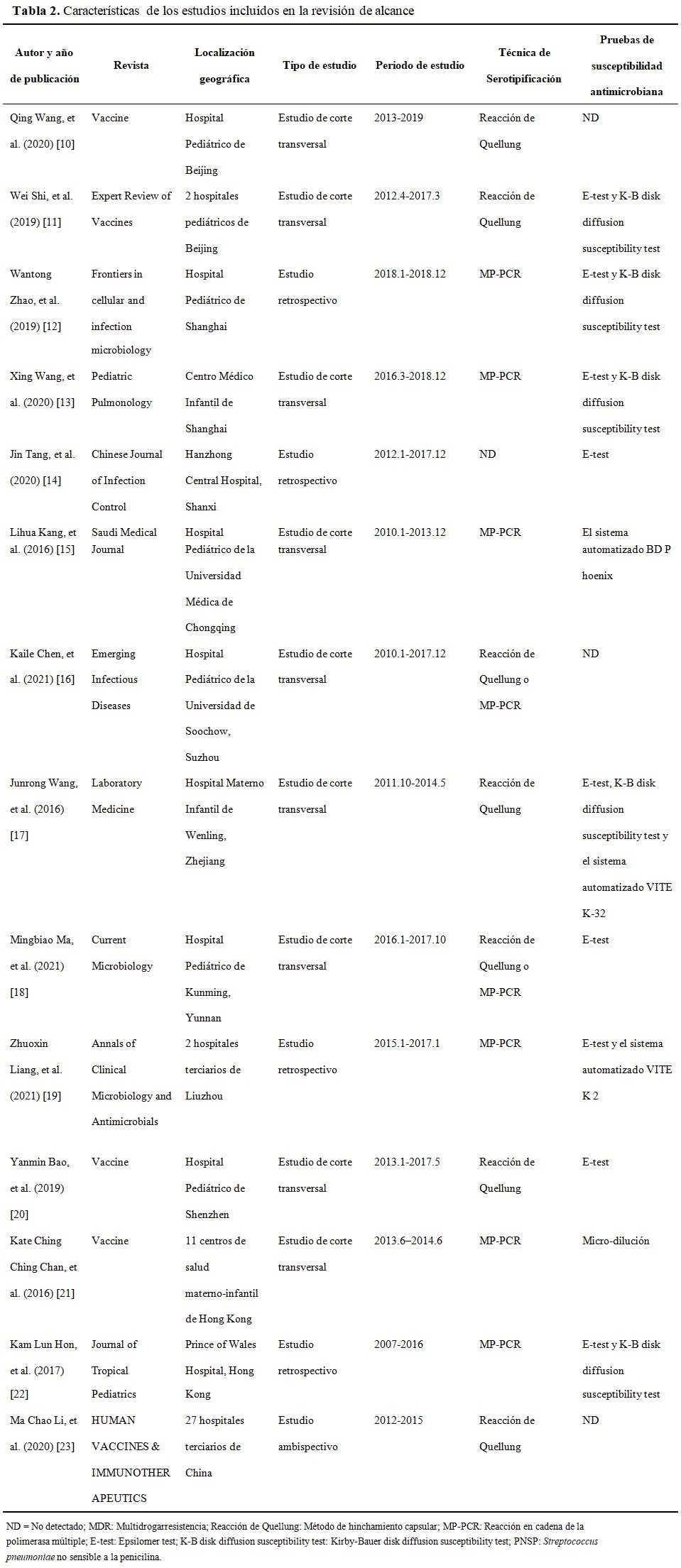
En cuanto a diseño de estudio, se observó que todos los estudios incluidos son observacionales, hay nuev de corte transversal, cuatro retrospectivos y uno ambispectivo. La serotipificación de S. Pneumoniae se realizó por el método de hinchamiento capsular o la reacción en cadena de la polimerasa múltiple. Las pruebas de susceptibilidad a antimicrobianos de S. pneumoniae en laboratorio fueron microdilución, E-test, K-B disk difusion susceptibility test, el sistema automatizado BD Phoenix, el sistema automatizado VITEK 2 y VITEK-32. (Tabla 2).
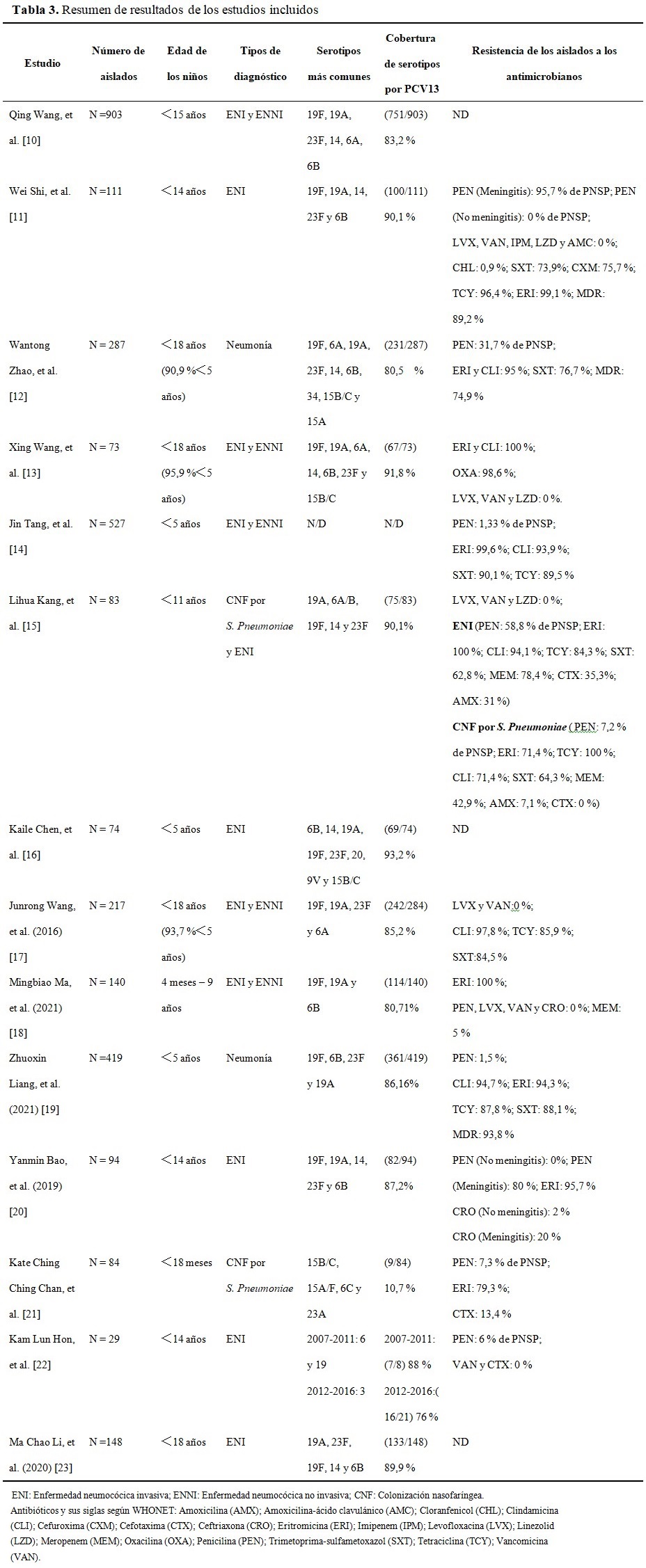
A continuación se ofrece un resumen de los resultados de los estudios. (Tabla 3).
De los estudios incluidos, dos fueron conducidos en Beijing. En el estudio de Wang Q (2020),(10) los serotipos más comunes fueron: 19F (36,0 %), 19A (13,6 %), 23F (9,4 %), 14 (8,9 %), 6A (6,9 %) y 6B (5,3 %). En el estudio de Shi W (2019),(11) los serotipos más frecuentes fueron: 19F (22,5 %), 19A (17,1 %), 14 (16,2 %), 23F (13,5 %) y 6B (9,0 %). La mayoría de los aislados fueron sensibles a vancomicina, levofloxacina, amoxicilina-ácido clavulánico, linezolid y cloranfenicol. El 96,4 % fueron resistentes a tetraciclina y el 100 % fueron resistentes a eritromicina. El 89,2 % de los aislados se definieron como bacterias multidrogorresistentes.
Otros dos estudios fueron conducidos en Shanghai. En el estudio de Zhao WT (2019),(12) los serotipos más frecuentes fueron: 19F (33,4 %), 6A (11,8 %), 19A (9,8 %), 23F (8,4 %), 14 (8,4 %), 6B (8,0 %), 34 (2,8 %), 15B/C (2,4 %) y 15A (2,1 %). La prevalencia de no susceptibles a la penicilina (PNSP) fue del 31,7 %. Más del 95 % de los aislamientos mostraron una alta resistencia a eritromicina y clindamicina. El 74,9 % de los aislamientos se definieron como bacterias multidrogorresistentes. En el estudio de Wang X (2020),(13) los serotipos más detectados fueron: 19F (39,7 %), 19A (16,4 %), 6A (11,0 %), 14 (9,6 %), 6B (8,2 %), 23F (6,8 %) y 15B/C (1,4 %). Todas las cepas mostraron resistencia a eritromicina y clindamicina, pero susceptibles a levofloxacina, moxifloxacina, vancomicina y linezolid.
En el estudio de Tang J (2020),(14) la prevalencia de PNSP fue del 1,33 %; la mayoría de los aislados fueron muy resistentes a eritromicina, clindamicina, trimetoprima-sulfametoxazol y tetraciclina.
En el estudio de Kang LH (2016),(15) los serotipos más comunes fueron: 19A (20,4 %), 6A/B (20,4 %), 19F (15,7 %), 14 (14,5 %) y 23F (10,8 %). Todos los aislados fueron sensibles a vancomicina, linezolid, levofloxacina y moxifloxacina.
En el estudio de Chen KL (2021),(16) los serotipos más comunes fueron: 6B (28,4 %), 14 (18,9 %), 19A (18,9 %), 19F (12,2 %), 23F (10,8 %), 20 (4,1 %), 9V (4,1 %) y 15B/C (2,7 %). En el estudio de Wang JR (2016),(17) los serotipos más comunes fueron: 19F (31,3 %), 19A (15,2 %), 23F (11,5 %) y 6A (10,1 %). Todos los aislados fueron sensibles a vancomicina y levofloxacina, la mayoría de los aislados fueron muy resistentes a trimetoprima-sulfametoxazol, tetraciclina y clindamicina. El 98,2 % de los aislados se definieron como multidrogorresistentes.
En el estudio de Ma MB (2021),(18) en niños < 2 años, los serotipos más comunes fueron: 19F (28,0 %), 19A (22,4 %) y 6B (14,6 %). En niños ≥ 2 años, los serotipos más comunes fueron: 19F (39,2 %), 19A (17,6 %) y 6B (13,7 %). No se encontró ningún aislado resistente a penicilina, ceftriaxona, levofloxacina o vancomicina. La prevalencia de resistencia a meropenem y eritromicina fue del 5 % y 100 %, respectivamente.
En el estudio de Liang ZX (2021),(19) los serotipos más prevalentes fueron 19F (46,8 %), 6B (11,5 %), 23F (9,5 %) y 19A (9,3 %). La mayoría de los aislados de S. pneumoniae fueron resistentes a eritromicina, tetraciclina, clindamicina y trimetoprim-sulfametoxazol. En el estudio de Bao YM (2019),(20) del Hospital Pediátrico de Shenzhen, se obtuvieron un total de 94 aislados, los serotipos mayormente detectados fueron 19F (25,5 %), 19A (19 %), 14 (17 %), 23F (7,5 %) y 6B (9,6 %). La mayoría de los aislados fueron resistentes a eritromicina.
Hong Kong limita con Shenzhen, es una región administrativa especial de China. En noviembre de 2011 el gobierno local importó e incluyó la PCV13 en el PVI, la tasa de vacunas del PVI es superior al 95 % en Hong Kong.(26) La investigación de Chan KCC (2016),(21) se llevó a cabo entre 2013 y 2014. Los serotipos más prevalentes fueron: 15 (15B/C: 16,7 %; 15A/F: 9,5 %), 6C (15,5 %) y 23A (13,1 %). La prevalencia de PNSP fue de 7,3 %. La prevalencia de resistencia a cefotaxima y eritromicina fue de 13,4 % y 79,3 %, respectivamente.
En la investigación de Hon KL (2017),(22)los serotipos mayormente detectados fueron: 6 (50 %) y 19 (50 %), entre los años 2012-2016 fue el serotipo 3 (57,1 %). La prevalencia de PNSP fue del 6 % y todos fueron sensibles a cefotaxima y vancomicina. Un estudio observacional multicéntrico recolectó aislados de S. pneumoniae de ENI en sujetos pediátricos y adultos de 27 hospitales terciarios en China continental. En el grupo pediátrico se recogieron 102 aislados en la fase retrospectiva, se obtuvieron 46 aislados en la fase prospectiva, los serotipos más comunes fueron 19A (20,9 %), 23F (20,3 %), 19F (19,6 %), 14(8,1 %) y 6B (6,1 %).(23)
Hay 13 artículos que analizan la distribución de serotipos de S. Pneumoniae, los serotipos más frecuentemente registrados son los siguientes con sus rangos entre paréntesis: 19F (12,2 %-46,8 %), 19A (9,3 %-22,4 %), 23F (6,8 %-20,3 %), 14 (8,4 %-18,9 %) y 6B (5,3 %-28,4 %). Hay 11 artículos que analizan la resistencia antimicrobiana de S. Pneumoniae, la prevalencia de PNSP se encuentran en el rango de 0 % a 95,7 %. Los aislados son muy resistentes a eritromicina, clindamicina, tetraciclina y trimetoprima-sulfametoxazol, son resistentes a penicilina en meningitis neumocócica pero son sensibles a penicilina en otras enfermedades neumocócicas, además, son muy sensibles a levofloxacina, vancomicina y Linezolid.
CONSIDERACIONES FINALES
En el presente estudio, la mayoría de los estudios incluidos son unicéntricos, Los estudios multicéntricos,(11,19,21,23) no fueron diseñados como un programa de vigilancia nacional. Debe tenerse en cuenta que muchos de estos estudios utilizaron muestra de tamaño pequeño (promedio 228, rango 29-903), con rangos de edad que difieren de un estudio a otro. Un estudio demostró las diferencias significativas en los serotipos y la resistencia antimicrobiana de S. pneumoniae en diferentes regiones.(27) Una revisión sistemática mostró que los serotipos más comunes en todo el mundo son 1, 5, 6A, 6B, 14, 19F y 23F.(28) Según un metaanálisis publicado en el año 2018, los serotipos dominantes en China son 19F, 19A, 23F, 14 y 6B,(29) en otros países asiáticos como Malasia e India donde las PCV no se han incluido en el PVI, también hay un predominio de serotipos vacunales. En Malasia, la distribución de serotipos más comunes son 14, 6B, 19A, 6A y 19F.(30) En India, los serotipos neumocócicos más frecuentes que causan ENI en los niños de 5 años son 14, 1, 19F, 6B, 5, 6A, 9 V y 23F.(31)
La distribución de serotipos y la resistencia antimicrobiana de S. Pneumoniae no solo varían según la geografía, sino también por el diagnóstico de los pacientes y la cobertura de vacunas antineumocócicas en la población. La OMS publicó en 2017 una lista de patógenos prioritarios resistentes a los antibióticos, PNSP se incluye en las 12 bacterias más peligrosas para la salud humana.(32) En el estudio de Shi W,(11) la prevalencia de PNSP en los aislados de meningitis fue del 95,7 %; sin embargo, los aislados de ENI no meningitis mostraron 0 % de PNSP. Los aislados no meningitis fueron sensibles a penicilina y ceftriaxona. Sin embargo, los aislados de meningitis mostraron alta resistencia a penicilina y ceftriaxona.(20) Además, las prevalencias de los aislados de ENI no susceptibles a eritromicina, penicilina, meropenem, cefotaxima y clindamicina fueron significativamente más altas que las de los aislados de CNF.(15)
En este estudio, los artículos incluidos indicaron que los aislados de S. pneumoniae siguen siendo muy resistentes a eritromicina, clindamicina, tetraciclina y trimetoprima-sulfametoxazol, pero son muy sensibles a levofloxacina, vancomicina y Linezolid, que coincide con los resultados de la CHINET en 2017 y 2019.(33,34)Según los resultados del programa de vigilancia antimicrobiana SENTRY,(35) la susceptibilidad de S. pneumoniae a muchos antibióticos aumentó en todas las regiones en los últimos años, y estos podrían estar relacionados con la inmunización de las PCV. Antes del uso generalizado de las PCV, los serotipos 1, 5 y 14 representaban el 28-43 % de los casos de enfermedad neumocócica invasiva en niños menores de 5 años en todo el mundo, los serotipos 19F y 23F eran responsables del 9-18 % de los casos a nivel mundial.(28) En Australia, Canadá, Inglaterra y Gales, Sudáfrica y EE. UU, la introducción de la PCV7 fue seguida de una rápida reducción de la enfermedad causada por los serotipos incluidos en la misma vacuna (serotipos vacunales) y un posterior aumento de la incidencia de las enfermedades causadas por otros serotipos (serotipos no vacunales), este fenómeno se denomina "sustitución de serotipos".(2)
La reducción significativa de los serotipos vacunales de S. pneumoniae en la CNF coincidió con los hallazgos de otros estudios y refleja la eficacia de la inmunización.(36, 37) El gobierno local de Hong Kong incluyó la PCV13 en el PVI desde 2011. Chan KCC,(21) indicó que tras un año de introducción de la PCV13 en el PVI, la mayoría de los neumococos circulantes entre los niños sanos de Hong Kong eran serotipos no vacunales. Se han comunicado resultados similares en estudios de otros países como Japón e Inglaterra.(37,38) En China continental la PCV13 se autorizó para su uso opcional en 2016, pero todavía no se incluye en el PVI, las investigaciones realizadas en esta región demostraron que los serotipos más comunes fueron los serotipos vacunales,(39,40,41) según los resultados de los estudios incluidos, en la región continental de China, todavía no ha aparecido sustitución de serotipos. Al igual que la situación de Malasia, donde los serotipos vacunales son los más comunes en niños.(30)
Con la presente revisión de los artículos publicados en los últimos seis años, fue posible mapear la evidencia científica existente en la distribución de serotipos de neumococos y resistencia antimicrobiana en población pediátrica de China. La PCV13 tiene alta cobertura en los serotipos de S. pneumoniae en los niños de China continental, por eso recomienda la inclusión de la PCV13 en el PVI, al mismo tiempo, se debe tener en cuenta la aparición de la sustitución de serotipos. Por eso, se deben incluir más pacientes pediátricos o niños en las investigaciones, especialmente los niños menores de 5 años. Es necesaria una vigilancia de alta calidad a largo plazo sobre la distribución de serotipos y resistencia antimicrobiana de S. Pneumoniae para el desarrollo de la prevención de enfermedades neumocócicas.
Conflicto de intereses
Los autores plantean que no existe conflicto de intereses.
Contribuciones de los autores
Conceptualización: María Eugenia Toledo Romaní, Xu Han.
Curación de datos: Xu Han.
Análisis formal: Xu Han, Haiyang Yu.
Investigación: Xu Han, Haiyang Yu, Niurka Molina Águila.
Metodología: Niurka Molina Águila, Xu Han.
Administración del proyecto: María Eugenia Toledo Romaní.
Recursos: María Eugenia Toledo Romaní, Xu Han.
Software: Xu Han, Haiyang Yu.
Supervisión: María Eugenia Toledo Romaní.
Visualización: Xu Han.
Redacción – borrador original: Xu Han, Haiyang Yu.
Redacción – revisión y edición: María Eugenia Toledo Romaní.
Financiación
Instituto de Medicina Tropical Pedro Kourí. La Habana, Cuba.