INTRODUCCIÓN
Ante el resultado de un estudio de laboratorio, sea positivo o negativo, siempre se impone la pregunta acerca de su significación para el diagnóstico de la enfermedad o condición que se investiga. En esa valoración, es imprescindible tomar en consideración las características sobre la validez interna de la prueba, que incluyen, entre otras, a la sensibilidad y la especificidad diagnósticas.(1,2)
La capacidad de una prueba para detectar la enfermedad en estudio se conoce como la sensibilidad diagnóstica; por su parte, la especificidad es la capacidad del ensayo para identificar aquellos que no tienen la enfermedad. Estos atributos son útiles para decidir el momento en que deben utilizarse los ensayos, o conocer el significado del resultado de una prueba en un paciente en particular.(3)
En el momento de escribir este artículo, varios estudios de laboratorio están disponibles para el diagnóstico del virus SARS-CoV-2, agente de la COVID-19. Estos se clasifican en dos grupos, de acuerdo a sus métodos de ensayos. En uno se sitúan aquellos que utilizan técnicas moleculares; y en el otro, los que emplean métodos serológicos.(4)
Las técnicas moleculares incluyen los métodos de laboratorio que aplican la reacción en cadena de la polimerasa o PCR (por sus siglas en inglés), para amplificar y detectar ácidos nucleicos virales del SARS-CoV-2 en distintas muestras biológicas clínicas. Estas son consideradas como el método de referencia (gold standard) para el diagnóstico de COVID-19.(4)
Las pruebas serológicas utilizan métodos de inmnoensayos en diferentes formatos para descubrir anticuerpos, antígenos o ambos. Dentro de este grupo se encuentran los enzimoinmunoensayos, los quimioluminiscentes y los inmunocromatográficos de flujo lateral, los cuales detectan proteínas virales o anticuerpos dirigidos contra el SARS-CoV-2. Además, se incluyen en este grupo las técnicas que utilizan la detección de anticuerpos neutralizantes, que evalúan la capacidad funcional de los anticuerpos séricos para evitar la infección del virus in vitro.(4,5,6)
Los ensayos inmunocromatográficos de flujo lateral para estudiar esta entidad, comúnmente reconocidos como pruebas rápidas, han ganado amplia aceptación debido a la simplicidad de su diseño, facilidad para transportar y almacenar; no requieren de equipamiento, instalaciones especiales, ni de personal especializado, además de aportar tiempos de respuesta muy breves, generalmente pocos minutos.(6)
Estas características las convierten en pruebas muy atractivas para el manejo y monitorización de los pacientes, puesto que propician un diagnóstico precoz y mayor efectividad en la estrategia epidemiológica, siempre orientada a interrumpir la cadena de transmisión a un menor costo.(4,5)
Sin embargo, estas pruebas rápidas poseen diferentes grados de sensibilidad, especificad diagnóstica y valores predictivos. De ahí, que sea importante, al utilizarlas en la práctica clínico-epidemiológica, conocer la probabilidad de que el resultado sea confiable.
El presente trabajo pretende evaluar el desempeño analítico de pruebas rápidas para detectar anticuerpos IgG/IgM anti COVID-19 en las condiciones concretas del sistema sanitario de Cienfuegos.
MÉTODOS
Se realizó un estudio descriptivo, con los pacientes (n=410) que ingresaron en el Centro Especializado Ambulatorio (CEA) Héroes de Playa Girón, de Cienfuegos, con diagnóstico presuntivo, probable o confirmado de COVID-19, durante dos períodos de tiempo: 1) 1ro. de marzo hasta el 31 mayo del 2020: todos los pacientes ingresados con criterio de sospecha de COVID-19, asintomáticos; 2) 6 de enero hasta el 30 de abril del 2021: todos los pacientes ingresados confirmados con COVID-19, sintomáticos.
Se obtuvo información mediante la revisión documental de las historias clínicas y los registros de trabajo de los laboratorios del CEA y de Biología Molecular, del Centro Provincial de Higiene, Epidemiología y Microbiología de Cienfuegos.
Técnicas analíticas
Ensayo serológico (prueba rápida): Inmunoensayo de captura para la determinación de anticuerpos IgG/IgM anti SARS-CoV-2 en sangre total, suero y plasma humano, basado en el método de flujo lateral, donde la muestra es adsorbida por capilaridad en el casete, y mezclada con un antígeno desecado unido a un conjugado. Cuando el nivel de anticuerpos en la muestra se encuentra por encima del nivel de detección, el complejo antígeno conjugado-anticuerpo es capturado por un anticuerpo IgG inmovilizado en la región T del casete, produciendo una banda coloreada que indica un resultado positivo. Para la evaluación de este ensayo fueron utilizados los diagnosticadores Assut Europe (Roma, Italia), LUNGENE (Hangzhou Clongene Biotech, Ltd. China) y Wondfo (Guangzhou Wondfo Biotech, Ltd. China).(7,8,9)
Ensayo de biología molecular: Reacción en cadena de la polimerasa en tiempo real con transcriptasa inversa (RT-PCR) multiplex para la detección cualitativa directa del ARN del coronavirus SARS-CoV-2. Las secuencias diana amplificadas se detectan mediante sondas de hidrólisis marcadas con un colorante fluorescente indicador (fluoróforo). El indicador emite una señal fluorescente que se detecta en la unidad óptica del equipo de lectura. Se utilizó el estuche diagnóstico RIDA®GENE SARS-CoV-2.(10)
Toma de muestra: para el ensayo serológico se utilizó sangre total obtenida por punción capilar, y para el PCR se usó muestra de exudado nasofaríngeo.
Se calcularon la sensibilidad y especificidad diagnóstica, el valor predictivo positivo (VPP) y valor predictivo negativo (VPN) y eficiencia de la prueba dentro de un intervalo de confianza del 95 % a partir de los datos primarios insertados en tabla de contingencia 2 x 2.(1,2) (Tabla 1).
Donde:
a: número de muestras positivas en ambos ensayos: prueba rápida y prueba de referencia (verdaderos positivos: VP).
b: número de muestras positivas en la prueba rápida y negativas en la prueba de referencia (falsos positivos: FP).
c: número de muestras negativas en la prueba rápida y positivas en la prueba de referencia (falsos negativos: FN).
d: número de muestras negativas en ambos ensayos: prueba rápida y prueba de referencia (verdaderos negativos: VN).
RESULTADOS
La edad promedio de los pacientes incluidos (n=410) fue de 53 años ± 27,73 (edad mínima 2 años y edad máxima 97 años), con ligero predomino del sexo femenino (n 210 (51,3 %).
Del total de individuos estudiados, 52 presentaron una prueba rápida positiva; distribuidos según clases de inmunoglobulinas IgM e IgG: 41 y 2 pacientes positivos de forma respectiva y para ambas clases 8. De todos ellos, la fracción de verdaderos positivos quedó conformada por 48 que fueron clasificados correctamente como tal para ambas pruebas (cuatro pacientes falsos positivos con prueba rápida positiva y confirmatorio negativo). La fracción de verdaderos negativos quedó conformada por 318 personas, a partir de 358 con resultados negativos en el examen serológico (40 falsos negativos con prueba rápida negativa y prueba confirmatoria positiva).
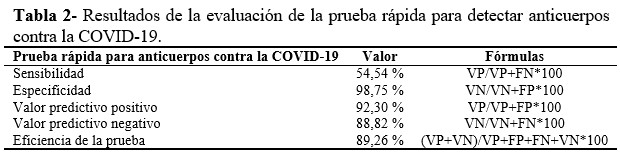
Se obtuvo una excelente especificidad (98,75 %) y regular sensibilidad (54,54 %), así como buenos valores predictivos y eficiencia diagnóstica global. (Tabla 2).
DISCUSIÓN
La especificidad mostrada (98,75 %) está en correspondencia con la reportada por la literatura interna de los fabricantes y la reportada por otros autores.(6,7,8,9,11) En este sentido, fueron identificados cuatro pacientes como falsos positivos, relacionado directamente con la especificidad diagnóstica del ensayo, y expresado, además, a través del valor predictivo positivo.(12)
Esta condición de falsa positividad en pruebas serológicas para enfermedades infecciosas podría ser consecuencia de la presencia de sustancias interferentes presentes en la muestra; o de la reactividad inespecífica o cruzada debido a diversas condiciones médicas, como la presencia de otros coronavirus circulantes, inmunizaciones recientes, hepatopatías, enfermedades autoinmunes, enfermedades alérgicas, hipergammaglobulinemias, anticuerpos polirreactivos no específicos; o bien a la presencia de anticuerpos heterófilos, entre otras causas.(13) Además, se incluyen en este apartado los pacientes convalecientes de la enfermedad con prueba negativa de biología molecular y anticuerpos circulantes como respuesta inmune contra el virus.
La falsa positividad es relativamente menos grave que la falsa negatividad, desde el punto de vista del manejo clínico-epidemiológico de los enfermos y del control de la enfermedad en la población. No obstante, un resultado positivo de COVID-19 en un individuo sano conlleva a molestias innecesarias que generan el aislamiento, estudios de contactos; todo ello con una repercusión psicológica, económica y social para el individuo afectado y su familia.(12)
La sensibilidad observada (54,54 %) indica que cerca de la mitad de las personas infectadas (sintomáticas o asintomáticas) por el SARS-CoV-2 incluidas en el estudio, mostraron erróneamente resultados negativos a la prueba rápida de anticuerpos IgG/IgM anti COVID-19. Esta categoría de falsos negativos se encuentra relacionada directamente con la sensibilidad diagnóstica del ensayo, y expresada además a través del valor predictivo negativo; por lo que un resultado negativo de la prueba rápida no descarta la presencia de la enfermedad.(1,2,12)
Para explicar este nivel de sensibilidad, hay que referirse a la dinámica de la respuesta y producción de los anticuerpos durante las diferentes fases de la infección por el SARS-CoV-2. Aunque es un aspecto que aún no está completamente dilucidado para esta enfermedad, se plantea que la inmunoglobulina M (IgM) proporciona la primera línea de defensa, antes de la generación de una respuesta de inmunoglobulina G (IgG) de alta afinidad, la cual es importante a largo plazo en la inmunidad y memoria inmunológica.(14)
Existen estudios donde se analiza la respuesta de anticuerpos anti-SARS-CoV-2 en infecciones recientes; la mayoría de estos informan una respuesta inmune caracterizada por un incremento en los títulos de anticuerpos específicos después de la segunda o tercera semana de evolución de los síntomas.(14)
En uno de los estudios realizados en China, los niveles de inmunoglobulinas anti COVID-19 se comenzaron a detectar en los primeros siete días de la enfermedad, y aumentaron rápidamente durante la segunda semana. La seroconversión tuvo lugar en un tiempo promedio de 11 días para anticuerpos totales,12 días para IgM y 14 días para IgG.(15)
En otra investigación de cinética viral y respuesta de anticuerpos en enfermos con COVID-19, la IgM frente a la proteína N del SARS-CoV-2 se detectaba al séptimo día, y el punto máximo se alcanzaba en el día 28 con una disminución a partir del día 42; mientras que la IgG se detectó al décimo día con un máximo al día 49 tras la aparición de los síntomas.(16) Aunque algunos autores han reportado que la seroconversión, tanto para la immunoglobulina G (IgG) como para la immunoglobulina M (IgM) ocurre simultáneamente, comportamiento considerado como inusual, por el Centro de Prevención y Control de Enfermedades (CDC por sus siglas en inglés).(6)
En un estudio realizado en Francia con un grupo de pacientes con resultados positivos al PCR-COVID-19, evaluó de forma evolutiva el desempeño analítico de un ensayo rápido para anticuerpos IgM/IgG anti COVID-19. Los autores observaron que, a medida que transcurrían los días de evolución de la enfermedad, la sensibilidad diagnóstica del ensayo mostraba valores crecientes en correspondencia a la cinética de anticuerpos de la enfermedad (sensibilidad diagnóstica de 10 % en los primeros cinco días; 58 % entre sexto y décimo días; 63 % entre los 11 a 15 días; y 100 % después de esa fecha).(11)
De acuerdo con la literatura interna de las pruebas rápidas de anticuerpos IgG/IgM anti COVID-19,(7,8,9) un resultado negativo indica que los anticuerpos contra el virus no están presentes o sus niveles no son detectables por el ensayo. De acuerdo a la cinética viral y a la respuesta de anticuerpos en enfermos con COVID-19 descrita con anterioridad, la diferencia entre la sensibilidad reportada por los fabricantes (87,01 %), y la calculada en la presente investigación, puede radicar precisamente en el momento de la realización del ensayo en los pacientes estudiados.
El desempeño diagnóstico global de la prueba expresada por medio de la eficiencia diagnóstica, garantiza que el 89,26 % de los individuos será correctamente clasificado con el empleo de las pruebas rápidas para la detección de anticuerpos contra el SARS-CoV-2.
No obstante, se recomienda que estos ensayos serológicos no deben ser usados para descartar un caso durante los primeros días de enfermedad. Asimismo, la detección de anticuerpos después del día siete solo indica contacto previo con el virus, pero no dice nada respecto a la presencia y excreción del virus. Los anticuerpos así detectados podrían resultar de una infección previa y no de la infección aguda para la cual se está requiriendo el diagnóstico.(6)
Aunque los fabricantes de estas pruebas indiquen que los ensayos poseen una excelente sensibilidad y especificidad ─nunca igual a 100 % porque el ensayo ideal no existe─, en muchos casos la realidad es bastante distinta. Un aspecto es la capacidad diagnóstica del test, es decir, del reactivo, y otra la capacidad diagnóstica del proceso completo, el cual no está exento de fallos, en ocasiones subvalorados por la simplicidad en la ejecución de las pruebas rápidas.(12,13)
Tanto la sensibilidad como la especificidad diagnóstica pueden ser afectadas por problemas preanalíticos relacionados con la toma de muestras, así como su manejo e identificación, por dificultades analíticas durante la ejecución del ensayo, las cuales afectan su calidad; y debido a errores posanalíticos en la confección del informe del ensayo, la transcripción de resultados, entre otros.(2,12,13)
Sobre la base de las consideraciones anteriores, los ensayos de pruebas rápidas no deben ser usados para descartar la enfermedad por su valor predictivo negativo bajo, pero son útiles para confirmarla, ya que poseen un valor predictivo positivo bueno. La combinación de la prueba RT-PCR y la detección de anticuerpos específicos logra un aumento significativo en la sensibilidad para hacer un diagnóstico patogénico de la COVID-19.(14)
Recientes estudios han indicado la presencia de falsos negativos en los ensayos de PCR como consecuencia de la baja carga viral en períodos iniciales de la enfermedad, o de la degradación del material viral en las muestras de exudados.(17,18) No obstante, estos métodos de biología molecular, son considerados como “gold standard” para el diagnóstico de COVID-19.(4)
Es preciso definir que está consensuado que la sensibilidad, la especificidad, el VPN y el VPP con valores mayores o iguales al 95 %, sean catalogados como excelente, mientras que valores entre un 80 % y un 94 % se consideren como buenos; la categoría regular está reservada para valores entre 50 % y 79 %; y la mala para menor del 50 %.(19)
Por todo lo anterior, se ha recomendado que durante el curso de la pandemia la utilidad de las pruebas rápidas para la detección de anticuerpos contra SARS-CoV-2 en la práctica clínica-epidemiológica, se encuentre limitada para las siguientes situaciones:(6,14)
1. Investigaciones epidemiológicas de prevalencia de la enfermedad en la comunidad y la definición de tasa de transmisión local.
2. Estudios de contagio en poblaciones de riesgo aumentado.
3. Identificación de portadores asintomáticos o en pacientes con baja carga viral, por debajo del límite de detección de los ensayos de PCR, o cuando no sea posible obtener muestra del tracto respiratorio.
4. Selección de donantes de plasma convalecientes para la preparación del suero convaleciente hiperinmune.
Los inmunoensayos para la detección rápida de anticuerpos IgG/IgM contra la COVID-19 mostraron un desempeño diagnóstico adecuado. Constituyen una alternativa diagnóstica asequible y valiosa para evaluar exposición previa al SARS-CoV-2. Su uso clínico está restringido para ciertas situaciones médicas, no obstante, son una herramienta epidemiológica muy útil. En el futuro, cuando existan mayores evidencias sobre la cinética viral y la respuesta de anticuerpos en esta infección, estos ensayos rápidos podrían resultar de mucha utilidad para evaluar la respuesta a la vacunación.
Conflicto de intereses:
Los autores declaran que no existen conflictos de intereses para con el estudio, ni sus resultados.
Contribuciones de los autores:
Conceptualización: Pedro Sánchez Frenes, Dayamí García Torres.
Curación de datos: Pedro Sánchez Frenes, Dayamí García Torres, Gippsy Mendoza Cartaya, Mavis Portela Sánchez.
Investigación: Pedro Sánchez Frenes, Dayamí García Torres, Dayamí García Torres, Gippsy Mendoza Cartaya.
Metodología: Pedro Sánchez Frenes, Dayamí García Torres, María de Jesús Sánchez Bouza.
Validación: Pedro Sánchez Frenes, Dayamí García Torres, Gippsy Mendoza Cartaya.
Visualización: Pedro Sánchez Frenes
Redacción – borrador original: Pedro Sánchez Frenes, Dayamí García Torres, Gippsy Mendoza Cartaya, Mavis Portela Sánchez, María de Jesús Sánchez Bouza.
Redacción – revisión y edición: Pedro Sánchez Frenes, Dayamí García Torres, Gippsy Mendoza Cartaya, Mavis Portela Sánchez, María de Jesús Sánchez Bouza.
Financiación:
Centro Especializado Ambulatorio Héroes de Playa Girón, Cienfuegos
Centro Provincial de Higiene, Epidemiología y Microbiología de Cienfuegos