INTRODUCCIÓN
Los virus de Marburgo y Ébola pertenecen a la familia de los Filoviridae que producen infecciones víricas agudas en humanos con una elevada mortalidad. Ambos virus presentan diferencias antigénicas y genéticas. La letalidad por el virus del Ébola oscila entre el 50 y el 90 %, mientras que el virus del Marburgo alcanza tasas de letalidad entre el 25 y el 80 %, un poco menos que el del Ébola.1
Las epidemias suelen empezar con un único caso, que lo adquiere a partir de un reservorio desconocido en la naturaleza, probablemente un murciélago, y se propagan fundamentalmente por contacto estrecho con los enfermos o sus líquidos corporales en las casas, los hospitales o los funerales. Tanto el virus del Ébola como el Marburgo requieren de un nivel de bioseguridad cuatro, por su alto poder para infectar y su gran letalidad.
El virus del Ébola posee cinco serotipos fáciles de distinguir, conocidos por el lugar donde fueron identificados por primera vez (Zaire, Sudán, Costa de Marfil, Bundibugyo y Reston).2 A excepción del subtipo Reston, todos los miembros de la familia Filoviridae son virus africanos capaces de provocar una enfermedad grave y a menudo letal en el ser humano. El serotipo Reston, que ha sido exportado desde Filipinas en varias ocasiones, ha causado infecciones letales en monos, pero solo ha producido infecciones subclínicas en el humano.3
Los estudios realizados desde su descubrimiento en la década de los 70 muestran una notable conservación de su secuencia para los cinco serotipos del Ébola, dato que indica una acusada estabilidad genética. Las partículas típicas del filovirus contienen un único RNA monocatenario de polaridad negativa y lineal, dispuesto en una nucleocápside helicoidal.4
El material genético tiene 19 Kb de longitud y codifica para siete proteínas estructurales. La nucleocápside contiene las proteínas NP, que forma parte de la estructura y la proteína L, con función de ARN polimerasa, indispensable para la replicación viral. La cápside está compuesta por la proteína estructural VP30 y la glicoproteína (GP) necesaria para la entrada a la célula hospedara. Las proteínas VP24 y VP40 forman una matriz que mantiene unidos el nucleoide con la cápside.4
Los viriones tienen un diámetro de 80 nm y una longitud que puede alcanzar los 14 000 nm. Por microscopía electrónica suele observarse como un filamento que puede presentarse de forma alargada y retorcida. La cubierta lipídica los hace sensibles a los disolventes de las grasas y a los detergentes comunes. Los virus pueden persistir durante semanas en la sangre a temperatura ambiente.3
La GP asociada a la superficie del virión es un trímero formado por los heterodímeros GP1/GP2, a la que se atribuye ser la mediadora de la unión a las células y su fusión a estas. Estas GPs ricas en azúcares parecen contribuir a la resistencia del virus a los anticuerpos neutralizantes que poseen los individuos afectados en comparación con otras enfermedades virales.5
Estudios in vitro donde se ha inducido la expresión de las GPs del virus del Ébola en adenovirus, han mostrado que estas juegan un papel crucial en la disregulación inflamatoria, la supresión del sistema inmune y la pérdida de la integridad vascular. En resumen el estudio demuestra que las glicoproteínas virales provocan la elevación de los microRNA (miRNA) que actúan disminuyendo la expresión de los genes que codifican para las estructuras de adhesión celular, lo que contribuye con el daño de la pared vascular, el aumento de la permeabilidad vascular y la extravasación de líquido.2
Las células infectadas in vitro expresan una forma de la GP viral, que porta muchos de sus determinantes antigénicos y es secretada a la circulación de los enfermos. Esta GP truncada que se libera a la circulación y al espacio extracelular suprime la respuesta inmune desarrollada ante la proteína de superficie del virus y bloquea así los mecanismos efectores antivirales.6,7
Recientemente la humanidad se enfrentó al brote de Ébola más largo de la historia que afectó a varias naciones centroafricanas desde marzo del 20148 y constituyó una emergencia sanitaria mundial.9 A pesar de los numerosos esfuerzos de la comunidad mundial en contener la epidemia10 no se logran aún resultados totalmente positivos.11 Hasta el momento los pacientes sobreviven a expensas de su sistema inmune. Es por ello, que se realizó la presente revisión bibliográfica con el propósito de resumir los principales aspectos relacionados con las particularidades de la respuesta inmune durante la infección por el virus del Ébola, para lo cual se accedió a la base de datos bibliográfica PubMed/Medline usando los términos: ebolavirus; ebolavirus and immune response, ebolavirus and evasión to immune response. Se incluyeron aquellos artículos de menos de cinco años de publicados, de acceso abierto. La fuente original se encontraba mayoritariamente en idioma inglés por lo cual se realizó la traducción de los artículos para su posterior análisis y uso en la actual publicación.
DESARROLLO
En los humanos y en los modelos animales, los virus de Ébola y Marburgo se replican bien en casi todos los tipos celulares, incluidas las células endoteliales, los macrófagos y las células parenquimatosas de numerosos órganos. El blanco inicial es el sistema fagocito mononuclear. Una vez aumentados los títulos de viriones, las células parenquimatosas y los fibroblastos pueden servir como sitios de replicación viral.12
La entrada del virus a la célula es por un mecanismo de micropignositosis en regiones de membrana ricas en colesterol. Estudios in vitro demostraron que el virus se une a la proteína ligadora de manosa (BLM) gracias a las azúcares presentes en las GPs. Esta unión a la BLM es indispensable para la unión del virus a los receptores de leptina tipo C expresados en la superficie celular; lo que favorece el posterior proceso de micropignositosis.13
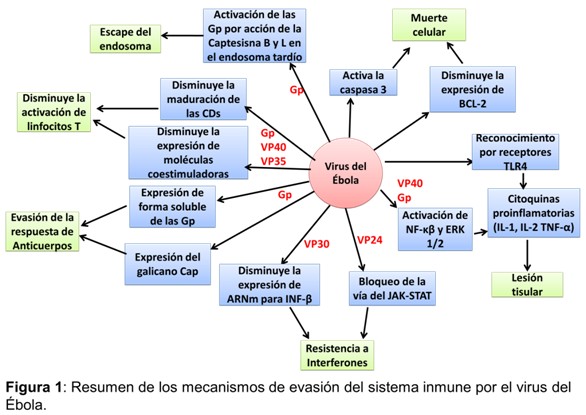
Las GPs del virus se sintetizan de forma inactiva y requieren la acción proteolítica de las enzimas de las células del hospedero. Se ha demostrado que esta proteólisis es catalizada por la catepsina B y L, enzimas que se localizan en la pared del endosoma tardío.14 La GP es crítica en la entrada del virus a la célula del hospedero15 y la activación proteolítica ocurre una vez que la partícula viral es internalizada por el macrófago.14
La replicación vírica se asocia con la necrosis celular, tanto in vivo como in vitro, por lo que es un virus citopático. Entre los hallazgos importantes en la microscopia óptica se incluyen la necrosis hepática con cuerpos de Councilman (inclusiones intracelulares que guardan relación con amplias acumulaciones de nucleocápsides víricas), la neumonitis intersticial, los nódulos gliales en el cerebro y los pequeños infartos.12
Estudios por citometría de flujo demostraron que del 30 al 40 % de las células infectadas por el serotipo de Ébola Zaire ocurre una activación de la caspasa 3, y existen bajos niveles de la molécula antiapoptótica BcL2 hacia el día ocho de la primoinfección. Del 60 al 70 % de los macrófagos han muerto hacia ese día, por otro lado los linfocitos T muestran activación de las vías de señales del Fas/FasL. La infección viral es capaz de producir una muerte masiva de los linfocitos y los macrófagos al finalizar la primera semana de la primoinfección.16
Además de la lesión directa por la infección vírica, los pacientes infectados por el virus del Ébola (subtipo Zaire) tienen altos niveles circulantes de citocinas proinflamatorias, esta tormenta de citoquina contribuye a la gravedad de la enfermedad. El reconocimiento de la partícula viral a través de los receptores TLR4 desencadena la liberación masiva de citocinas.17
Estudios recientes han demostrado que los pacientes con infección por Ébola muestran una sobreactivación de los monocitos y los macrófagos los cuales liberan grandes cantidades de IL-1, IL-2, TNF-α e interferón tipo I. Estudios con diversos antígenos virales han demostrado su capacidad para interactuar con el TLR4 e inducir la expresión de genes para citocinas proinflamatorias; tal es el caso de las GPs.18
Otro estudio describe como las proteínas virales VP40 y GP producen una activación incompleta de las células dendríticas; esto ocasiona un fallo en la activación de los linfocitos T. Sin embargo esta proteína es capaz de activar los factores de transcripción NF-κβ y ERK1/2 involucrados en la producción de citoquinas proinflamatorias.19
El factor de crecimiento transformante beta (TGF-β) es una citocina que modula específicamente la infección del hepatocito. Las células infectadas por Ébola secretan TGF-β, esta citocina, además de su efecto inmunosupresor, está involucrada en la transición epitelial mesenquimal. Un estudio experimental demostró que el TGF-β favorece la rotura de las uniones adherentes en los vasos sanguíneos cercanos, por desregulación en la expresión de moléculas de adhesión; esto favorece la lesión endotelial.20
Por otra parte, la proteína viral VP24 es capaz de unirse a uno de los mediadores químicos involucrados en la vía de Jak-STAT,21 lo que bloquea la acción del factor de transcripción STAT1, responsable de la respuesta antiviral. De esta forma se ha comprobado en modelos murinos que la VP24 no solo es capaz de inhibir la acción del IFNα y el IFNβ, sino que disminuye además, la expresión de IFN-γ citocina involucrada en la respuesta Th1, propio de las defensas antivirales.22
La VP35 reprime la producción del ARNm para el IFN β. Esta acción es similar a la de la proteína NS de la influenza.23 De hecho el virus del Ébola es resistente a los efectos antivirales de los interferones tipo I.3,6 El efecto conjunto de estas proteínas confieren virulencia al virus al evadir la respuesta inmune antiviral.
El Ébola es capaz de interferir con la activación y la diferenciación de las células dendríticas, siendo este otro mecanismo para interferir con la respuesta inmune. Se ha demostrado en distintos experimentos in vitro que las proteínas VP35 y la VP40 presentan dominios antagonistas de la respuesta inmune. La acción conjunta de estos dominios es responsable de la inhibición de la maduración de las células dendríticas. Además, disminuye los niveles de moléculas coestimuladoras como el CD80 y el CD86. También antagoniza con la formación de clúster, indispensables para el intercambio de antígenos.24 Por tanto, las acciones de la VP35 y la VP40 inhiben la presentación de los antígenos y consecuentemente, la activación de los linfocitos T vírgenes como parte de la respuesta celular a la infección.
La inmunidad humoral también se encuentra afectada en la infección por el virus del Ébola. Se ha demostrado que la IgM contra el virus se hace detectable después de la segunda semana y los niveles permanecen elevados hasta dos meses después de la infección. Por su parte, los niveles de IgG se hacen detectables entre los 15 y 20 días después de los primeros síntomas y pueden mantenerse elevados por años después de la recuperación de la enfermedad.25
La mayoría de la inmunorreactividad de los sueros obtenidos de 54 sobrevivientes del brote del Ébola de Gulu en Uganda durante 2000 al 2001 fueron frente a las proteínas virales NP y GP1-649. Los títulos de anticuerpos permanecieron detectables a los dos y diez años de la infección, pero el número de pacientes positivos disminuye con los años. Sin embargo, en un grupo de 12 víctimas solo cuatro muestran anticuerpos frente al virus.4 Este estudio demuestra que la respuesta inmune humoral es un factor a considerar en el pronóstico de los enfermos.
Sin embargo estudios de la GP de la superficie del virus han mostrado que un glicano que se encuentra en la subunidad GP1 denominado cap está involucrado en los mecanismos de evasión de la respuesta de anticuerpos. Este glicano ha demostrado, mediante experimentación in vitro, que además de estar involucrado en la eficiencia de la entrada del virus a la célula, protege a la GP de superficie de la acción neutralizante de los anticuerpos.5
Contradictoriamente, otros estudios demostraron que el suero de un grupo de sobrevivientes del Ébola presentaba niveles de IgG reactiva frente a la proteína viral GP1-649 con actividad neutralizante a los 12 años de la infección.26 Este hallazgo nos confirma que la presencia de Ac neutralizantes influye en el pronóstico de la enfermedad y que estos anticuerpos pueden persistir más de una década.
Es necesario recordar que la GP se secreta al medio por la células infectadas. Estas formas solubles de las GP constituyen un mecanismo de evasión a la respuesta humoral pues compiten con las GP virales por unión a los Ac, limitando así las acciones efectoras de las inmunoglobulinas en la partícula viral y en segundo lugar favorece la formación de inmunocomplejos circulantes. Un estudio de esta forma sérica de las GP del Ébola confirma este mecanismo de evasión del virus a la respuesta inmune humoral.7 Estos hallazgos quizás justifiquen la poca efectividad de la administración de suero de pacientes convalecientes a enfermos como intento de inmunización pasiva.
Un estudio preclínico de la administración de cocteles de anticuerpos monoclonales demostró que es capaz de proteger a primates sometidos a un reto antigénico con el virus del Ébola. Durante el estudio se corroboró que el número de sobrevivientes en el grupo tratado con el coctel fue superior a los tratados con el placebo. Al medir la respuesta inmune humoral y celular se encontró que los sobrevivientes tratados, así como los expuestos al virus mostraron niveles de respuesta lo suficientemente fuerte como para protegerlos de la infección no letal al ponerse nuevamente en contacto a las 13 semanas posteriores al primera exposición.27,28
Estudios con los anticuerpos monoclonales KZ52 (humanos); 6D8, 6D3, 13C6 (murinos) y el JP3K11 (procedente de monos) mostraron capacidad neutralizante in vitro y protegen a roedores de nuevas infecciones. Los anticuerpos KZ52 y JP3K11 actúan de manera distinta, pero su blanco es bloquear a las glicoproteínas víricas evitando así la entrada del virus a la célula.29
Basados en la importancia de las inmunoglobulinas en el pronóstico de la infección se han desarrollado estrategias vacunales contra el virus dirigidas a inducir respuesta de anticuerpos. Un candidato vacunal desarrollado por la Agencia de Salud de Canadá, utiliza proteínas recombinantes del virus. Este candidato fue probado en Guinea en abril de 2015; como resultados preliminares se constató una disminución en el número de casos confirmados de ébola en ese país después de la administración del preparado.30
En la siguiente figura se muestra un resumen de los mecanismos de evasión del sistema inmune por el Ébola.
CONCLUSIONES
La infección por el Ébola es potencialmente mortal, causada por un filovirus que se caracteriza por inducir una respuesta alterada del sistema inmune. La estructura antigénica del virus consta de glicoproteínas y proteínas que participan en la inmunopatogenia del virus. La partícula viral una vez internalizada en una célula escapa del endosoma gracias a la acción de la catepsina, lo que le permite al virus invadir la célula. Una vez infectada la célula del huésped este es capaz de activar los mecanismos de apoptosis.
El Ébola provoca una sobreexpresión de citocinas proinflamatorias. Es insensible a los efectos antivirales de los interferones y provoca la apoptosis de los linfocitos y los macrófagos. Además, disminuye las poblaciones de células dendríticas 103+, disminuye la capacidad de presentación antigénica y la activación y diferenciación de células Th1. La producción de una forma sérica de las glicoproteínas de la cápside junto a su glicosilación hace que la partícula sea resistente a la neutralización por los anticuerpos, a pesar de que en los sobrevivientes se detectan títulos de IgG específicos elevados con capacidad neutralizante. El virus del Ébola se destaca por evadir la respuesta inmune innata y adaptativa.