INTRODUCCIÓN
La obesidad se ha convertido en un serio problema de salud pública, debido a su creciente prevalencia a nivel mundial. Constituye un factor de riesgo principal para múltiples enfermedades crónicas no transmisibles tales como diabetes mellitus tipo 2, enfermedades cardiovasculares y cerebrovasculares, hipertensión arterial, dislipidemias y algunos tipos de cáncer.1
Debido a la gran similitud y homología entre el genoma de roedores y humanos, estos modelos animales son una herramienta fundamental para el estudio de condiciones morbosas que afectan a los humanos. La obesidad en animales puede ser inducida mediante manipulación genética, dietética o inducción de alteraciones neuroendocrinas. Los modelos más ampliamente utilizados para inducir obesidad en ratas son la lesión ventromedial hipotalámica, por administración de glutamato monosódico (GMS) o por lesión eléctrica directa, la ooforectomía, alimentación con dietas hipercalóricas o la manipulación genética.2 Estos últimos métodos son muy costosos.
El GMS es la sal sódica del L- ácido glutámico, un L-alfa-aminoácido. Se utiliza como aditivo en los alimentos para potenciar el sabor.3 Su administración a ratas en período neonatal produce la destrucción del núcleo arqueado hipotalámico, conduciendo a disfunción neuroendocrina y metabólica. Las ratas tratadas con GMS desarrollan hiperadiposidad, tolerancia alterada a la glucosa, hiperinsulinemia, retardo del crecimiento, que se constatan alrededor de las 12 semanas de vida. El mecanismo real por el cual la lesión hipotalámica provocada por el GMS conduce a obesidad central se desconoce. Sí se sabe que no es debido a incremento en la ingesta de comida. La acumulación grasa pudiera deberse en parte a incremento de la actividad parasimpática.2,4-8
Otros cambios debido a la ausencia de control del eje hipotálamo-pituitario-adrenal son: hipoactividad, irritabilidad aumentada, reducción del peso ovárico, pubertad tardía y elevados niveles séricos de glucocorticoides.2,5-8 También presentan hiperleptinemia y se ha demostrado disminución en la expresión del receptor de leptina al nivel cerebral y otros tejidos como las glándulas adrenales.9
El GMS es un reactivo barato. Un kilogramo del producto no excede los $150 USD, con lo cual se pudiera inducir obesidad a más de 1000 animales. Esta sustancia puede ser administrada por vía subcutánea o intraperitoneal, a la dosis de 2-4mg/g de peso corporal durante el período neonatal. Se requieren entre 4-10 dosis para inducir obesidad.2 Este trabajo tiene el objetivo de seleccionar un esquema de tratamiento adecuado para inducir obesidad con GMS en ratas Winstar en periodo neonatal.
MÉTODOS
El estudio fue realizado en los laboratorios de investigación del departamento de Bioquímica del Instituto de Ciencias Básicas y Preclínicas Victoria de Girón. Se administró glutamato monosódico a ratas Wistar en período neonatal, siguiendo tres esquemas diferentes de tratamiento (con cinco, siete y diez dosis), a 4mg/g/día, y mediante dos vías de administración: subcutánea e intraperitoneal. A los controles se les administró cloruro de sodio al 0,9 %. Para realizar el diagnóstico de obesidad, a los 90 días se evaluaron las variables: peso, longitud hocico-ano e índice de Lee. Se consideró el día del nacimiento como día cero. Se formaron los siguientes grupos para la administración de GMS y NaCL por vía intraperitoneal:
Ratas que recibieron GMS desde el primero hasta el quinto día (D5A-GMS) = 12
Ratas que recibieron NaCL desde el primero hasta el quinto día (D5A-C) =10
Ratas que recibieron GMS el segundo, cuarto, sexto, octavo y décimo día (D5B-GMS) = 12
Ratas que recibieron NaCL el segundo, cuarto, sexto, octavo y décimo día (D5B-C) =10
Ratas que recibieron GMS desde el primero hasta el séptimo día (D7A-GMS) = 13
Ratas que recibieron NaCL desde el primero hasta el séptimo día (D7A-C) = 10
Ratas que recibieron GMS desde el segundo hasta el octavo día (D7B-GMS) = 13
Ratas que recibieron NaCL desde el segundo hasta el octavo día (D7B-C) = 10
Ratas que recibieron GMS desde el primero hasta el décimo día (D10-GMS) = 8
Ratas que recibieron NaCL desde el primero hasta el décimo día (D10-C) = 6
En una segunda etapa, según los resultados obtenidos con la administración intraperitoneal del GMS, se formaron cuatro grupos para la administración de GMS por vía subcutánea a la dosis antes mencionada:
Ratas que recibieron GMS el segundo, cuarto, sexto, octavo y décimo días (D5-GMS) =8
Ratas que recibieron NaCL el segundo, cuarto, sexto, octavo y décimo días (D5-C) = 8
Ratas que recibieron GMS desde el segundo hasta el octavo día (D7-GMS) = 8
Ratas que recibieron NaCL desde el segundo hasta el octavo día (D7-C) = 8
Después del destete, las ratas fueron colocadas en número de cuatro a cinco por caja. Se mantuvieron bajo condiciones controladas de temperatura (22 ± 3°C), luz (ciclos de 12h luz/oscuridad) y humedad relativa (60± 5 %). Se les suministró agua y comida a libre demanda. Para su cuidado se siguieron los principios de la guía para el cuidado y uso de animales para la experimentación. El comité de ética de la investigación aprobó los procedimientos llevados a cabo para este estudio.
La obesidad fue evaluada a los 90 días mediante el índice de Lee, calculado por la raíz cúbica del peso corporal (g) dividido entre la longitud hocico-ano (LHA) (cm).10 Un valor igual o menor a 0,300 fue considerado como normal; mayor que 0,300, las ratas fueron clasificadas como obesas. Se determinaron otras variables tales como: peso y longitud hocico-ano y mortalidad neonatal. En los resultados se expresa la media y el error estándar (EE) para las diferentes variables. El peso, LHA y e índice de Lee, fueron analizados estadísticamente mediante la prueba no paramétrica U de Mann-Whitney. El nivel de significación estadística fue considerado cuando p<0,05.
RESULTADOS
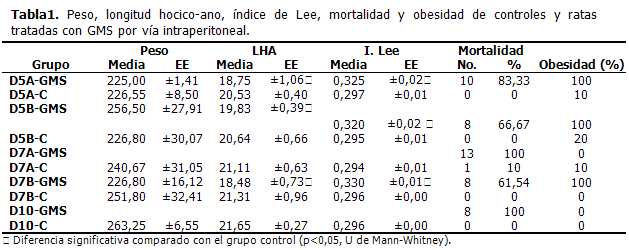
La frecuencia de muertes neonatales fue de más del 50 % cuando el GMS fue administrado intraperitonealmente siguiendo el esquema de 5, 7 y 10 dosis. En el último caso (10 dosis) fue de un 100 %.
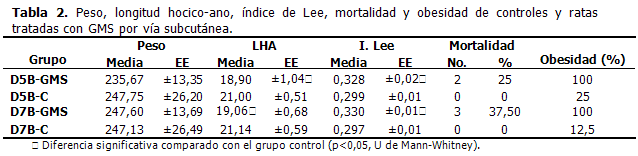
Cuando el tratamiento con GMS (intraperitoneal) fue iniciado el primer día después del nacimiento, se produjeron más muertes (D5A-GMS=83,33 %; D7A-GMS=100 %). Con respecto al comienzo en el segundo día después del nacimiento, disminuyeron las muertes (D5B-GMS=66,67 %; D7A-GMS=61,54 %). (Tabla1). El porcentaje de muertes fue inferior cuando el GMS fue inyectado por vía subcutánea, siendo más bajo con el empleo de 5 y 7 dosis (Tabla 2).
No se observaron diferencias estadísticamente significativas entre el peso de las ratas tratadas con GMS y el de las ratas a las que se les administró Na Cl 0,9% (controles). La longitud hocico-ano resultó diferente estadísticamente entre el grupo tratado con GMS y los controles, con todos los esquemas de tratamientos ensayados. También el índice de Lee fue diferente entre el grupo tratado con GMS y el grupo control. El 100 % de las ratas tratadas con GMS que alcanzaron la vida adulta, se hicieron obesas. El 13,72 % de los controles desarrollaron obesidad según índice de Lee. (Tablas 1 y 2). No hubo diferencias significativas, ni por vía intraperitoneal ni subcutánea, con respecto al índice de Lee al emplear 5 y 7 dosis.
DISCUSIÓN
Las muertes neonatales ocurridas en el grupo tratado con GMS se deben a que esta sustancia es capaz de atravesar la barrera hematoencefálica (que en este período no está completamente desarrollada), provocando agotamiento de las reservas energéticas y muerte celular, con lo cual se afectan otras funciones vitales. Todo ello interfiere con un adecuado desarrollo neonatal.11 La probabilidad de lesionar órganos vitales es mayor por la vía intraperitoneal, lo cual explicaría que el porciento de muertes haya sido elevado con la administración de GMS por esta vía.
El hecho de que no existan diferencias significativas entre el peso de las ratas inyectadas con GMS y el de los controles, se debe a que el glutamato monosódico no incrementa la ingesta alimenticia.
Se plantea que estos animales desarrollan hipofagia.2 Afifi M y colaboradores, no encontraron diferencias significativas entre el peso de ratas con obesidad inducida con GMS, preñadas y los controles.9
Las ratas tratadas con GMS resultaron ser más pequeñas que los controles. En la literatura se reporta que este producto destruye las neuronas del núcleo arqueado, al nivel del cual se produce factor liberador de la hormona del crecimiento. Lucinei obtuvo en su estudio que las ratas tratadas con GMS tuvieron una reducción del 9,5 % con relación a la longitud corporal, en comparación con los controles.4
En humanos, cuando ambos padres son obesos, el riesgo de aparición de obesidad en su descendencia es de un 80 %. En caso de que solo uno de los padres sea obeso, el riesgo se reduce a un 40 %.
Cuando ambos padres son normopesos el riesgo de obesidad es del 10 %.12 Ello pudiera aplicarse a las ratas, lo cual justificaría la aparición de obesidad en algunos controles.
Considerando que se logra desarrollar obesidad en el 100 % de las ratas, con un menor porciento de muertes, menor manipulación, y que no se obtuvieron diferencias significativas en el índice de Lee, se concluye que el modelo más apropiado es la administración del GMS a razón de 4mg/g en cinco dosis, por vía subcutánea, en días alternos, comenzando el segundo día después del día del nacimiento.