INTRODUCCIÓN
El ceftaroline es la más reciente incorporación al grupo de las cefalosporinas, se encuentra actualmente en la fase III de ensayos clínicos. (1) Algunos autores la clasifican como una cefalosporina de quinta generación, mientras otros la incluyen en una subclase especial dentro de las cefalosporinas de uso parenteral, junto al ceftobiprole, descubierto y desarrollado en años recientes. (2)
También referenciado como TAK-599 y PPI-0903, el ceftaroline se suministra por vía parenteral en forma de ceftaroline fosamil, que rápidamente es convertido a su forma activa por las fosfatasas del plasma. Es una cefalosporina de amplio espectro. Actúa frente a cepas de Staphylococcus aureus y Streptococcus pneumoniae resistentes a las penicilinas, Pseudomonas aeruginosa y enterococos. Tiene una elevada afinidad por las PBP2a (por sus siglas en inglés -Penicillin Binding Proteins) elaboradas por Staphylococcus aureus, ya que supera la resistencia de estas bacterias. (1-3) Se prueba su efectividad en el tratamiento de infecciones complicadas de la piel y estructura de la piel. Se ha evaluado su uso, in vitro, combinado con meropenem, aztreonam, cefepima, tazobactam, amikacina, levofloxacino y tigeciclina. En todos los casos se han manifestado efectos sinérgicos en la actividad antibiótica, lo que puede conducir a nuevas opciones terapéuticas. (4) El ceftaroline actúa a nivel de la pared celular de las bacterias, al igual que el resto de las cefalosporinas y los antibióticos betalactámicos en general. (5, 6) Es eliminado por excreción renal. Se refiere que es un medicamento seguro y bien tolerado por los pacientes, aunque se necesitan más estudios para determinar su eficacia y seguridad como antibiótico. (1-4)
En el presente trabajo se realiza la modelación molecular del ceftaroline. Los resultados se analizan de conjunto con los obtenidos anteriormente, especialmente para el ceftobiprole, con muchas semejanzas en su estructura química y acción farmacológica. (5)
MÉTODO
Se realizó la modelación molecular del ceftaroline, en computadoras personales IBM compatibles de la Universidad de Ciencias Médicas de Las Tunas. Se compararon los resultados con los obtenidos previamente para el ceftobiprole. (5) Se siguió la misma metodología: la estructura final se obtuvo por la optimización de la geometría molecular al aplicar cálculos semiempíricos según el modelo parametrizado 3 (PM3), (Parametric Model 3) (por sus siglas en inglés) (7) con el paquete de programas MOPAC versión 7.01.3 para Linux. (8) se calcularon las densidades de cargas naturales y los orbitales moleculares a un nivel teórico DFT / B3LYP/6-31G (d) // HF/PM3. (9) se utilizó la teoría de los orbitales de frontera de Fukui para analizar la reactividad. (10) Todos los cálculos posteriores a la optimización de la geometría se realizaron con el paquete de programas Gaussian 98 versión A.7 para Linux. (11)
RESULTADOS
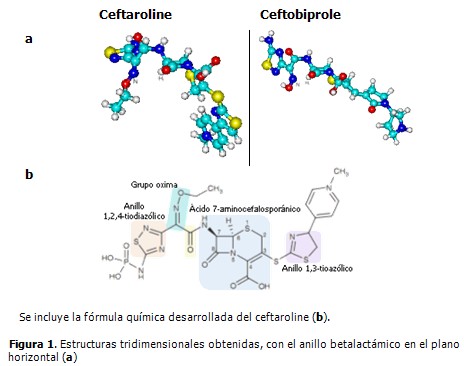
El ceftaroline optimizado tiene una estructura tridimensional menos alargada que la del ceftobiprole. Cuando el plano del anillo betalactámico está en posición horizontal, la molécula se curva hacia abajo por ambos lados, semejando un movimiento de enrollamiento. (Figura 1).
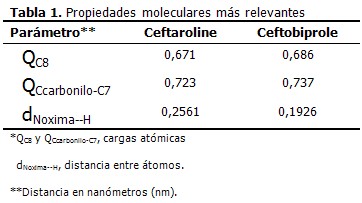
Se muestran los valores de las propiedades moleculares más significativas que surgen al comparar ceftaroline con ceftobiprole. En este último existe una débil interacción tipo puente de hidrógeno, entre el nitrógeno del grupo oxima y el hidrógeno unido al carbono C7 (distancia = 0,1926 nm), que no está presente en el ceftaroline, donde ambos átomos se alejan a 0,2561 nm. La estructura del anillo betalactámico es muy similar a la obtenida en los estudios precedentes. (5, 6, 12) (Tabla 1).
Las densidades de cargas atómicas positivas sobre los dos carbonos carbonílicos (C8 y carbonilo de la cadena amino unida a C7) del ceftaroline son ligeramente inferiores a sus equivalentes en el ceftobiprole. Al comparar ambas cefalosporinas no existen diferencias de esta propiedad en los otros átomos de la base estructural que están más relacionados con la actividad antibiótica. Los valores se corresponden con el entorno electrónico de cada átomo.
El análisis de los orbitales moleculares mostró una diferencia energética LUMO – HOMO menor a 0,2 eV., al igual que para el ceftobiprole. (5)
DISCUSIÓN
Los resultados en los ensayos clínicos en fase III, donde se prueba el uso de ceftaroline y ceftobiprole, han sido muy alentadores, en ellos se muestra el amplio espectro que poseen ambas cefalosporinas y sus reactividades frente a patógenos muy resistentes. (1-4) En sus estructuras químicas están presentes fragmentos moleculares de probada importancia en la acción farmacológica de esta familia de antibióticos. (1)
La configuración espacial que se obtuvo en el modelaje del ceftaroline tiene similitud a la reportada en el portal del Proyecto PubChem para compuestos bioactivos, generada a partir de datos obtenidos experimentalmente. (13) La molécula se dispone al formar una estructura curva, fundamentalmente debido al fragmento que contiene el grupo oxima y el anillo tiodiazólico, contiguos al grupo carbonilo de la cadena lateral en C7. La presencia de un radical etilo en el grupo oxima parece ser la causa de esta forma espacial. En el ceftobiprole, muy similar en su estructura química, el grupo oxima tiene un hidrógeno y la forma de la molécula es más alargada, estabilizada adicionalmente por un débil puente de hidrógeno entre el nitrógeno del grupo oxima y el hidrógeno del carbono C7. A pesar de la diferencia espacial entre ambas cefalosporinas, las densidades de cargas sobre los átomos más relacionados con la actividad antibiótica no difieren significativamente.
Actualmente continúan los estudios de estas dos cefalosporinas, las que han mostrado muchas semejanzas en sus propiedades farmacológicas. (1-3) Sin embargo, algunos resultados indican que ceftaroline pudiera ser menos activo frente a patógenos gramnegativos, existen investigaciones en las que se ha probado su uso combinado con otros antibióticos. (4) Ambas cefalosporinas presentan el anillo 1, 2, 4 tiodiazólico, en el sustituyente en C7, el cual se estima tiene un papel determinante en la acción frente a las bacterias gramnegativas. (1) La menor reactividad del ceftaroline puede ser consecuencia de su forma espacial. Esto refuerza lo señalado en los estudios de modelación anteriores donde se enfatizó en la importancia de que las cadenas laterales posean varios sitios para establecer interacciones electrostáticas y que estos queden lo más expuestos posibles, además de la facilidad de acceso al carbono carbonílico del anillo betalactámico. Todo ello facilita el proceso de reconocimiento molecular por las PBPs de las bacterias y la preparación de la molécula del antibiótico para formar el complejo acil-enzima. (5) El ceftobiprole reúne mejor todas estas características.
La modelación de propiedades moleculares y electrónicas realizada muestra como la introducción de un etilo en el grupo oxima del ceftaroline afecta su configuración espacial y puede estar relacionado con una disminución en su actividad frente a bacterias gramnegativas. Estos resultados aportan elementos a tener presente en la estructura química de este tipo de compuestos, donde sería recomendable que la estructura tridimensional de la molécula fuera alargada, con el menor impedimento estérico posible en los alrededores del carbono carbonílico del anillo betalactámico. Adicionalmente a las recomendaciones estructurales hechas, la metodología seguida en el trabajo, y en los precedentes, (5, 6, 12) es de fácil realización y puede ser utilizada para brindar un criterio más en la evaluación inicial de nuevos betalactámicos candidatos a convertirse en antibióticos.